名校
解题方法
1 . 光催化是新发展的一个催化技术,TiO2是目前研究成功的应用广泛的光催化剂,它是由金红石矿(主要成分为TiO2)先制备为TiCl4,再转化为纯TiO2。
请根据表中数据作答:
(1)计算反应:TiO2(s) + 2Cl2(g)= TiCl4(g) + O2(g) 298K的ΔrΗΘm和ΔrSΘm,该反应能否正向进行___________ ?
(2)计算反应2C(s) + O2(g) = 2CO(g) 298K的ΔrΗΘm和ΔrSΘm,并判据反应在298K进行的方向___________ 。
(3)为得到纯的TiCl4,有人设计如下方案:TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g ) + 2CO(g)。计算该反应298K的ΔrΗΘm和ΔrSΘm,并判据反应进行的方向___________ 。
| 物种 | TiO2(s) | TiCl4(g) | Cl2(g) | O2(g) | C(s) | CO(g) |
| ΔrΗΘm /kJ∙molˉ1 | –944.7 | –763.2 | 0 | 0 | 0 | –110.5 |
| SΘm/J∙molˉ1∙Kˉ1 | 55.02 | 354.9 | 223.1 | 205.1 | 5.74 | 197.7 |
(1)计算反应:TiO2(s) + 2Cl2(g)= TiCl4(g) + O2(g) 298K的ΔrΗΘm和ΔrSΘm,该反应能否正向进行
(2)计算反应2C(s) + O2(g) = 2CO(g) 298K的ΔrΗΘm和ΔrSΘm,并判据反应在298K进行的方向
(3)为得到纯的TiCl4,有人设计如下方案:TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g ) + 2CO(g)。计算该反应298K的ΔrΗΘm和ΔrSΘm,并判据反应进行的方向
您最近一年使用:0次
名校
解题方法
2 . 依据事实,写出下列反应的热化学方程式。
(1)N2(g)与H2(g)反应,生成1molNH3(g)时放出46.1kJ的热量:___________ 。
(2)2molN2(g)与2molO2(g)充分反应,生成NO(g)并吸收136kJ的热量:___________ 。
(3)卫星发射可用肼(N2H4)作燃料,2molN2H4(g)在足量O2(g)中燃烧,生成N2(g)和H2O(l)并放出1244kJ的热量:___________ 。
(4)已知N2(g)+2O2(g)=2NO2(g)ΔH=+67.7kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=—534kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________ 。
(1)N2(g)与H2(g)反应,生成1molNH3(g)时放出46.1kJ的热量:
(2)2molN2(g)与2molO2(g)充分反应,生成NO(g)并吸收136kJ的热量:
(3)卫星发射可用肼(N2H4)作燃料,2molN2H4(g)在足量O2(g)中燃烧,生成N2(g)和H2O(l)并放出1244kJ的热量:
(4)已知N2(g)+2O2(g)=2NO2(g)ΔH=+67.7kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=—534kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
您最近一年使用:0次
名校
解题方法
3 . 磷及其化合物应用广泛,磷元素有白磷、红磷、黑磷等单质。
(1)一定条件下,红磷在氯气中燃烧的产物有两种( 和
和 ),反应过程中的能量变化关系如图所示。回答下列问题:
),反应过程中的能量变化关系如图所示。回答下列问题:
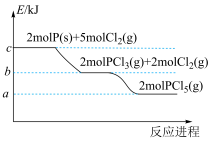
写出固态红磷在一定量的 中完全燃烧生成气态物质(
中完全燃烧生成气态物质( )的热化学方程式:
)的热化学方程式:____________________________ 。( 用图中字母表示)
用图中字母表示)
(2)白磷( )在
)在 中燃烧有如下转化关系。
中燃烧有如下转化关系。
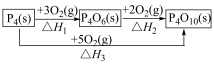
其中
_____________ (用含 和
和 的代数式表示)。
的代数式表示)。
(3)已知: (s,白磷)
(s,白磷) (s,黑磷)
(s,黑磷)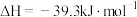 ;
;
 (s,白磷)
(s,白磷) (s,红磷)
(s,红磷)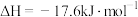 ;
;
由此推知,其中最稳定的磷单质是__________ (填“白磷”、“黑磷”或“红磷”)。
(1)一定条件下,红磷在氯气中燃烧的产物有两种(
 和
和 ),反应过程中的能量变化关系如图所示。回答下列问题:
),反应过程中的能量变化关系如图所示。回答下列问题:
写出固态红磷在一定量的
 中完全燃烧生成气态物质(
中完全燃烧生成气态物质( )的热化学方程式:
)的热化学方程式: 用图中字母表示)
用图中字母表示)(2)白磷(
 )在
)在 中燃烧有如下转化关系。
中燃烧有如下转化关系。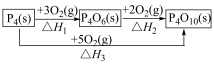
其中

 和
和 的代数式表示)。
的代数式表示)。(3)已知:
 (s,白磷)
(s,白磷) (s,黑磷)
(s,黑磷)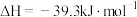 ;
; (s,白磷)
(s,白磷) (s,红磷)
(s,红磷)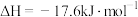 ;
;由此推知,其中最稳定的磷单质是
您最近一年使用:0次
名校
4 . 二氧化碳一甲烷重整反应制备合成气(H2+CO)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
①

②
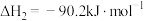
③
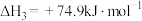
④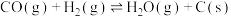
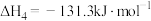
回答下列问题:
(1)
_______ ,反应①_______ 正向自发进行(填标号)。
A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为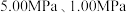 和
和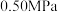 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为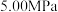 的曲线是
的曲线是_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”),判断依据是_______ 。 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是_______ 。 和
和 ,达到平衡时
,达到平衡时 的转化率为
的转化率为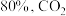 的转化率为
的转化率为 ,碳单质的物质的量为
,碳单质的物质的量为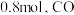 的物质的量为
的物质的量为_______  ,反应①用摩尔分数表示的平衡常数
,反应①用摩尔分数表示的平衡常数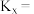
_______ (结果保留两位小数)。
上述平衡时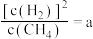 ,向体系通入
,向体系通入 气,重新达到平衡时,
气,重新达到平衡时,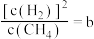 ,则a
,则a_______ b(填“>”“<”或“=”)。(已知反应 的
的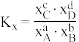 ,物质
,物质 的摩尔分数
的摩尔分数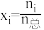 )
)
①


②

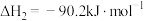
③

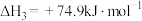
④
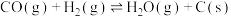
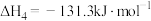
回答下列问题:
(1)

A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为
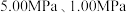 和
和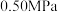 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为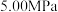 的曲线是
的曲线是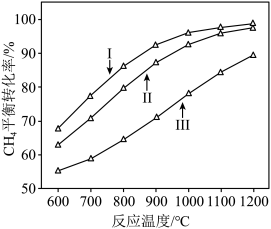
 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是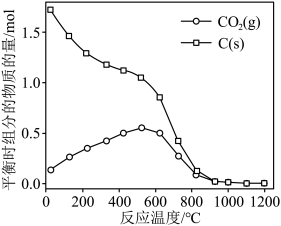
 和
和 ,达到平衡时
,达到平衡时 的转化率为
的转化率为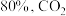 的转化率为
的转化率为 ,碳单质的物质的量为
,碳单质的物质的量为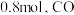 的物质的量为
的物质的量为 ,反应①用摩尔分数表示的平衡常数
,反应①用摩尔分数表示的平衡常数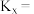
上述平衡时
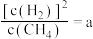 ,向体系通入
,向体系通入 气,重新达到平衡时,
气,重新达到平衡时,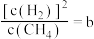 ,则a
,则a 的
的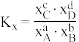 ,物质
,物质 的摩尔分数
的摩尔分数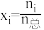 )
)
您最近一年使用:0次
2024-01-20更新
|
1114次组卷
|
4卷引用:2024年1月河南普通高等学校招生考试适应性测试化学试题
2024年1月河南普通高等学校招生考试适应性测试化学试题(已下线)T29-原理综合题(已下线)2024年1月“九省联考”河南卷真题完全解读与考后提升湖南省长沙市雅礼中学2023-2024学年高三下学期月考(八)化学试题
名校
5 . 铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜: ;
;
方法2:湿法炼铜: 。
。
上述两种方法中,方法2比方法1更好,其原因是_______ (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为_______ 。
(2)黄铜矿的含铜成分为 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为_______ 。
(3)将 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为_______ g。
(4) 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知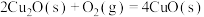
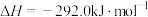 ;则
;则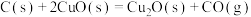 的
的
_______  。
。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
①实验ⅰ中气体减少的原因是_______ 。
②实验ⅰ中,推测产生 ,可能发生的反应有
,可能发生的反应有 、
、_______ 。
③随着阴极析出 ,实验ⅱ中
,实验ⅱ中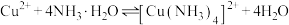 平衡不移动,理由是
平衡不移动,理由是_______ 。
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:
 ;
;方法2:湿法炼铜:
 。
。上述两种方法中,方法2比方法1更好,其原因是
(2)黄铜矿的含铜成分为
 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为(3)将
 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为(4)
 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知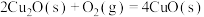
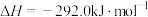 ;则
;则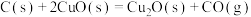 的
的
 。
。(5)某同学利用下图装置进行铁上电镀铜的实验探究。
| 实验序号 | 装置示意图 | 实验现象 |
| 1 | 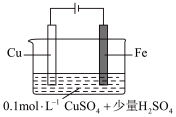 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 |
| 2 | 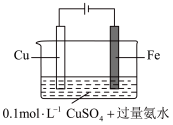 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无 元素 元素 |
②实验ⅰ中,推测产生
 ,可能发生的反应有
,可能发生的反应有 、
、③随着阴极析出
 ,实验ⅱ中
,实验ⅱ中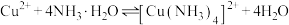 平衡不移动,理由是
平衡不移动,理由是
您最近一年使用:0次
2024-01-01更新
|
214次组卷
|
2卷引用:河南省部分名校2023-2024学年高三上学期11月期中化学试题
6 . 甲烷和二氧化碳是两种主要的温室气体,它们的化学利用是一条非常好的节能减排途径。工业上甲烷和二氧化碳催化重整为合成气,体系中主要发生如下反应:
Ⅰ.
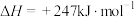 ;
;
Ⅱ.
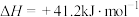 。
。
回答下列问题:
(1)根据反应Ⅰ、Ⅱ,下列能提高 平衡转化率的是___________(填字母)。
平衡转化率的是___________(填字母)。
(2)研究表明,甲烷和二氧化碳催化重整为合成气的一种反应机理(ads指吸附在催化剂表面的中间物种)如下:
i.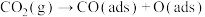 ;
;
ii.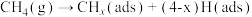 ;
;
iii.……
iv.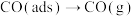 ,
,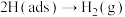 。
。
则反应iii的方程式为___________ 。
(3)在恒压、反应物起始物质的量比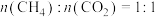 条件下,发生上述反应Ⅰ、Ⅱ,
条件下,发生上述反应Ⅰ、Ⅱ, 和
和 的平衡转化率随温度变化的曲线如图所示。
的平衡转化率随温度变化的曲线如图所示。 的平衡转化率随温度变化的曲线是
的平衡转化率随温度变化的曲线是___________ (填“曲线A”或“曲线B”)。
②恒压、 、初始
、初始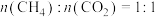 条件下,反应至
条件下,反应至 转化率达到X点的值,要使
转化率达到X点的值,要使 转化率能达到Y点的值,改变的条件可能是
转化率能达到Y点的值,改变的条件可能是___________ 。
③已知图中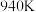 时曲线A、B对应物质的平衡转化率分别为80%和60%,则平衡体系中
时曲线A、B对应物质的平衡转化率分别为80%和60%,则平衡体系中 的物质的量分数为
的物质的量分数为___________ ,此温度下,反应Ⅱ的平衡常数
___________ 。
(4)甲烷和二氧化碳催化重整反应体系中,催化剂失活主要是由于催化剂的表面积炭所致。催化剂表面积炭主要来自 裂解:
裂解: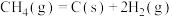
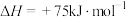 和
和 的歧化:
的歧化: 。
。
①歧化反应 的
的
___________ (填“>”或“<”)0。
②研究表明,催化剂(表示为载体/助剂)载体表面碱性越强,抗积炭能力越强,则下列催化剂抗积炭能力最强的是___________ (填字母)。
A.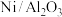 B.
B. C.
C. D.
D.
Ⅰ.

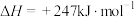 ;
;Ⅱ.

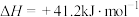 。
。回答下列问题:
(1)根据反应Ⅰ、Ⅱ,下列能提高
 平衡转化率的是___________(填字母)。
平衡转化率的是___________(填字母)。A.恒温恒容下增加 的用量 的用量 | B.恒温恒压下通入惰性气体 |
| C.升高温度 | D.加入更高效催化剂 |
(2)研究表明,甲烷和二氧化碳催化重整为合成气的一种反应机理(ads指吸附在催化剂表面的中间物种)如下:
i.
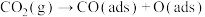 ;
;ii.
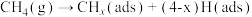 ;
;iii.……
iv.
 ,
,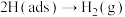 。
。则反应iii的方程式为
(3)在恒压、反应物起始物质的量比
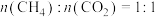 条件下,发生上述反应Ⅰ、Ⅱ,
条件下,发生上述反应Ⅰ、Ⅱ, 和
和 的平衡转化率随温度变化的曲线如图所示。
的平衡转化率随温度变化的曲线如图所示。
 的平衡转化率随温度变化的曲线是
的平衡转化率随温度变化的曲线是②恒压、
 、初始
、初始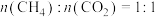 条件下,反应至
条件下,反应至 转化率达到X点的值,要使
转化率达到X点的值,要使 转化率能达到Y点的值,改变的条件可能是
转化率能达到Y点的值,改变的条件可能是③已知图中
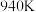 时曲线A、B对应物质的平衡转化率分别为80%和60%,则平衡体系中
时曲线A、B对应物质的平衡转化率分别为80%和60%,则平衡体系中 的物质的量分数为
的物质的量分数为
(4)甲烷和二氧化碳催化重整反应体系中,催化剂失活主要是由于催化剂的表面积炭所致。催化剂表面积炭主要来自
 裂解:
裂解: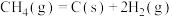
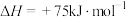 和
和 的歧化:
的歧化: 。
。①歧化反应
 的
的
②研究表明,催化剂(表示为载体/助剂)载体表面碱性越强,抗积炭能力越强,则下列催化剂抗积炭能力最强的是
A.
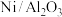 B.
B. C.
C. D.
D.
您最近一年使用:0次
2023-12-02更新
|
298次组卷
|
5卷引用:河南省部分名校2023-2024学年高三上学期11月期中化学试题
7 . 完成下列小题
(1)等浓度的盐酸、氨水中,由水电离出的 浓度前者
浓度前者______ 后者(填“大于”“小于”或“等于”)。在25℃下,将 的氨水与
的氨水与 的盐酸等体积混合充分反应后溶液呈中性,则反应后溶液中离子浓度的大小关系为
的盐酸等体积混合充分反应后溶液呈中性,则反应后溶液中离子浓度的大小关系为______ 。
(2)下列方法中可以使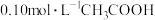 的电离程度增大的是
的电离程度增大的是______ (填字母)。
a.加入少量 的稀盐酸
的稀盐酸
b.加热该 溶液
溶液
c.加入少量冰醋酸
d。加水稀释至
e.加入少量 的NaOH溶液
的NaOH溶液
(3)2023年10月15日8时54分,长征二号丁运载火箭在酒泉卫星发射中心点火升空,将云海一号04星送入预定轨道,此次任务是长征二号丁运载火箭2023年度的第10次发射,实现了十战十捷。
①全箭主动力采用四氧化二氮( )和偏二甲肼(
)和偏二甲肼( )推进剂:
)推进剂:
已知:
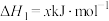
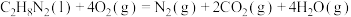
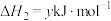
则 的
的
______ 。
②火箭和导弹表面的薄层是耐高温物质。下列反应可制得该材料: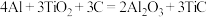 ,已知反应物和生成物均为固体,该反应过程中每转移1mol电子放出的热量为98kJ,写出该反应的热化学方程式
,已知反应物和生成物均为固体,该反应过程中每转移1mol电子放出的热量为98kJ,写出该反应的热化学方程式______ 。
(4)反应 的平衡常数为
的平衡常数为______ (保留小数点后一位)。[已知 ,
, 的
的 ,
, ]
]
(1)等浓度的盐酸、氨水中,由水电离出的
 浓度前者
浓度前者 的氨水与
的氨水与 的盐酸等体积混合充分反应后溶液呈中性,则反应后溶液中离子浓度的大小关系为
的盐酸等体积混合充分反应后溶液呈中性,则反应后溶液中离子浓度的大小关系为(2)下列方法中可以使
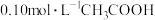 的电离程度增大的是
的电离程度增大的是a.加入少量
 的稀盐酸
的稀盐酸b.加热该
 溶液
溶液c.加入少量冰醋酸
d。加水稀释至

e.加入少量
 的NaOH溶液
的NaOH溶液(3)2023年10月15日8时54分,长征二号丁运载火箭在酒泉卫星发射中心点火升空,将云海一号04星送入预定轨道,此次任务是长征二号丁运载火箭2023年度的第10次发射,实现了十战十捷。
①全箭主动力采用四氧化二氮(
 )和偏二甲肼(
)和偏二甲肼( )推进剂:
)推进剂:已知:

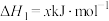
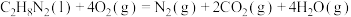
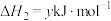
则
 的
的
②火箭和导弹表面的薄层是耐高温物质。下列反应可制得该材料:
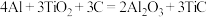 ,已知反应物和生成物均为固体,该反应过程中每转移1mol电子放出的热量为98kJ,写出该反应的热化学方程式
,已知反应物和生成物均为固体,该反应过程中每转移1mol电子放出的热量为98kJ,写出该反应的热化学方程式(4)反应
 的平衡常数为
的平衡常数为 ,
, 的
的 ,
, ]
]
您最近一年使用:0次
解题方法
8 . 随着化石能源的减少,新能源的开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
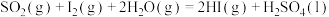
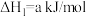
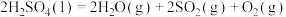
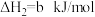
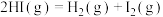
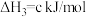
则: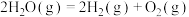

___________ kJ/mol。
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为
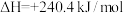 ,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程
,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程___________ (填“吸收”或“放出”)的热量是___________ kJ。
(3)甲醇是一种新型的汽车动力燃料。
①以 和
和 为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为
为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为___________ 。

②工业上利用CO和 来制备甲醇气体。已知某些化学键的键能数据如下表:
来制备甲醇气体。已知某些化学键的键能数据如下表:
设CO以 键构成,则工业制备甲醇的热化学方程式为
键构成,则工业制备甲醇的热化学方程式为___________ 。
(4)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示:
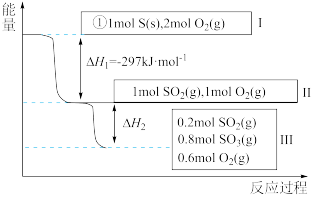
已知: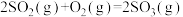

①表示硫的燃烧热的热化学方程式为___________ 。
②图中
___________ kJ/mol。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
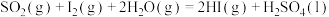
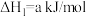
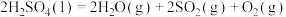
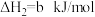
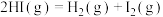
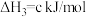
则:
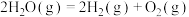

(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为

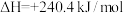 ,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程
,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程(3)甲醇是一种新型的汽车动力燃料。
①以
 和
和 为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为
为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为
②工业上利用CO和
 来制备甲醇气体。已知某些化学键的键能数据如下表:
来制备甲醇气体。已知某些化学键的键能数据如下表:| 化学键 |  |  |  |  |  |  |
键能/ | 348 | 413 | 436 | 358 | 1072 | 463 |
 键构成,则工业制备甲醇的热化学方程式为
键构成,则工业制备甲醇的热化学方程式为(4)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示:

已知:
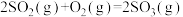

①表示硫的燃烧热的热化学方程式为
②图中

您最近一年使用:0次
2023-11-17更新
|
216次组卷
|
2卷引用:河南省开封市2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
9 . Ⅰ.在载人航天器中,可以利用 与
与 的反应,将航天员呼出的
的反应,将航天员呼出的 转化为
转化为 等,然后通过电解
等,然后通过电解 得到
得到 ,从而实现
,从而实现 的再生。已知:
的再生。已知:
①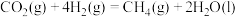

②
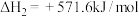
(1)请写出甲烷与氧气反应生成二氧化碳和液态水的热化学方程式___________ 。
Ⅱ.将 盐酸和
盐酸和 未知浓度的
未知浓度的 溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持
溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持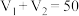 。
。
(2)下列叙述正确的是___________。
(3)中和反应的反应热的理论值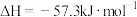 ,写出表示稀盐酸和
,写出表示稀盐酸和 溶液反应的中和热的热化学方程式
溶液反应的中和热的热化学方程式___________ 。下列操作可能使测得的 偏大的是
偏大的是___________ (填序号)。
①室温低于 时进行实验
时进行实验
②分多次把 溶液倒入盛有盐酸的小烧杯中
溶液倒入盛有盐酸的小烧杯中
③实验时用环形铜丝搅拌棒代替搅拌器
(4)在做测定中和反应的反应热实验时,应使用仪器的正确组合是___________。
①天平 ②量筒 ③烧杯 ④滴定管 ⑤温度计 ⑥试管 ⑦酒精灯
 与
与 的反应,将航天员呼出的
的反应,将航天员呼出的 转化为
转化为 等,然后通过电解
等,然后通过电解 得到
得到 ,从而实现
,从而实现 的再生。已知:
的再生。已知:①
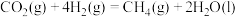

②

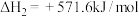
(1)请写出甲烷与氧气反应生成二氧化碳和液态水的热化学方程式
Ⅱ.将
 盐酸和
盐酸和 未知浓度的
未知浓度的 溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持
溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持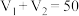 。
。
(2)下列叙述正确的是___________。
| A.该实验表明化学能可转化为热能 | B.做该实验时环境温度为 |
C. 溶液的浓度约为 溶液的浓度约为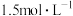 | D.该实验表明有水生成的反应都是放热反应 |
(3)中和反应的反应热的理论值
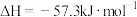 ,写出表示稀盐酸和
,写出表示稀盐酸和 溶液反应的中和热的热化学方程式
溶液反应的中和热的热化学方程式 偏大的是
偏大的是①室温低于
 时进行实验
时进行实验②分多次把
 溶液倒入盛有盐酸的小烧杯中
溶液倒入盛有盐酸的小烧杯中③实验时用环形铜丝搅拌棒代替搅拌器
(4)在做测定中和反应的反应热实验时,应使用仪器的正确组合是___________。
①天平 ②量筒 ③烧杯 ④滴定管 ⑤温度计 ⑥试管 ⑦酒精灯
| A.①②④ | B.②③⑤ | C.②③④⑦ | D.全部 |
您最近一年使用:0次
2023-11-11更新
|
73次组卷
|
2卷引用:河南省洛阳市宜阳县第一高级中学清北园2023-2024学年高一上学期第七次能力达标测试化学试卷
10 . 化学反应常伴随能量变化,是人类获得能量的重要途径。
(1)一种即热饭盒的结构如图所示,这种饭盒使用起来非常方便,撤去底部的隔板几分钟后,饭菜就变热了。
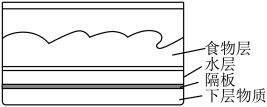
①下层物质可以是由镁粉、铁粉和食盐组成的混合物,则镁粉和铁粉的作用依次为___________ 、___________ 。
②化学能转化为热能在生产或生活中的应用还有___________ (填一种)。
③某种冷敷袋盛装的物质是硝酸铵,加少量水即可达到冷却效果,该冷敷袋的主要工作原理为___________ 热(填“吸”或“放”)的___________ 变化(填“物理”或“化学”)。
(2)借鉴中和反应反应热的测定方法,某同学测定放热反应 的焓变
的焓变 (忽略温度对焓变的影响,忽略溶液体积、质量变化和金属吸收的热量。近似的认为溶液的密度、比热容与水的相同,已知水的比热容为4.18
(忽略温度对焓变的影响,忽略溶液体积、质量变化和金属吸收的热量。近似的认为溶液的密度、比热容与水的相同,已知水的比热容为4.18 )。实验结果见下表。
)。实验结果见下表。
则温度:b___________ c(填“>”“<”或“=”);
___________  (用含a、c的代数式表示)。
(用含a、c的代数式表示)。
(3)已知298 K,101 kPa时,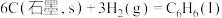
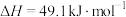 ,相关物质的摩尔燃烧焓数据如表:
,相关物质的摩尔燃烧焓数据如表:
则表示C(石墨,s)摩尔燃烧焓的热化学方程式为___________ ,a=___________ 。
(1)一种即热饭盒的结构如图所示,这种饭盒使用起来非常方便,撤去底部的隔板几分钟后,饭菜就变热了。

①下层物质可以是由镁粉、铁粉和食盐组成的混合物,则镁粉和铁粉的作用依次为
②化学能转化为热能在生产或生活中的应用还有
③某种冷敷袋盛装的物质是硝酸铵,加少量水即可达到冷却效果,该冷敷袋的主要工作原理为
(2)借鉴中和反应反应热的测定方法,某同学测定放热反应
 的焓变
的焓变 (忽略温度对焓变的影响,忽略溶液体积、质量变化和金属吸收的热量。近似的认为溶液的密度、比热容与水的相同,已知水的比热容为4.18
(忽略温度对焓变的影响,忽略溶液体积、质量变化和金属吸收的热量。近似的认为溶液的密度、比热容与水的相同,已知水的比热容为4.18 )。实验结果见下表。
)。实验结果见下表。| 序号 | 反应试剂 | 体系温度/℃ | ||
| 反应前 | 反应后 | |||
| ⅰ | 100mL 0.20  溶液 溶液 | 1.36g Zn粉 | a | b |
| ⅱ | 0.62g Zn粉 | a | c | |

 (用含a、c的代数式表示)。
(用含a、c的代数式表示)。(3)已知298 K,101 kPa时,
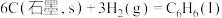
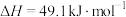 ,相关物质的摩尔燃烧焓数据如表:
,相关物质的摩尔燃烧焓数据如表:| 物质 |  | 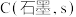 |  |
摩尔燃烧焓 | -285.8 | -393.5 | a |
您最近一年使用:0次



