1 . (一)碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质,请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如图:_______ 。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ•mol-1,则反应过程中,每转移1mol电子放出的热量为_______ 。
(3)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ•mol-1;②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1;③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1;CH4、H2组成的混合气体2mol,完全㜔烧后放出热量1297.0kJ能量,该混合气体中CH4与H2的物质的量之比n(CH4):n(H2)=_____ ,C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出其反应热△H=_____ kJ•mol-1。
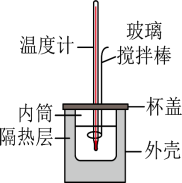
(二)0.50mol•L-1的盐酸与0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题: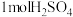 溶于不同量水中的热效度如下表:
溶于不同量水中的热效度如下表:
下列说法正确的是_______ 。
A.当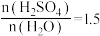 时,溶解放热
时,溶解放热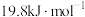
B.向 的溶液中加入9g水,放出热量6.9kJ
的溶液中加入9g水,放出热量6.9kJ
C.用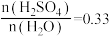 的溶液测定中和反应的反应热会使△H偏小
的溶液测定中和反应的反应热会使△H偏小
(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
①表中的温度差平均值为_______ ℃。
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1.则中和热△H=_____ (取小数点后一位)。
(6)下列说法正确的是_______ (填字母)。
a.为了使反应充分进行,药品可以分多次加入
b.完成一次中和反应反应热平行样的测定,温度计需要使用2次
c.测量NaOH与不同种类的酸(如HCl、 等)中和反应的反应热,数值可能不同
等)中和反应的反应热,数值可能不同
d.用温度计测定NaOH溶液起始温度后直接测定 溶液的温度
溶液的温度
(1)有机物M经过太阳光光照可转化成N,转化过程如图:
 △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ•mol-1,则反应过程中,每转移1mol电子放出的热量为
(3)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ•mol-1;②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1;③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1;CH4、H2组成的混合气体2mol,完全㜔烧后放出热量1297.0kJ能量,该混合气体中CH4与H2的物质的量之比n(CH4):n(H2)=
(二)0.50mol•L-1的盐酸与0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
 溶于不同量水中的热效度如下表:
溶于不同量水中的热效度如下表: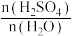 | 2.0 | 1.0 | 0.67 | 0.50 | 0.33 |  |
溶解放热 | 15.8 | 27.8 | 35.9 | 41.6 | 48.9 | 95.3 |
A.当
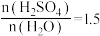 时,溶解放热
时,溶解放热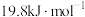
B.向
 的溶液中加入9g水,放出热量6.9kJ
的溶液中加入9g水,放出热量6.9kJC.用
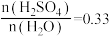 的溶液测定中和反应的反应热会使△H偏小
的溶液测定中和反应的反应热会使△H偏小(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t1-t2)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.6 | 26.6 | 26.6 | 29.1 | 2.5 |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | 4 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 |
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•(g•℃)-1.则中和热△H=
(6)下列说法正确的是
a.为了使反应充分进行,药品可以分多次加入
b.完成一次中和反应反应热平行样的测定,温度计需要使用2次
c.测量NaOH与不同种类的酸(如HCl、
 等)中和反应的反应热,数值可能不同
等)中和反应的反应热,数值可能不同d.用温度计测定NaOH溶液起始温度后直接测定
 溶液的温度
溶液的温度
您最近一年使用:0次
名校
解题方法
2 . 按题意要求填空:
(1)已知10g液态己烷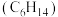 完全燃烧生成液态水放出484kJ的热量,写出表示己烷燃烧热的热化学方程
完全燃烧生成液态水放出484kJ的热量,写出表示己烷燃烧热的热化学方程___________ 。
(2)已知在微生物作用条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下
。两步反应的能量变化示意图如下 全部被氧化成
全部被氧化成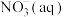 的热化学方程式为:
的热化学方程式为:___________ 。
(3)化学键的键能是原子间形成(或断裂)1mol化学键时释放(或吸收)的能量。以下是部分共价键键能数据: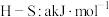 ;
;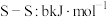 ;
;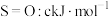 ;
;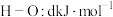 。
。 盐酸与
盐酸与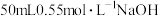 溶液在如图所示装置中进行中和反应。回答下列问题:
溶液在如图所示装置中进行中和反应。回答下列问题:___________ 。保持其他条件不变,实验中改用100mL0.50mol⋅L−1盐酸与100mL0.55mol⋅L−1NaOH溶液进行反应,与上述实验相比,二者所测的中和热___________ (填“相等”或“不相等”),原因是___________ 。
② 若四次操作测得终止温度与起始温度差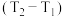 分别为①3.1℃;5.1℃;③3.2℃;④3.3℃。则所得的中和反应的中和热
分别为①3.1℃;5.1℃;③3.2℃;④3.3℃。则所得的中和反应的中和热
___________  (已知该温度下水的比热容:
(已知该温度下水的比热容: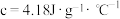 ,保留三位有效数字)。
,保留三位有效数字)。
(1)已知10g液态己烷
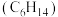 完全燃烧生成液态水放出484kJ的热量,写出表示己烷燃烧热的热化学方程
完全燃烧生成液态水放出484kJ的热量,写出表示己烷燃烧热的热化学方程(2)已知在微生物作用条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下
。两步反应的能量变化示意图如下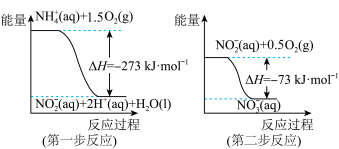
 全部被氧化成
全部被氧化成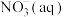 的热化学方程式为:
的热化学方程式为:(3)化学键的键能是原子间形成(或断裂)1mol化学键时释放(或吸收)的能量。以下是部分共价键键能数据:
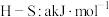 ;
;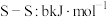 ;
;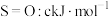 ;
;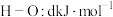 。
。已知反应: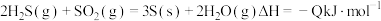 ,其反应产物中的固体S实为
,其反应产物中的固体S实为 ,实际分子是一个8元环状分子(即
,实际分子是一个8元环状分子(即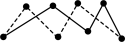 ),试根据这些数据计算已知反应的反应热:则Q=
),试根据这些数据计算已知反应的反应热:则Q=
 盐酸与
盐酸与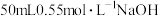 溶液在如图所示装置中进行中和反应。回答下列问题:
溶液在如图所示装置中进行中和反应。回答下列问题:
② 若四次操作测得终止温度与起始温度差
 分别为①3.1℃;5.1℃;③3.2℃;④3.3℃。则所得的中和反应的中和热
分别为①3.1℃;5.1℃;③3.2℃;④3.3℃。则所得的中和反应的中和热
 (已知该温度下水的比热容:
(已知该温度下水的比热容: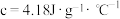 ,保留三位有效数字)。
,保留三位有效数字)。
您最近一年使用:0次
3 . I.Ti、Na、Mg、C、N、O、Fe等元素单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)已知C、CO的燃烧热分别为393.5kJ/mol和283.0kJ/mol,写出碳不完全燃烧生成CO的热化学方程式___________ 。
(2)Na、Mg、C、N、O的第一电离能由大到小的顺序为___________ 。
(3)基态 原子最高能层的原子轨道形状为
原子最高能层的原子轨道形状为___________ ,其价电子轨道表示式为___________ 。
(4)钢铁发生吸氧腐蚀时正极的电极反应式为:___________ 。为防止钢铁输水管的腐蚀,可用导线将其与镁块连接,这种防护方法为___________ 。(电化学保护法中的一种)
(5)用琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是___________ 。
II.制备硫酸四氨合铜晶体
①取20mL配制好的硫酸铜溶液于试管中,向其中滴加1mol/L氨水,有蓝色沉淀生成。
②继续慢慢加入氨水并振荡试管,沉淀逐渐消失,生成深蓝色溶液。
(6) 中,形成配位键提供孤电子对的原子是
中,形成配位键提供孤电子对的原子是___________ (填元素符号),1mol该微粒中,含有σ键的数目为___________  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(7)步骤②中蓝色沉淀溶解的离子方程式为___________ 。
(8)步骤③中加入无水乙醇的目的是___________ 。
(1)已知C、CO的燃烧热分别为393.5kJ/mol和283.0kJ/mol,写出碳不完全燃烧生成CO的热化学方程式
(2)Na、Mg、C、N、O的第一电离能由大到小的顺序为
(3)基态
 原子最高能层的原子轨道形状为
原子最高能层的原子轨道形状为(4)钢铁发生吸氧腐蚀时正极的电极反应式为:
(5)用琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成
 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是II.制备硫酸四氨合铜晶体
①取20mL配制好的硫酸铜溶液于试管中,向其中滴加1mol/L氨水,有蓝色沉淀生成。
②继续慢慢加入氨水并振荡试管,沉淀逐渐消失,生成深蓝色溶液。
③再向试管中加入15mL无水乙醇,混合后静置30分钟,有深蓝色晶体析出
(6)
 中,形成配位键提供孤电子对的原子是
中,形成配位键提供孤电子对的原子是 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(7)步骤②中蓝色沉淀溶解的离子方程式为
(8)步骤③中加入无水乙醇的目的是
您最近一年使用:0次
4 . 能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、 时,
时,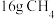 完全燃烧生成液态水时放出的热量是
完全燃烧生成液态水时放出的热量是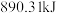 ,则
,则 燃烧的热化学方程式为
燃烧的热化学方程式为_______ 。
(2)已知:
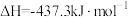
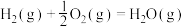
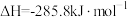
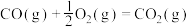
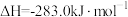
则煤气化反应 的焓变
的焓变
_______  。
。
(3)如图所示组成闭合回路,其中,甲装置中 为负极,
为负极, 和
和 的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,
的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出, 溶液的体积为
溶液的体积为 。
。

①装置中气体A为_______ (填“ ”或“
”或“ 和
和 ”),d极上的电极反应式为
”),d极上的电极反应式为_______ 。
②乙装置中a极上的电极反应式为_______ 。若在a极产生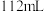 (标准状况)气体,则甲装置中消耗
(标准状况)气体,则甲装置中消耗
_______ mL(标准状况),乙装置中所得溶液的
_______ (忽略电解前后溶液体积变化)。
③如果乙中电极不变,将溶液换成饱和 溶液,当阴极上有
溶液,当阴极上有 气体生成时,同时有
气体生成时,同时有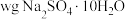 晶体析出,若温度不变,剩余溶液中溶质的质量分数应为
晶体析出,若温度不变,剩余溶液中溶质的质量分数应为_______ (用含w、a的表达式表示,不必化简)。
(1)在25℃、
 时,
时,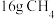 完全燃烧生成液态水时放出的热量是
完全燃烧生成液态水时放出的热量是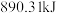 ,则
,则 燃烧的热化学方程式为
燃烧的热化学方程式为(2)已知:

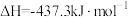
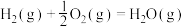
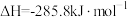
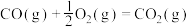
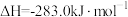
则煤气化反应
 的焓变
的焓变
 。
。(3)如图所示组成闭合回路,其中,甲装置中
 为负极,
为负极, 和
和 的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,
的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出, 溶液的体积为
溶液的体积为 。
。
①装置中气体A为
 ”或“
”或“ 和
和 ”),d极上的电极反应式为
”),d极上的电极反应式为②乙装置中a极上的电极反应式为
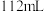 (标准状况)气体,则甲装置中消耗
(标准状况)气体,则甲装置中消耗

③如果乙中电极不变,将溶液换成饱和
 溶液,当阴极上有
溶液,当阴极上有 气体生成时,同时有
气体生成时,同时有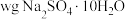 晶体析出,若温度不变,剩余溶液中溶质的质量分数应为
晶体析出,若温度不变,剩余溶液中溶质的质量分数应为
您最近一年使用:0次
名校
5 . 铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜: ;
;
方法2:湿法炼铜: 。
。
上述两种方法中,方法2比方法1更好,其原因是_______ (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为_______ 。
(2)黄铜矿的含铜成分为 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为_______ 。
(3)将 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为_______ g。
(4) 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知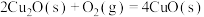
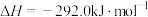 ;则
;则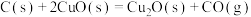 的
的
_______  。
。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
①实验ⅰ中气体减少的原因是_______ 。
②实验ⅰ中,推测产生 ,可能发生的反应有
,可能发生的反应有 、
、_______ 。
③随着阴极析出 ,实验ⅱ中
,实验ⅱ中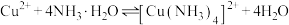 平衡不移动,理由是
平衡不移动,理由是_______ 。
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:
 ;
;方法2:湿法炼铜:
 。
。上述两种方法中,方法2比方法1更好,其原因是
(2)黄铜矿的含铜成分为
 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为(3)将
 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为(4)
 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知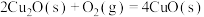
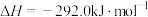 ;则
;则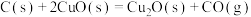 的
的
 。
。(5)某同学利用下图装置进行铁上电镀铜的实验探究。
| 实验序号 | 装置示意图 | 实验现象 |
| 1 | 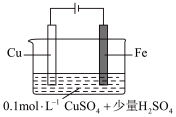 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 |
| 2 | 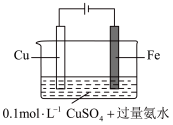 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无 元素 元素 |
②实验ⅰ中,推测产生
 ,可能发生的反应有
,可能发生的反应有 、
、③随着阴极析出
 ,实验ⅱ中
,实验ⅱ中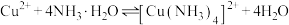 平衡不移动,理由是
平衡不移动,理由是
您最近一年使用:0次
2024-01-01更新
|
214次组卷
|
2卷引用:湖北省九师联盟2024届高三11月质检化学试题
6 . 分别取 的
的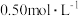 盐酸与
盐酸与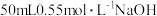 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。

请回答下列问题:
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、量筒、___________ 。
(2)用醋酸代替盐酸溶液进行上述实验,测得的中和热的数值会___________ (填“偏大”“偏小”或“无影响”),理由:____________________________________________ 。
(3)若在实验过程中,不把温度计上的酸用水冲洗干净直接测量 溶液的温度,则测得的
溶液的温度,则测得的
___________ (填“>”“<”或“=”)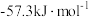 。为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容。则:①
。为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容。则:①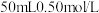 盐酸的质量
盐酸的质量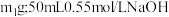 溶液的质量
溶液的质量 ;②两溶液混合后的溶液的比热容为
;②两溶液混合后的溶液的比热容为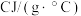 ,反应前后溶液的温度差为
,反应前后溶液的温度差为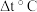 ;根据温度差和比热容等计算中和热的数值为:
;根据温度差和比热容等计算中和热的数值为:___________  .
.
(4)工业上可通过天然气跟水蒸气反应制取 ,有关反应的能量变化如图所示,则该反应的
,有关反应的能量变化如图所示,则该反应的
___________  (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
 的
的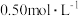 盐酸与
盐酸与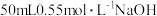 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
I II III
请回答下列问题:
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、量筒、
(2)用醋酸代替盐酸溶液进行上述实验,测得的中和热的数值会
(3)若在实验过程中,不把温度计上的酸用水冲洗干净直接测量
 溶液的温度,则测得的
溶液的温度,则测得的
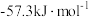 。为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容。则:①
。为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容。则:①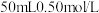 盐酸的质量
盐酸的质量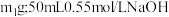 溶液的质量
溶液的质量 ;②两溶液混合后的溶液的比热容为
;②两溶液混合后的溶液的比热容为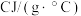 ,反应前后溶液的温度差为
,反应前后溶液的温度差为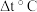 ;根据温度差和比热容等计算中和热的数值为:
;根据温度差和比热容等计算中和热的数值为: .
.(4)工业上可通过天然气跟水蒸气反应制取
 ,有关反应的能量变化如图所示,则该反应的
,有关反应的能量变化如图所示,则该反应的
 (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
您最近一年使用:0次
解题方法
7 . 氮、硫等非金属元素及其化合物在生产生活中应用广泛。请回答下列问题:
(1)键能是指在将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。
已知下列化学键的键能如下表:
写出1mol气态肼(H2N一NH2)在氧气中燃烧生成氮气和气态水的热化学方程式___________ 。
(2)已知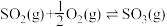 反应过程的能量变化如图所示:
反应过程的能量变化如图所示:
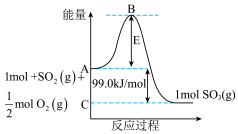
①图中E表示:___________ 。
②又知 ,请根据上图求出反应
,请根据上图求出反应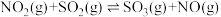 的△H=
的△H=___________ kJ·mol-1。
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。
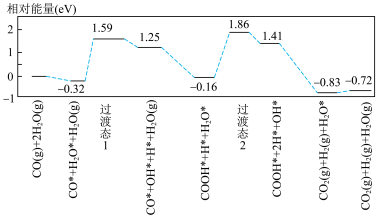
可知水煤气变换的△H___________ 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=___________ eV,写出该步骤的化学方程式___________ 。
(1)键能是指在将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。
已知下列化学键的键能如下表:
| 化学键 |  | O=O | N-N | N-H | O-H |
| 键能/kJ·mol-1 | 946 | 497 | 193 | 391 | 463 |
(2)已知
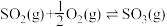 反应过程的能量变化如图所示:
反应过程的能量变化如图所示:
①图中E表示:
②又知
 ,请根据上图求出反应
,请根据上图求出反应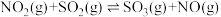 的△H=
的△H=(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。

可知水煤气变换的△H
您最近一年使用:0次
8 . 甲烷和二氧化碳是两种主要的温室气体,它们的化学利用是一条非常好的节能减排途径。工业上甲烷和二氧化碳催化重整为合成气,体系中主要发生如下反应:
Ⅰ.
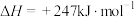 ;
;
Ⅱ.
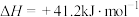 。
。
回答下列问题:
(1)根据反应Ⅰ、Ⅱ,下列能提高 平衡转化率的是___________(填字母)。
平衡转化率的是___________(填字母)。
(2)研究表明,甲烷和二氧化碳催化重整为合成气的一种反应机理(ads指吸附在催化剂表面的中间物种)如下:
i.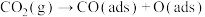 ;
;
ii.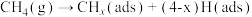 ;
;
iii.……
iv.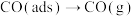 ,
,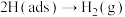 。
。
则反应iii的方程式为___________ 。
(3)在恒压、反应物起始物质的量比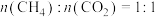 条件下,发生上述反应Ⅰ、Ⅱ,
条件下,发生上述反应Ⅰ、Ⅱ, 和
和 的平衡转化率随温度变化的曲线如图所示。
的平衡转化率随温度变化的曲线如图所示。 的平衡转化率随温度变化的曲线是
的平衡转化率随温度变化的曲线是___________ (填“曲线A”或“曲线B”)。
②恒压、 、初始
、初始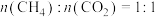 条件下,反应至
条件下,反应至 转化率达到X点的值,要使
转化率达到X点的值,要使 转化率能达到Y点的值,改变的条件可能是
转化率能达到Y点的值,改变的条件可能是___________ 。
③已知图中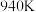 时曲线A、B对应物质的平衡转化率分别为80%和60%,则平衡体系中
时曲线A、B对应物质的平衡转化率分别为80%和60%,则平衡体系中 的物质的量分数为
的物质的量分数为___________ ,此温度下,反应Ⅱ的平衡常数
___________ 。
(4)甲烷和二氧化碳催化重整反应体系中,催化剂失活主要是由于催化剂的表面积炭所致。催化剂表面积炭主要来自 裂解:
裂解: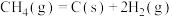
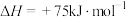 和
和 的歧化:
的歧化: 。
。
①歧化反应 的
的
___________ (填“>”或“<”)0。
②研究表明,催化剂(表示为载体/助剂)载体表面碱性越强,抗积炭能力越强,则下列催化剂抗积炭能力最强的是___________ (填字母)。
A.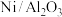 B.
B. C.
C. D.
D.
Ⅰ.

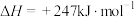 ;
;Ⅱ.

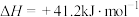 。
。回答下列问题:
(1)根据反应Ⅰ、Ⅱ,下列能提高
 平衡转化率的是___________(填字母)。
平衡转化率的是___________(填字母)。A.恒温恒容下增加 的用量 的用量 | B.恒温恒压下通入惰性气体 |
| C.升高温度 | D.加入更高效催化剂 |
(2)研究表明,甲烷和二氧化碳催化重整为合成气的一种反应机理(ads指吸附在催化剂表面的中间物种)如下:
i.
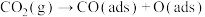 ;
;ii.
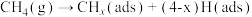 ;
;iii.……
iv.
 ,
,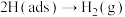 。
。则反应iii的方程式为
(3)在恒压、反应物起始物质的量比
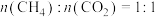 条件下,发生上述反应Ⅰ、Ⅱ,
条件下,发生上述反应Ⅰ、Ⅱ, 和
和 的平衡转化率随温度变化的曲线如图所示。
的平衡转化率随温度变化的曲线如图所示。
 的平衡转化率随温度变化的曲线是
的平衡转化率随温度变化的曲线是②恒压、
 、初始
、初始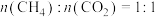 条件下,反应至
条件下,反应至 转化率达到X点的值,要使
转化率达到X点的值,要使 转化率能达到Y点的值,改变的条件可能是
转化率能达到Y点的值,改变的条件可能是③已知图中
 时曲线A、B对应物质的平衡转化率分别为80%和60%,则平衡体系中
时曲线A、B对应物质的平衡转化率分别为80%和60%,则平衡体系中 的物质的量分数为
的物质的量分数为
(4)甲烷和二氧化碳催化重整反应体系中,催化剂失活主要是由于催化剂的表面积炭所致。催化剂表面积炭主要来自
 裂解:
裂解: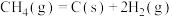
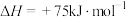 和
和 的歧化:
的歧化: 。
。①歧化反应
 的
的
②研究表明,催化剂(表示为载体/助剂)载体表面碱性越强,抗积炭能力越强,则下列催化剂抗积炭能力最强的是
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
2023-12-02更新
|
298次组卷
|
5卷引用:湖北省九师联盟2024届高三11月质检化学试题
名校
9 . 化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
(1)下列有关化学变化中能量变化的说法中,正确的是___________。
(2)甲烷可用于生产合成气,其反应为CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.4kJ/mol,已知断裂1 mol相关化学键所需的能量如下表:
则a=__________ ,若加入催化剂改变上述反应历程,上述反应的 ΔH___________ (填“变大”、“变小”或“不变”)
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
① 联氨分子的电子式为___________ 。
② 试写出联氨与过量HCl反应的化学方程式__________ 。
③ 已知:N2(g)+2O2(g)=2NO2(g) ΔH=+66.4kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ/mol
H2O(g)=H2O(l) ΔH=-44.0kJ/mol
则2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) ΔH=___________ kJ/mol。
(1)下列有关化学变化中能量变化的说法中,正确的是___________。
| A.需要加热才能发生的反应也可能是放热反应 |
| B.化学键断裂时通常放出能量 |
| C.反应物的总能量高于生成物的总能量表现为吸热反应 |
| D.反应物的总键能高于生成物的总键能表现为吸热反应 |
| 化学键 | H-H | O-H | C-H | C=O |
| 键能/(kJ·mol-¹) | 436 | a | 415.1 | 1076 |
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
① 联氨分子的电子式为
② 试写出联氨与过量HCl反应的化学方程式
③ 已知:N2(g)+2O2(g)=2NO2(g) ΔH=+66.4kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ/mol
H2O(g)=H2O(l) ΔH=-44.0kJ/mol
则2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) ΔH=
您最近一年使用:0次
2023-11-05更新
|
427次组卷
|
3卷引用:湖北省恩施土家族苗族自治州高级中学2023-2024学年高二上学期期中考试化学试题
名校
10 . 完成下列问题
(1)已知CH3OH(l)的摩尔燃烧焓ΔH=-726.5 kJ·mol-1,CH3OH(l)+ O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a___________ (填“>”“<”或“=”)726.5。
(2)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:___________ 。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为___________ 。
(4)CO2与H2在某催化剂的作用下反应如图所示:
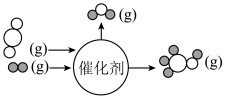
写出该反应的热化学方程式:___________ 。
(5)CO2催化加氢制CH3OH的一种反应历程如图所示(吸附在催化剂表面的物质用*标注,如CO 表示CO2吸附在催化剂表面)。
表示CO2吸附在催化剂表面)。
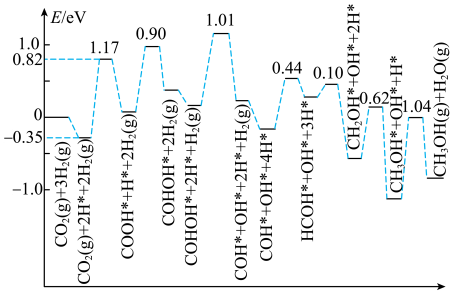
该反应历程中决速步反应的化学方程式为___________ 。
(1)已知CH3OH(l)的摩尔燃烧焓ΔH=-726.5 kJ·mol-1,CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a(2)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为
(4)CO2与H2在某催化剂的作用下反应如图所示:

| 化学键 |  |  | 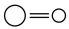 |  | 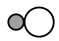 |
| 键能/(kJ·mol-1) | 436 | 326 | 803 | 464 | 414 |
(5)CO2催化加氢制CH3OH的一种反应历程如图所示(吸附在催化剂表面的物质用*标注,如CO
 表示CO2吸附在催化剂表面)。
表示CO2吸附在催化剂表面)。
该反应历程中决速步反应的化学方程式为
您最近一年使用:0次



