11-12高二上·河南焦作·期中
1 . 丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ΔH=-c kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-d kJ/mol (a、b、c、d 均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量________ (填“大于 ”、“等于 ” 或“小于 ”)途径Ⅱ放出的热量。
(2)由于C3H8(g)=C3H6(g)+H2(g)的反应中,反应物具有的总能量_____ (填“大于”、“等 于”或“小于 ”)生成物具有的总能量,那么在化学反应时,反应物就需要_____ (填“放出 ” 或“吸收 ”)能量才能转化为生成物,因此其反应条件是____ ;
(3)b与a、c、d 的数学关系式是_____________________________________ 。
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ΔH=-c kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-d kJ/mol (a、b、c、d 均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量
(2)由于C3H8(g)=C3H6(g)+H2(g)的反应中,反应物具有的总能量
(3)b与a、c、d 的数学关系式是
您最近一年使用:0次
2020-04-30更新
|
145次组卷
|
13卷引用:2014—2015学年湖北武汉新洲三中高二10月月考化学(A卷)试卷
(已下线)2014—2015学年湖北武汉新洲三中高二10月月考化学(A卷)试卷(已下线)2011-2012学年河南省焦作市修武一中分校高二上学期期中考试化学试卷(已下线)2012-2013学年吉林省松原市扶余县一中高二第一次月考化学试卷2015-2016学年四川省新津中学高二10月月考化学试卷西藏日喀则市第二高级中学2017-2018学年高二上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B甘肃省临泽县第一中学2018-2019学年高二上学期期中考试化学试题山东省济宁市第二中学2019-2020学年高二上学期第一次月考化学试题山西省祁县第二中学2019-2020学年高二10月月考化学试题陕西省宝鸡市金台区2019-2020学年高二上学期期中检测化学试题青海省西宁市海湖中学2020-2021学年高二上学期第一阶段测试化学试题福建省莆田第十五中学2018-2019学年高二上学期期中考试化学试题新疆岳普湖县2021-2022学年高二下学期第一次学情调研测试化学试题
2 . 工业废气、汽车尾气排放出的 SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)NOx和 SO2在空气中存在下列平衡:
2NO(g) + O2(g) 2NO2(g) △ H =− 113.0kJ
2NO2(g) △ H =− 113.0kJ mol−1
mol−1
2SO2(g) + O2(g) 2SO3(g) △ H =− 196.6kJ
2SO3(g) △ H =− 196.6kJ mol−1
mol−1
SO2通常在二氧化氮的存在下,进一步被氧化,生成 SO3.
①写出 NO2和 SO2反应的热化学方程式为_____ .
②随温度升高,该反应化学平衡常数变化趋势是_____ .
(2)提高2SO2(g) + O2(g) 2SO3(g)反应中 SO2的转化率,是减少 SO2排放的有效措施:①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2和 1.0mol O2,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是
2SO3(g)反应中 SO2的转化率,是减少 SO2排放的有效措施:①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2和 1.0mol O2,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是_____ .②在①中条件下,反应达到平衡后,改变下列条件,能使 SO2的转化率提高的是_____ (填字母).
a.温度和容器体积不变,充入 1.0mol He
b.温度和容器体积不变,充入 1.0mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度

(3)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图
①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是_____ .
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是_____ .
(1)NOx和 SO2在空气中存在下列平衡:
2NO(g) + O2(g)
 2NO2(g) △ H =− 113.0kJ
2NO2(g) △ H =− 113.0kJ mol−1
mol−12SO2(g) + O2(g)
 2SO3(g) △ H =− 196.6kJ
2SO3(g) △ H =− 196.6kJ mol−1
mol−1SO2通常在二氧化氮的存在下,进一步被氧化,生成 SO3.
①写出 NO2和 SO2反应的热化学方程式为
②随温度升高,该反应化学平衡常数变化趋势是
(2)提高2SO2(g) + O2(g)
 2SO3(g)反应中 SO2的转化率,是减少 SO2排放的有效措施:①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2和 1.0mol O2,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是
2SO3(g)反应中 SO2的转化率,是减少 SO2排放的有效措施:①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2和 1.0mol O2,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是a.温度和容器体积不变,充入 1.0mol He
b.温度和容器体积不变,充入 1.0mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度

(3)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图
①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是
您最近一年使用:0次
名校
解题方法
3 . 能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为_________________________ ;该反应在________ 条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)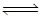 CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
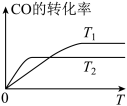
①T1________ T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1________ (填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是________ (填字母)。
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___________________ ;
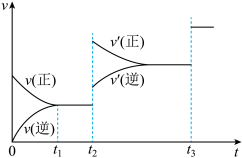
t3时采取的措施可能是_________________ 。
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=________ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是________ ;正极的电极反应为_______________________ 。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)
 CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
①T1
②若容器容积不变,下列措施不能增加CO转化率的是
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是

t3时采取的措施可能是
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是
您最近一年使用:0次
2020-03-03更新
|
882次组卷
|
3卷引用:湖北省咸宁市崇阳一中2019-2020学年高二3月月考化学试题
湖北省咸宁市崇阳一中2019-2020学年高二3月月考化学试题陕西省渭南市大荔县2019-2020学年高二上学期期末教学质量检测化学试题(已下线)本册综合检测(二)——2020-2021学年高二化学选修四同步单元AB卷(人教版)
名校
解题方法
4 . 工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2 在空气中存在下列平衡:2NO(g)+O2(g)
在空气中存在下列平衡:2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g)
2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为
2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为________ 。
(2)提高2SO2(g)+O2(g) 2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
①温度为T℃时,在2 L的密闭容器中加入2.0 mol 和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的
和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的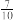 。该反应的平衡常数为
。该反应的平衡常数为_____ 。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_____ 。
A.在其他条件不变时,减少容器的体积
B.在其他条件不变时,改用高效催化剂
C.在其他条件不变时,升高体系温度
D.1.0mol温度和容器体积不变,充入1.0 mol氦气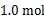
E.温度和容器体积不变,充入1.0 mol O2
(3)利用如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为______ ;若通入的NO体积为4.48 L(标况下),则理论上另一电极通入SO2的物质的量应为_______ 。
(1)NOx和SO2
 在空气中存在下列平衡:2NO(g)+O2(g)
在空气中存在下列平衡:2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g)
2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为
2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为(2)提高2SO2(g)+O2(g)
 2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。①温度为T℃时,在2 L的密闭容器中加入2.0 mol
 和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的
和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的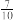 。该反应的平衡常数为
。该反应的平衡常数为②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是
A.在其他条件不变时,减少容器的体积
B.在其他条件不变时,改用高效催化剂
C.在其他条件不变时,升高体系温度
D.1.0mol温度和容器体积不变,充入1.0 mol氦气
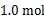
E.温度和容器体积不变,充入1.0 mol O2
(3)利用如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为

您最近一年使用:0次
5 . (1) 已 知 16 g 固 体 硫 完 全 燃 烧 时 放 出 148.4 kJ的 热 量 , 该 反 应 的 热 化 学 方 程 式 是________________ 。
(2)2mol乙醇 燃烧 时,生成液 态水 和二 氧化碳 ,同 时放 出 2733.6kJ 的热 量, 写出 该反应 的热 化学 方程式________________________________ 。
(3)用 NA 表示阿伏加 德罗常数,在 C2H2(气态)完全燃烧生成 CO2 和液态水的反应中,每有 5NA 个电子转移时,放出650 kJ 的热量。其燃烧热的热化学方程式为_____ 。
(4).在一定条件下,通入 80 g SO2 气体充分生成 SO3 气体时,放 出热量 98.3 kJ,已知 SO2 在此条件下转化率为 80%,则该反应的热化学方程________________________________ 。
(5)已知:CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ/mol;CO2 (g) +3H2(g)=CH3OH(g)+ H2O(g) △H3=c kJ/mol;2CH3OH(g)= CH3OCH3(g) + H2O(g) △H4=d kJ/mol
求:2CO(g) + 4H2 (g)=CH3OCH3(g) + H2O(g) △H=_____ kJ/mol
(2)2mol乙醇 燃烧 时,生成液 态水 和二 氧化碳 ,同 时放 出 2733.6kJ 的热 量, 写出 该反应 的热 化学 方程式
(3)用 NA 表示阿伏加 德罗常数,在 C2H2(气态)完全燃烧生成 CO2 和液态水的反应中,每有 5NA 个电子转移时,放出650 kJ 的热量。其燃烧热的热化学方程式为
(4).在一定条件下,通入 80 g SO2 气体充分生成 SO3 气体时,放 出热量 98.3 kJ,已知 SO2 在此条件下转化率为 80%,则该反应的热化学方程
(5)已知:CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ/mol;CO2 (g) +3H2(g)=CH3OH(g)+ H2O(g) △H3=c kJ/mol;2CH3OH(g)= CH3OCH3(g) + H2O(g) △H4=d kJ/mol
求:2CO(g) + 4H2 (g)=CH3OCH3(g) + H2O(g) △H=
您最近一年使用:0次
名校
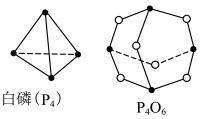
6 . (1)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:P-P:198kJ·mol-1,P-O:360 kJ·mol-1,O=O:498kJ·mol-1,则反应P4(白磷)与O2反应生成P4O6的热化学反应方程式为____ 。
(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ/mol
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ/mol
写出肼和N2O4反应的热化学方程式_____ 。
(3)化学反应N2+3H2 2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是
2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____ 。
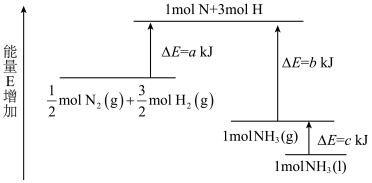

(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ/mol
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ/mol
写出肼和N2O4反应的热化学方程式
(3)化学反应N2+3H2
 2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是
2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是
您最近一年使用:0次
2019-10-16更新
|
136次组卷
|
3卷引用:湖北省武汉市汉南区职教中心2019-2020学年高二上学期期中考试化学试题
9-10高二下·湖北恩施·期末
名校
7 . 2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ/mol.
2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ/mol.
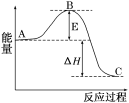
请回答下列问题:
(1)图中A、C分别表示___ 、___ ,E的大小对该反应的反应热有无影响?____ 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___ ,理由是____ 。
(2)图中ΔH=___ kJ/mol.
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:____ 。
(4)如果反应速率v(SO2)为0.05mol/(L·min),则v(O2)=___ mol/(L·min)、v(SO3)=____ mol/(L·min)。
(5)已知单质硫的燃烧热为296kJ/mol,计算由S(s)生成3molSO3(g)的ΔH(要求计算过程)。____
 2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ/mol.
2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ/mol.
请回答下列问题:
(1)图中A、C分别表示
(2)图中ΔH=
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
(4)如果反应速率v(SO2)为0.05mol/(L·min),则v(O2)=
(5)已知单质硫的燃烧热为296kJ/mol,计算由S(s)生成3molSO3(g)的ΔH(要求计算过程)。
您最近一年使用:0次
2019-10-05更新
|
99次组卷
|
9卷引用:09-10年湖北恩施高二下学期期末测试化学卷
(已下线)09-10年湖北恩施高二下学期期末测试化学卷(已下线)2011届山西省汾阳中学高三上学期第二次月考化学卷(已下线)2011-2012学年浙江省嵊泗中学高一上学期第一次月考化学试卷(已下线)2014-2015学年河南洛阳第一高级中学高二上10月化学卷(已下线)2014-2015学年河南洛阳第一高级中学高一上10月化学卷湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题【全国百强校】宁夏回族自治区银川一中2018-2019学年高二上学期12月阶段性测试理科综合化学试题江西省南城县第二中学2018-2019学年高二上学期第二次月考化学试题山西省忻州市第一中学2019-2020学年高一4月月考化学试题
名校
8 . (1)已知:①Fe(s)+1/2O2(g)=FeO(s) ΔH1=-272.0kJ·mol-1;
②2Al(s)+3/2O2(g)=Al2O3(s) ΔH2=-1675.7kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是__________ 。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____ (填“正”或“负”)极。F电极上的电极反应式为________ 。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因______ 。


(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为____ 。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为___ mol。
②2Al(s)+3/2O2(g)=Al2O3(s) ΔH2=-1675.7kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因


(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为
您最近一年使用:0次
2019-04-28更新
|
149次组卷
|
2卷引用:湖北省随州市第一中学2018-2019学年高二下学期期中考试化学试题
2019高一下·全国·专题练习
名校
解题方法
9 . 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),反应过程中的能量变化情况如图所示。
CH3OH(g),反应过程中的能量变化情况如图所示。
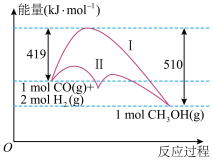
(1)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。该反应是________ (填“吸热”或“放热”)反应。计算当反应生成1.5 mol CH3OH(g)时,能量变化是________ kJ。
(2)选择适宜的催化剂________ (填“能”或“不能”)改变该反应的反应热。
(3)推测反应CH3OH(g)⇌CO(g)+2H2(g)是________ (填“吸热”或“放热”)反应。
 CH3OH(g),反应过程中的能量变化情况如图所示。
CH3OH(g),反应过程中的能量变化情况如图所示。
(1)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。该反应是
(2)选择适宜的催化剂
(3)推测反应CH3OH(g)⇌CO(g)+2H2(g)是
您最近一年使用:0次
2019-03-18更新
|
621次组卷
|
4卷引用:湖北省随州市曾都一中2019-2020学年高一下学期3月月考化学试题
湖北省随州市曾都一中2019-2020学年高一下学期3月月考化学试题(已下线)2019年3月14日 《每日一题》 必修2 化学反应过程的能量变化图分析2020春(新教材)人教化学第二册第6章 化学反应与能量练习人教版2019必修第二册 第六章 本章复习提升
名校
10 . (1)在1800K时,2Fe(s)+3/2O2(g)=Fe2O3(s) ∆H= -354.2kJ/mol;
3Fe(s)+2O2(g)=Fe3O4(s) ∆H= -550.9kJ/mol
则反应:2Fe3O4(s)+1/2O2(g) === 3Fe2O3(s)的∆H =_____ kJ·mol−1,四氧化三铁在充满氧气的集气瓶中反应生成Fe2O3_____ (填“能”或“不能”)自发进行。
(2)2018年是合成氨工业先驱哈伯(P•Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g) NH3(g) △H(298K)= - 46.2KJ•mol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
NH3(g) △H(298K)= - 46.2KJ•mol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H* NH*;NH*+ H*
NH*;NH*+ H* NH2*;NH2* + H*
NH2*;NH2* + H* NH3*
NH3*
脱附:NH3* NH3(g)
NH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。 请回答:
①利于提高合成氨平衡产率的条件有__________ 。
A.低温 B.高温 C.低压 D.高压 E.催化剂
②实际生产中,常用Fe作催化剂,控制温度773K,压强3.0 ×105Pa,原料中N2和H2物质的量之比为1:2.8。
分析说明原料气中N2过量的两个理由_________ ;_____________ 。
③关于合成氨工艺的下列理解,正确的是_______ 。
A.合成氨反应在不同温度下的△H和△S都小于零
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发
3Fe(s)+2O2(g)=Fe3O4(s) ∆H= -550.9kJ/mol
则反应:2Fe3O4(s)+1/2O2(g) === 3Fe2O3(s)的∆H =
(2)2018年是合成氨工业先驱哈伯(P•Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g)
 NH3(g) △H(298K)= - 46.2KJ•mol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
NH3(g) △H(298K)= - 46.2KJ•mol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*
 NH*;NH*+ H*
NH*;NH*+ H* NH2*;NH2* + H*
NH2*;NH2* + H* NH3*
NH3*脱附:NH3*
 NH3(g)
NH3(g)其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。 请回答:
①利于提高合成氨平衡产率的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
②实际生产中,常用Fe作催化剂,控制温度773K,压强3.0 ×105Pa,原料中N2和H2物质的量之比为1:2.8。
分析说明原料气中N2过量的两个理由
③关于合成氨工艺的下列理解,正确的是
A.合成氨反应在不同温度下的△H和△S都小于零
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发
您最近一年使用:0次
2019-02-19更新
|
298次组卷
|
2卷引用:【全国百强校】湖北省荆州中学2018-2019学年高二上学期期末考试化学试题



