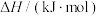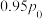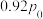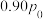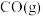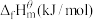名校
1 . (Ⅰ)铬及其化合物在催化、金属防腐等方面具有重要应用。 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为___ (列式表示)。
(2)该反应
_______ 0(填“>”或“=”或“<”)。
(Ⅱ)2022年11月29日23时08分,我国在酒泉卫星发射中心使用长征二号F遥十五火箭,成功将神舟十五号载人飞船发射升空,是空间站建造阶段最后一次载人飞行任务。
(3)火箭发射时可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。已知:①
和水蒸气。已知:①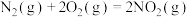
 kJ/mol②
kJ/mol②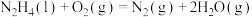
 kJ/mol请写出
kJ/mol请写出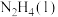 与
与 反应的热化学方程式
反应的热化学方程式_______ 。③
 ,
, 与
与 进行大小比较:
进行大小比较:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)二甲醚( )是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和
)是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和 合成二甲醚的反应为:
合成二甲醚的反应为:
 kJ/mol。
kJ/mol。
①改变下列“量”,一定会引起 发生变化的是
发生变化的是_______ (填代号)。
a.化学计量数 b.反应物浓度 c.催化剂
②采用新型催化剂(主要成分是Cu-Mn的合金)制备二甲醚。催化剂中 对合成二甲醚的影响情况如下图所示。当
对合成二甲醚的影响情况如下图所示。当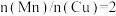 时,二甲醚的选择性(选择性
时,二甲醚的选择性(选择性 )为85.8%,此时二甲醚的产率为
)为85.8%,此时二甲醚的产率为_______ 。(保留3位有效数字)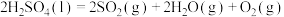
 kJ·mol
kJ·mol
反应III:
 kJ·mol
kJ·mol
在反应Ⅱ中,若标准状况下有33.6 L 气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为
气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为______ kJ。
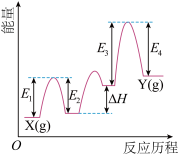
 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为(2)该反应

(Ⅱ)2022年11月29日23时08分,我国在酒泉卫星发射中心使用长征二号F遥十五火箭,成功将神舟十五号载人飞船发射升空,是空间站建造阶段最后一次载人飞行任务。
(3)火箭发射时可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。已知:①
和水蒸气。已知:①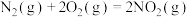
 kJ/mol②
kJ/mol②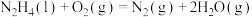
 kJ/mol请写出
kJ/mol请写出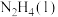 与
与 反应的热化学方程式
反应的热化学方程式
 ,
, 与
与 进行大小比较:
进行大小比较:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)二甲醚(
 )是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和
)是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和 合成二甲醚的反应为:
合成二甲醚的反应为:
 kJ/mol。
kJ/mol。①改变下列“量”,一定会引起
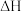 发生变化的是
发生变化的是a.化学计量数 b.反应物浓度 c.催化剂
②采用新型催化剂(主要成分是Cu-Mn的合金)制备二甲醚。催化剂中
 对合成二甲醚的影响情况如下图所示。当
对合成二甲醚的影响情况如下图所示。当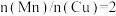 时,二甲醚的选择性(选择性
时,二甲醚的选择性(选择性 )为85.8%,此时二甲醚的产率为
)为85.8%,此时二甲醚的产率为 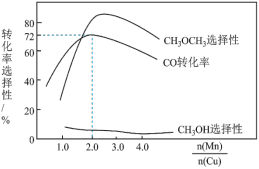
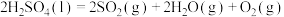
 kJ·mol
kJ·mol
反应III:

 kJ·mol
kJ·mol
在反应Ⅱ中,若标准状况下有33.6 L
 气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为
气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为
您最近半年使用:0次
2 . 环氧乙烷( ,简称
,简称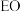 )是有机合成常用的试剂。
)是有机合成常用的试剂。 常温下易燃易爆,其爆炸极限为
常温下易燃易爆,其爆炸极限为 。工业上常用乙烯、氧气、氮气混合气投料的乙烯氧化法制备
。工业上常用乙烯、氧气、氮气混合气投料的乙烯氧化法制备 。涉及反应有:
。涉及反应有:

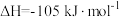
副反应:

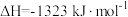
(1)主反应的活化能
 (正)
(正) (逆)(填“>”、“<”或“=”)。
(逆)(填“>”、“<”或“=”)。(2)已知
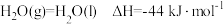 ,则
,则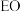 的燃烧热为
的燃烧热为
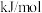 。
。(3)在温度为T,压强为
 的环境下,欲提高乙烯的平衡转化率,理论上需
的环境下,欲提高乙烯的平衡转化率,理论上需(4)以Ag为催化剂的反应机理如下:
反应I:
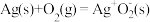 慢
慢反应Ⅱ:
 快
快反应Ⅲ:
 快
快①一定能够提高主反应反应速率的措施有
A.移出
 B.增大
B.增大 浓度 C.降低温度 D.增大
浓度 C.降低温度 D.增大 浓度
浓度②加入
 二氯乙烷会发生反应
二氯乙烷会发生反应 。一定条件下,反应经过一定时间后,
。一定条件下,反应经过一定时间后,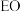 产率及选择性[
产率及选择性[ ]与
]与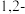 二氯乙烷浓度关系如图。
二氯乙烷浓度关系如图。
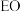 产率先增加后降低的原因可能是
产率先增加后降低的原因可能是(5)一定温度下,假定体系内只发生主反应,设
 的平衡分压为p,
的平衡分压为p, 的平衡转化率为x,用含p和x的代数式表示主反应的
的平衡转化率为x,用含p和x的代数式表示主反应的
您最近半年使用:0次
2024-04-29更新
|
49次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
3 . 氙及其化合物在工业生产中有重要用途。
(1)1962年,化学家巴特利特合成了氙的第一个化合物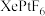 ,其在熔化时电离出
,其在熔化时电离出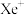 和
和 。Xe和
。Xe和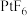 混合制得
混合制得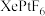 的反应可以表示如下:
的反应可以表示如下: )和1mol气态阴离子(
)和1mol气态阴离子( )所需要的能量叫做晶格能,
)所需要的能量叫做晶格能,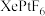 的晶格能为
的晶格能为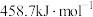 。
。
②Xe的第一电离能为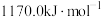 。
。
③
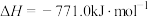 。
。
根据以上信息,计算反应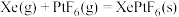

___________  。
。
(2)不久,在三个不同实验室里又分别合成了 、
、 、
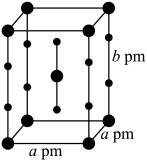
、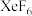 三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,
三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°, 表示阿伏伽德罗常数的值。则该化合物的化学式为
表示阿伏伽德罗常数的值。则该化合物的化学式为___________ ,中心原子的价层电子对数为___________ ,晶体密度为___________  。
。 混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
已知:分压=总压×该组分物质的量分数;
对于反应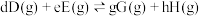
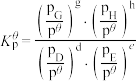
其中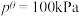 ,
,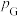 、
、 、
、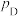 、
、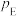 为各组分的平衡分压。
为各组分的平衡分压。
①
___________ 0(填“>”或“<”)。为提高平衡混合物中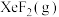 的含量,应
的含量,应___________ 投料比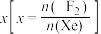 (填“增大”或“减小”)。
(填“增大”或“减小”)。
②673K时充入23.77molXe和 ,达平衡时容器内总压强
,达平衡时容器内总压强 ,各产物的物质的量如下表所示:
,各产物的物质的量如下表所示:
则 平衡转化率
平衡转化率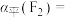
___________ (保留三位有效数字),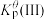
___________ 。
(1)1962年,化学家巴特利特合成了氙的第一个化合物
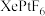 ,其在熔化时电离出
,其在熔化时电离出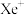 和
和 。Xe和
。Xe和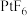 混合制得
混合制得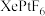 的反应可以表示如下:
的反应可以表示如下: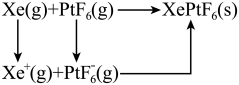
 )和1mol气态阴离子(
)和1mol气态阴离子( )所需要的能量叫做晶格能,
)所需要的能量叫做晶格能,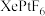 的晶格能为
的晶格能为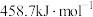 。
。②Xe的第一电离能为
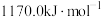 。
。③

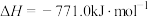 。
。根据以上信息,计算反应
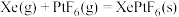

 。
。(2)不久,在三个不同实验室里又分别合成了
 、
、 、
、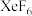 三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,
三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°, 表示阿伏伽德罗常数的值。则该化合物的化学式为
表示阿伏伽德罗常数的值。则该化合物的化学式为 。
。
 混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
混合气体,反应体系中存在的平衡及相应部分数据如下表所示。已知:分压=总压×该组分物质的量分数;
对于反应
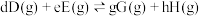
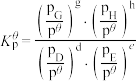
其中
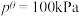 ,
,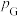 、
、 、
、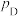 、
、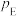 为各组分的平衡分压。
为各组分的平衡分压。标准压强平衡常数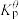 反应平衡 | 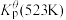 | 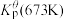 |
反应I: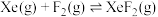  | 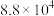 | 360 |
反应II: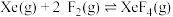  | ||
反应III: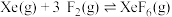  | 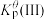 |

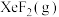 的含量,应
的含量,应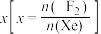 (填“增大”或“减小”)。
(填“增大”或“减小”)。②673K时充入23.77molXe和
 ,达平衡时容器内总压强
,达平衡时容器内总压强 ,各产物的物质的量如下表所示:
,各产物的物质的量如下表所示:| 化学式 |  |  | 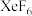 |
| 物质的量/mol | 3.60 | 19.80 | 0.36 |
 平衡转化率
平衡转化率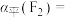
您最近半年使用:0次
2024-04-29更新
|
308次组卷
|
2卷引用:湖北省第九届2023-2024学年高三下学期4月四调(三模)考试化学试卷
名校
4 . 丙烯是有机化工中的重要原料,可用丙烷直接脱氢工艺和丙烷氧化脱氢工艺制备,其主反应和有关物质的燃烧热数据如下。
Ⅰ.丙烷直接脱氢工艺: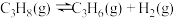
Ⅱ.丙烷氧化脱氢工艺:
回答下列问题:
(1)反应Ⅰ的
_____  ,其自发进行的条件是
,其自发进行的条件是_______ 。丙烷在不同温度下按照一定流速通过铬催化剂反应相同时间,所得混合物中部分物质的体积分数如下表所示,实际控制温度为580℃,原因是_________________ 。
(2)①反应Ⅱ属于自由基反应,其反应历程如下,写出第iv步的反应方程式。
i)
ii)
iii)
iv)______ 。
(3)将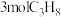 、
、 置于某恒温(高于100℃)、恒压(p)的密闭容器中进行反应Ⅱ时,发生了副反应Ⅲ:
置于某恒温(高于100℃)、恒压(p)的密闭容器中进行反应Ⅱ时,发生了副反应Ⅲ: 。达平衡时的体积分数
。达平衡时的体积分数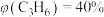 ,
, ,则
,则 的选择性为
的选择性为________ ( 的选择性
的选择性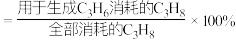 ,计算结果保留3位有效数字),反应Ⅲ的
,计算结果保留3位有效数字),反应Ⅲ的
_______ (用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
(4)使用惰性电极电解 的酸性溶液制丙烯,其装置如下图所示。
的酸性溶液制丙烯,其装置如下图所示。_______ (填“增大”“减小”或“不变”)。
②X电极的电极反应式为__________ 。
Ⅰ.丙烷直接脱氢工艺:
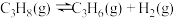
Ⅱ.丙烷氧化脱氢工艺:

物质 |
|
|
|
燃烧热 | -2219.9 | -2058.0 | -285.8 |
(1)反应Ⅰ的

 ,其自发进行的条件是
,其自发进行的条件是510℃ | 550℃ | 580℃ | 620℃ | |
丙烷(%) | 64.82 | 57.87 | 37.76 | 31.91 |
丙烯(%) | 12.33 | 15.85 | 22.72 | 23.13 |
乙烯(%) | 0.12 | 0.19 | 0.20 | 0.71 |
甲烷(%) | 1.50 | 2.78 | 4.03 | 7.31 |
氢气(%) | 20.47 | 18.99 | 25.45 | 31.14 |
(2)①反应Ⅱ属于自由基反应,其反应历程如下,写出第iv步的反应方程式。
i)

ii)

iii)

iv)
(3)将
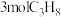 、
、 置于某恒温(高于100℃)、恒压(p)的密闭容器中进行反应Ⅱ时,发生了副反应Ⅲ:
置于某恒温(高于100℃)、恒压(p)的密闭容器中进行反应Ⅱ时,发生了副反应Ⅲ: 。达平衡时的体积分数
。达平衡时的体积分数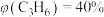 ,
, ,则
,则 的选择性为
的选择性为 的选择性
的选择性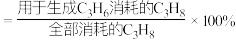 ,计算结果保留3位有效数字),反应Ⅲ的
,计算结果保留3位有效数字),反应Ⅲ的
 物质的量分数)。
物质的量分数)。(4)使用惰性电极电解
 的酸性溶液制丙烯,其装置如下图所示。
的酸性溶液制丙烯,其装置如下图所示。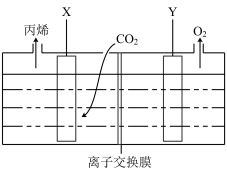
②X电极的电极反应式为
您最近半年使用:0次
2024-04-11更新
|
352次组卷
|
2卷引用:湖北省圆创联盟2024届高三三月联合测评(一模)化学试卷
名校
解题方法
5 . 我国科学家成功利用光伏发电,将电解水获得的 与
与 反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。该研究成果已在国际学术期刊《科学》上发表。回答下列问题:
反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。该研究成果已在国际学术期刊《科学》上发表。回答下列问题:
(1) 人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。
人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。 的
的
__________ (用含 、
、 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)有学者结合实验和计算机模拟结果,得出 的一种反应历程如图所示,其中吸附在催化剂表面的物种用“·”标注,TS1、TS2、TS3、TS4均为过渡态。决速步骤对应的化学方程式为
的一种反应历程如图所示,其中吸附在催化剂表面的物种用“·”标注,TS1、TS2、TS3、TS4均为过渡态。决速步骤对应的化学方程式为__________ ;TS3对应的步骤适合在__________ (填“高温”或“低温”)条件下进行。 和
和 ,发生反应
,发生反应
 ,在催化剂作用下单位时间内
,在催化剂作用下单位时间内 的转化率与温度、催化剂的关系如图所示。
的转化率与温度、催化剂的关系如图所示。 的生成速率
的生成速率__________ (填“>”“<”或“=”,下同) 的消耗速率;催化效率:Cat2
的消耗速率;催化效率:Cat2__________ Cat1。
②b点之后 的转化率降低,可能的原因是
的转化率降低,可能的原因是__________ 。
(4)已知 催化加氢的主要反应如下:
催化加氢的主要反应如下:
反应Ⅰ.
反应Ⅱ.
①230℃时,将 和
和 按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应Ⅰ和反应Ⅱ,容器内压强随时间的变化如下表所示。
按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应Ⅰ和反应Ⅱ,容器内压强随时间的变化如下表所示。
平衡时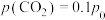 ,则该温度下反应Ⅰ的化学平衡常数
,则该温度下反应Ⅰ的化学平衡常数
__________ 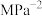 (用含
(用含 的代数式表示)。
的代数式表示)。
②二氧化碳催化加氢合成甲醇反应往往伴随副反应Ⅱ。一定温度和压强条件下,为了提高反应速率和甲醇选择性,应当__________ 。
 与
与 反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。该研究成果已在国际学术期刊《科学》上发表。回答下列问题:
反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。该研究成果已在国际学术期刊《科学》上发表。回答下列问题:(1)
 人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。
人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。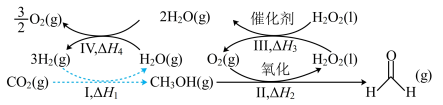
 的
的
 、
、 、
、 、
、 的代数式表示)。
的代数式表示)。(2)有学者结合实验和计算机模拟结果,得出
 的一种反应历程如图所示,其中吸附在催化剂表面的物种用“·”标注,TS1、TS2、TS3、TS4均为过渡态。决速步骤对应的化学方程式为
的一种反应历程如图所示,其中吸附在催化剂表面的物种用“·”标注,TS1、TS2、TS3、TS4均为过渡态。决速步骤对应的化学方程式为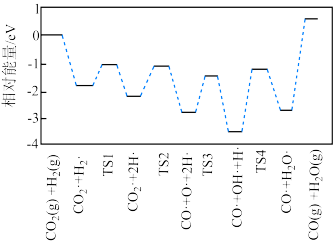
 和
和 ,发生反应
,发生反应
 ,在催化剂作用下单位时间内
,在催化剂作用下单位时间内 的转化率与温度、催化剂的关系如图所示。
的转化率与温度、催化剂的关系如图所示。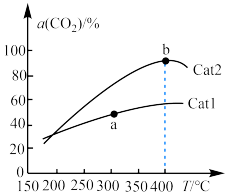
 的生成速率
的生成速率 的消耗速率;催化效率:Cat2
的消耗速率;催化效率:Cat2②b点之后
 的转化率降低,可能的原因是
的转化率降低,可能的原因是(4)已知
 催化加氢的主要反应如下:
催化加氢的主要反应如下:反应Ⅰ.

反应Ⅱ.

①230℃时,将
 和
和 按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应Ⅰ和反应Ⅱ,容器内压强随时间的变化如下表所示。
按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应Ⅰ和反应Ⅱ,容器内压强随时间的变化如下表所示。时间/min | 0 | 20 | 40 | 60 | 80 |
压强/MPa |
|
|
|
|
|
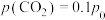 ,则该温度下反应Ⅰ的化学平衡常数
,则该温度下反应Ⅰ的化学平衡常数
 (用含
(用含 的代数式表示)。
的代数式表示)。②二氧化碳催化加氢合成甲醇反应往往伴随副反应Ⅱ。一定温度和压强条件下,为了提高反应速率和甲醇选择性,应当
您最近半年使用:0次
2024-04-07更新
|
334次组卷
|
4卷引用:湖北省九师联盟2024届高三下学期3月质量检测(W-G)化学试卷
6 . 含氮化合物广泛存在于自然界,是一类常见的化合物。
(1)汽车尾气是城市空气的主要污染物之一,汽车内燃机工作时发生反应:N2(g)+O2(g)=2NO(g),H2可以催化还原NO以达到消除污染的目的。
已知反应Ⅰ、N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1;
Ⅱ、2H2(g)+O2(g)=2H2O(1)ΔH=-571.6kJ·mol-1。
写出H2(g)与NO(g)反应生成N2(g)和H2O(1)的热化学方程式:___________ ,该反应自发进行的条件为___________ (填“高温”或“低温”)。
(2)已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。如图所示为其他条件不变时,反应2NO(g)+2CO(g) 2CO2(g)+N2(g)中c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线:
2CO2(g)+N2(g)中c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线:
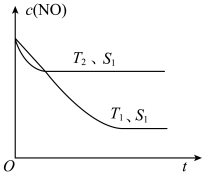
①该反应的ΔH___________ (填“>”或“<”)0。
②若催化剂的表面积S1>S2,在该图中画出该反应在T1、S2条件下达到平衡过程中c(NO)的变化曲线___________ 。
(3)尿素是一种重要的化工原料,工业上可用氨和二氧化碳合成尿素:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),ΔH<0,一定条件下,向10L恒容密闭容器中充入2molNH3和1molCO2。
CO(NH2)2(s)+H2O(g),ΔH<0,一定条件下,向10L恒容密闭容器中充入2molNH3和1molCO2。
①该反应10min后达到平衡,测得容器中气体密度为4.8g·L-1,则平衡常数K=___________ 。
②达到平衡后,再向容器中加入2molNH3(g)和1molCO2(g),则再次达到平衡时反应物NH3的转化率___________ (填“增大”“减小”或“不变”)。
③下列说法中,可以说明该反应已经达到平衡状态的有___________ (填序号)。
A.NH3和CO2的浓度之比为2∶1 B.2v正(NH3)=v逆(H2O)
C.气体的密度不变 D.容器内总压强不变
(4)N2O5是一种新型绿色硝化剂,其制备可以采用电解法。图甲是NaBH4燃料电池,图乙是电解制备N2O5装置,已知电解时电极a与电极d相连,电极c的反应式为___________ ,若制得10.8g N2O5,则消耗NaBH4的质量为___________ g。

(1)汽车尾气是城市空气的主要污染物之一,汽车内燃机工作时发生反应:N2(g)+O2(g)=2NO(g),H2可以催化还原NO以达到消除污染的目的。
已知反应Ⅰ、N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1;
Ⅱ、2H2(g)+O2(g)=2H2O(1)ΔH=-571.6kJ·mol-1。
写出H2(g)与NO(g)反应生成N2(g)和H2O(1)的热化学方程式:
(2)已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。如图所示为其他条件不变时,反应2NO(g)+2CO(g)
 2CO2(g)+N2(g)中c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线:
2CO2(g)+N2(g)中c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线:
①该反应的ΔH
②若催化剂的表面积S1>S2,在该图中画出该反应在T1、S2条件下达到平衡过程中c(NO)的变化曲线
(3)尿素是一种重要的化工原料,工业上可用氨和二氧化碳合成尿素:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g),ΔH<0,一定条件下,向10L恒容密闭容器中充入2molNH3和1molCO2。
CO(NH2)2(s)+H2O(g),ΔH<0,一定条件下,向10L恒容密闭容器中充入2molNH3和1molCO2。①该反应10min后达到平衡,测得容器中气体密度为4.8g·L-1,则平衡常数K=
②达到平衡后,再向容器中加入2molNH3(g)和1molCO2(g),则再次达到平衡时反应物NH3的转化率
③下列说法中,可以说明该反应已经达到平衡状态的有
A.NH3和CO2的浓度之比为2∶1 B.2v正(NH3)=v逆(H2O)
C.气体的密度不变 D.容器内总压强不变
(4)N2O5是一种新型绿色硝化剂,其制备可以采用电解法。图甲是NaBH4燃料电池,图乙是电解制备N2O5装置,已知电解时电极a与电极d相连,电极c的反应式为

您最近半年使用:0次
7 . 联氨(又称肼,N2H4无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子是___________ 分子(填“极性”或“非极性”),其中氮的杂化方式为___________ 。
(2)①2O2(g)+N2(g)=N2O4(1) H1
H1
②N2(g)+2H2(g)=N2H4(1) H2
H2
③O2(g)+2H2(g)=2H2O(g) H3
H3
④2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H4=-1048.9kJ/mo1
上述反应热效应之间的关系式为△H4=___________ ,联氨和N2O4可作为火箭推进剂的主要原因为___________ 。
(3)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________ (已知:N2H4+H+
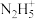 的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为
的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为___________ 。
(4)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并有气泡产生﹐发生的化学方程式为___________ 。联氨可用于处理高压锅炉水中的氧。防止锅炉被腐蚀。理论上2kg的联氨可除去水中溶解的O2___________ kg。
(1)联氨分子是
(2)①2O2(g)+N2(g)=N2O4(1)
 H1
H1②N2(g)+2H2(g)=N2H4(1)
 H2
H2③O2(g)+2H2(g)=2H2O(g)
 H3
H3④2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H4=-1048.9kJ/mo1
上述反应热效应之间的关系式为△H4=
(3)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为

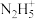 的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为
的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为(4)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并有气泡产生﹐发生的化学方程式为
您最近半年使用:0次
名校
8 .  的转化和利用是实现碳中和的有效途径。其中
的转化和利用是实现碳中和的有效途径。其中 转换为
转换为 被认为是最可能利用的路径,该路径涉及反应如下:
被认为是最可能利用的路径,该路径涉及反应如下:
反应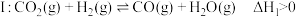
反应Ⅱ:
请回答下列问题:
(1)在特定温度下,由稳定态单质生成 化合物的焓变叫该物质在此温度下的标准生成焓
化合物的焓变叫该物质在此温度下的标准生成焓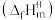 。下表为几种物质在
。下表为几种物质在 的标准生成焓,则反应
的标准生成焓,则反应 的
的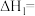
______  。
。
(2)为了提高 的平衡转化率和增大甲醇的选择性
的平衡转化率和增大甲醇的选择性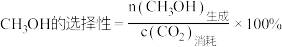 ,可采用的措施是:
,可采用的措施是:______ 。
a.增大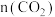 b.及时移除甲醇 c.减小容器体积 d.充入
b.及时移除甲醇 c.减小容器体积 d.充入
(3)保持温度恒定,向某恒容容器中按体积比1:3:1充入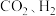 和
和 ,起始压强为
,起始压强为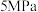 。发生上述平行反应,达到平衡后压强为
。发生上述平行反应,达到平衡后压强为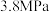 。已知达到平衡时
。已知达到平衡时 的选择性为
的选择性为 。则:
。则:
①下列不能作为反应(反应Ⅰ和反应Ⅱ)达到平衡状态的判据是______ (填标号)。
A.气体的密度不再变化 B.容器的总压强不再改变
C.气体的平均摩尔质量不再变化 D. 的分压不再改变
的分压不再改变
② 的转化率为
的转化率为______  ;该条件下反应Ⅰ的压强平衡常数
;该条件下反应Ⅰ的压强平衡常数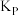 为
为______ (用分压表示,分压=总压 物质的量分数)
物质的量分数)
(4)已知Arrhenius经验公式为 (
(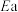 为活化能,
为活化能,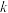 为速率常数,
为速率常数, 和
和 为常数),为探究m、n两种催化剂对反应I的催化效能,进行了实验探究,依据实验数据获得下图。在
为常数),为探究m、n两种催化剂对反应I的催化效能,进行了实验探究,依据实验数据获得下图。在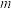 催化剂作用下,该反应的活化能
催化剂作用下,该反应的活化能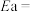
______  ,从图中信息获知催化性能较高的催化剂是
,从图中信息获知催化性能较高的催化剂是______ (填“ ”或“
”或“ ”)。
”)。

 的转化和利用是实现碳中和的有效途径。其中
的转化和利用是实现碳中和的有效途径。其中 转换为
转换为 被认为是最可能利用的路径,该路径涉及反应如下:
被认为是最可能利用的路径,该路径涉及反应如下:反应
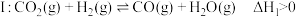
反应Ⅱ:

请回答下列问题:
(1)在特定温度下,由稳定态单质生成
 化合物的焓变叫该物质在此温度下的标准生成焓
化合物的焓变叫该物质在此温度下的标准生成焓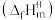 。下表为几种物质在
。下表为几种物质在 的标准生成焓,则反应
的标准生成焓,则反应 的
的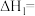
 。
。物质 |
|
|
|
|
| 0 | -394 | -111 | -242 |
(2)为了提高
 的平衡转化率和增大甲醇的选择性
的平衡转化率和增大甲醇的选择性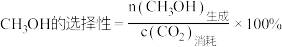 ,可采用的措施是:
,可采用的措施是:a.增大
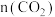 b.及时移除甲醇 c.减小容器体积 d.充入
b.及时移除甲醇 c.减小容器体积 d.充入
(3)保持温度恒定,向某恒容容器中按体积比1:3:1充入
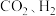 和
和 ,起始压强为
,起始压强为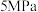 。发生上述平行反应,达到平衡后压强为
。发生上述平行反应,达到平衡后压强为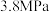 。已知达到平衡时
。已知达到平衡时 的选择性为
的选择性为 。则:
。则:①下列不能作为反应(反应Ⅰ和反应Ⅱ)达到平衡状态的判据是
A.气体的密度不再变化 B.容器的总压强不再改变
C.气体的平均摩尔质量不再变化 D.
 的分压不再改变
的分压不再改变②
 的转化率为
的转化率为 ;该条件下反应Ⅰ的压强平衡常数
;该条件下反应Ⅰ的压强平衡常数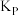 为
为 物质的量分数)
物质的量分数)(4)已知Arrhenius经验公式为
 (
(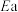 为活化能,
为活化能,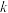 为速率常数,
为速率常数, 和
和 为常数),为探究m、n两种催化剂对反应I的催化效能,进行了实验探究,依据实验数据获得下图。在
为常数),为探究m、n两种催化剂对反应I的催化效能,进行了实验探究,依据实验数据获得下图。在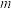 催化剂作用下,该反应的活化能
催化剂作用下,该反应的活化能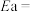
 ,从图中信息获知催化性能较高的催化剂是
,从图中信息获知催化性能较高的催化剂是 ”或“
”或“ ”)。
”)。
您最近半年使用:0次
解题方法
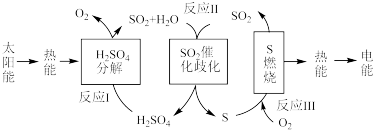
9 . SO2既是大气主要的污染物之一,又是工业制备硫酸的重要中间物质,研究SO2无害化处理,对治理大气污染、合理利用资源和建设生态文明具有重要意义。
Ⅰ.已知:①2SO2(g)+O2(g) 2SO3(g) ΔH = akJ/mol
2SO3(g) ΔH = akJ/mol
②2NO(g)+O2(g) 2NO2(g) ΔH = bkJ/mol
2NO2(g) ΔH = bkJ/mol
(1)NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=__________ kJ/mol(用a、b的代数式表示)。
(2)在一定温度下,将NO2和SO2以体积比1:2置于恒容容器中发生反应NO2(g)+SO2(g) SO3(g)+NO(g)。下列能说明反应达到平衡状态的是______填字母)。
SO3(g)+NO(g)。下列能说明反应达到平衡状态的是______填字母)。
Ⅱ.在一定条件下,SO2与O2发生反应:2SO2(g)+O2(g) 2SO3(g) 。
2SO3(g) 。
ⅰ.在不同温度下,一定量的SO2与O2在恒容容器发生反应2SO2(g)+O2(g) 2SO3(g) ,SO3的体积分数随时间变化如图:
2SO3(g) ,SO3的体积分数随时间变化如图:
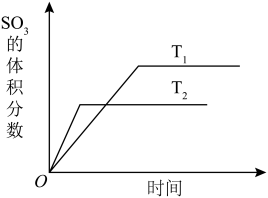
(3)该反应的ΔH______ 0 (填“>”“<”或“=”),判断依据是__________ 。
(4)若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1_______ K2(填“>”“<”或“=”)。
(5)在T℃时,向体积为1L的密闭容器中,通入2molSO2和1molO2,反应一段时间达到平衡,此时SO2的转化率为90%,则T℃时该反应的平衡常数K=__________ 。
ⅱ.硫酸工业中,在接触室发生反应:2SO2(g)+O2(g) 2SO3(g)。
2SO3(g)。
(6)生产中需要通入过量的空气,目的是__________ 。
Ⅰ.已知:①2SO2(g)+O2(g)
 2SO3(g) ΔH = akJ/mol
2SO3(g) ΔH = akJ/mol ②2NO(g)+O2(g)
 2NO2(g) ΔH = bkJ/mol
2NO2(g) ΔH = bkJ/mol(1)NO2(g)+SO2(g)
 SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=(2)在一定温度下,将NO2和SO2以体积比1:2置于恒容容器中发生反应NO2(g)+SO2(g)
 SO3(g)+NO(g)。下列能说明反应达到平衡状态的是______填字母)。
SO3(g)+NO(g)。下列能说明反应达到平衡状态的是______填字母)。| A.体系压强保持不变 |
| B.混合气体的密度保持不变 |
| C.混合气体的颜色保持不变 |
| D.每生成1molSO3消耗1molNO2 |
Ⅱ.在一定条件下,SO2与O2发生反应:2SO2(g)+O2(g)
 2SO3(g) 。
2SO3(g) 。ⅰ.在不同温度下,一定量的SO2与O2在恒容容器发生反应2SO2(g)+O2(g)
 2SO3(g) ,SO3的体积分数随时间变化如图:
2SO3(g) ,SO3的体积分数随时间变化如图:
(3)该反应的ΔH
(4)若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1
(5)在T℃时,向体积为1L的密闭容器中,通入2molSO2和1molO2,反应一段时间达到平衡,此时SO2的转化率为90%,则T℃时该反应的平衡常数K=
ⅱ.硫酸工业中,在接触室发生反应:2SO2(g)+O2(g)
 2SO3(g)。
2SO3(g)。(6)生产中需要通入过量的空气,目的是
您最近半年使用:0次
名校
解题方法
10 . 为了实现“碳达峰”和“碳中和”的目标,将 转化成可利用的化学能源的“负碳”技术是世界各国关注的焦点。回答下列问题:
转化成可利用的化学能源的“负碳”技术是世界各国关注的焦点。回答下列问题:
方法Ⅰ: 催化加氢制甲醇。
催化加氢制甲醇。
以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
反应ⅰ: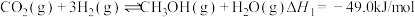
反应ⅱ:
反应ⅲ: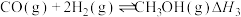
(1)计算反应ⅲ的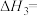
______ 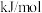 。
。
(2)一定温度和催化剂条件下,在密闭恒容容器中按照投料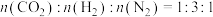 发生反应(
发生反应( 不参与反应),平衡时
不参与反应),平衡时 的转化率、
的转化率、 和CO的选择性(如
和CO的选择性(如 的选择性
的选择性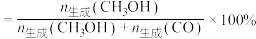 )随温度的变化曲线如图所示。
)随温度的变化曲线如图所示。

①图中曲线a表示物质______ 的变化(填“ ”“
”“ ”或“CO”)。
”或“CO”)。
②上述反应体系在一定条件下建立平衡后,下列说法正确的有______ (填标号)。
A.升高温度,反应ⅰ逆向移动,所以正反应速率减小
B.向容器中再通入少量 ,
, 的平衡转化率下降
的平衡转化率下降
C.移去部分 ,反应ⅲ平衡一定不移动
,反应ⅲ平衡一定不移动
D.选择合适的催化剂能提高 的选择性
的选择性
③保持温度不变,在恒容反应器中,初始总压为5p kPa,只发生反应ⅰ和ⅱ,达到平衡时 的转化率为80%,CO的选择性为25%,则
的转化率为80%,CO的选择性为25%,则 的转化率为
的转化率为______ ,反应ⅱ的压强平衡常数
______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
方法Ⅱ:催化加氢制甲酸
(3)科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的 转化为HCOOH,实现碳中和的目标。
转化为HCOOH,实现碳中和的目标。
已知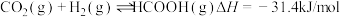 。温度为
。温度为 达到平衡时,化学平衡常数
达到平衡时,化学平衡常数 。实验测得:
。实验测得: ,
, ,
, 、
、 为速率常数。
为速率常数。 时,
时,
______  ;若温度为
;若温度为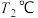 达到平衡时,
达到平衡时, ,则
,则
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
 转化成可利用的化学能源的“负碳”技术是世界各国关注的焦点。回答下列问题:
转化成可利用的化学能源的“负碳”技术是世界各国关注的焦点。回答下列问题:方法Ⅰ:
 催化加氢制甲醇。
催化加氢制甲醇。以
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:反应ⅰ:
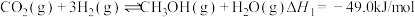
反应ⅱ:

反应ⅲ:
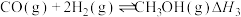
(1)计算反应ⅲ的
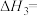
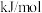 。
。(2)一定温度和催化剂条件下,在密闭恒容容器中按照投料
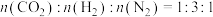 发生反应(
发生反应( 不参与反应),平衡时
不参与反应),平衡时 的转化率、
的转化率、 和CO的选择性(如
和CO的选择性(如 的选择性
的选择性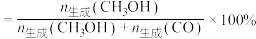 )随温度的变化曲线如图所示。
)随温度的变化曲线如图所示。
①图中曲线a表示物质
 ”“
”“ ”或“CO”)。
”或“CO”)。②上述反应体系在一定条件下建立平衡后,下列说法正确的有
A.升高温度,反应ⅰ逆向移动,所以正反应速率减小
B.向容器中再通入少量
 ,
, 的平衡转化率下降
的平衡转化率下降C.移去部分
 ,反应ⅲ平衡一定不移动
,反应ⅲ平衡一定不移动D.选择合适的催化剂能提高
 的选择性
的选择性③保持温度不变,在恒容反应器中,初始总压为5p kPa,只发生反应ⅰ和ⅱ,达到平衡时
 的转化率为80%,CO的选择性为25%,则
的转化率为80%,CO的选择性为25%,则 的转化率为
的转化率为
方法Ⅱ:催化加氢制甲酸
(3)科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的
 转化为HCOOH,实现碳中和的目标。
转化为HCOOH,实现碳中和的目标。已知
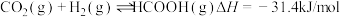 。温度为
。温度为 达到平衡时,化学平衡常数
达到平衡时,化学平衡常数 。实验测得:
。实验测得: ,
, ,
, 、
、 为速率常数。
为速率常数。 时,
时,
 ;若温度为
;若温度为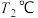 达到平衡时,
达到平衡时, ,则
,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近半年使用:0次