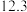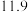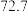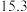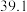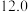1 . CH3OH是重要的能源物质,CO2转化为甲醇是一种有效减少CO2排放的方法。
(1) 加氢制甲醇过程中发生的主要反应为反应Ⅰ
加氢制甲醇过程中发生的主要反应为反应Ⅰ  ,
,
该反应一般认为通过反应Ⅱ和反应Ⅲ两步实现。
反应Ⅱ

反应Ⅲ
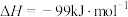
若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
(2)向恒温2L容器中充入一定量 和
和 ,发生反应
,发生反应
 。图中过程Ⅰ、Ⅱ是在不同催化剂作用下
。图中过程Ⅰ、Ⅱ是在不同催化剂作用下 的转化率
的转化率 随时间(t)的变化曲线。
随时间(t)的变化曲线。
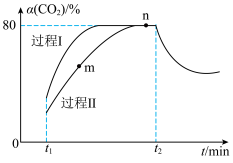
下列说法正确的是___________(填序号)。
(3)在25℃和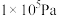 的条件下,发生反应
的条件下,发生反应 ,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
①压强从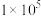 到
到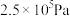 ,平衡
,平衡___________ (填“正向”“逆向”或“不”)移动;
②压强从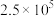 到
到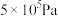 ,浓度从0.20变为
,浓度从0.20变为 的原因是
的原因是___________ 。
(4)在温度 、容积2L的密闭容器中加入1mol
、容积2L的密闭容器中加入1mol 和3mol
和3mol 发生如下反应:
发生如下反应: ,平衡后
,平衡后 的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol
的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol 、4.2mol
、4.2mol 、1mol
、1mol 、2mol
、2mol ,平衡后,
,平衡后,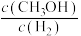
___________  (填“>”“<”“=”或“不能确定”)
(填“>”“<”“=”或“不能确定”)
(5)温度为 时,在容积为2L的密闭容器中加入1mol
时,在容积为2L的密闭容器中加入1mol 和3mol
和3mol 发生下列反应,平衡时
发生下列反应,平衡时 的物质的量为0.5mol。反应开始时与平衡时压强之比为
的物质的量为0.5mol。反应开始时与平衡时压强之比为___________ 。
反应Ⅰ
反应Ⅱ
反应Ⅲ
(1)
 加氢制甲醇过程中发生的主要反应为反应Ⅰ
加氢制甲醇过程中发生的主要反应为反应Ⅰ  ,
,该反应一般认为通过反应Ⅱ和反应Ⅲ两步实现。
反应Ⅱ


反应Ⅲ

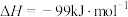
若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
A.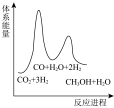 | B.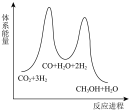 | C. | D. |
(2)向恒温2L容器中充入一定量
 和
和 ,发生反应
,发生反应
 。图中过程Ⅰ、Ⅱ是在不同催化剂作用下
。图中过程Ⅰ、Ⅱ是在不同催化剂作用下 的转化率
的转化率 随时间(t)的变化曲线。
随时间(t)的变化曲线。
下列说法正确的是___________(填序号)。
A.m点: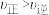 |
B. 时刻改变的反应条件可能是增大水蒸气的浓度 时刻改变的反应条件可能是增大水蒸气的浓度 |
| C.活化能:过程Ⅱ<过程Ⅰ |
D. 时刻改变的反应条件可能是降低温度 时刻改变的反应条件可能是降低温度 |
(3)在25℃和
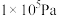 的条件下,发生反应
的条件下,发生反应 ,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。| 压强(Pa) | 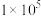 | 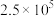 | 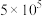 |
浓度( ) ) | 0.08 | 0.20 | 0.44 |
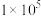 到
到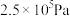 ,平衡
,平衡②压强从
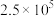 到
到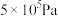 ,浓度从0.20变为
,浓度从0.20变为 的原因是
的原因是(4)在温度
 、容积2L的密闭容器中加入1mol
、容积2L的密闭容器中加入1mol 和3mol
和3mol 发生如下反应:
发生如下反应: ,平衡后
,平衡后 的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol
的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol 、4.2mol
、4.2mol 、1mol
、1mol 、2mol
、2mol ,平衡后,
,平衡后,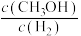
 (填“>”“<”“=”或“不能确定”)
(填“>”“<”“=”或“不能确定”)(5)温度为
 时,在容积为2L的密闭容器中加入1mol
时,在容积为2L的密闭容器中加入1mol 和3mol
和3mol 发生下列反应,平衡时
发生下列反应,平衡时 的物质的量为0.5mol。反应开始时与平衡时压强之比为
的物质的量为0.5mol。反应开始时与平衡时压强之比为反应Ⅰ

反应Ⅱ

反应Ⅲ

您最近一年使用:0次
名校
解题方法
2 . 萘类物质的加成反应,可以合成多种环状结构的异构体,并在工业中有重要应用,利用1-甲基萘(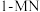 )制备四氢萘类物质(
)制备四氢萘类物质( ,包括
,包括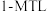 和
和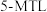 )。反应过程中伴有生成十氢萘(
)。反应过程中伴有生成十氢萘(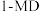 )的副反应,涉及反应如图:
)的副反应,涉及反应如图:
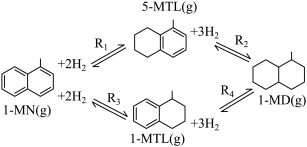
请回答下列问题:
(1)已知一定条件下反应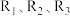 的焓变分别为
的焓变分别为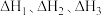 ,则反应
,则反应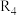 的焓变
的焓变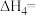
______ (用含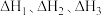 的代数式表示)。
的代数式表示)。
(2)根据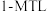 和
和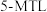 的结构及命名方式,
的结构及命名方式,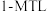 和
和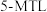 的一种同分异构体
的一种同分异构体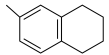 的名称为
的名称为______  。
。
(3)四个平衡体系的平衡常数与温度的关系如图所示。
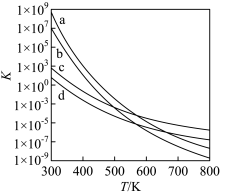
①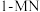 ,
, ,
,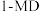 中最稳定的是
中最稳定的是______ 。
②不考虑生成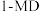 ,从反应进行程度上考虑,利于生成
,从反应进行程度上考虑,利于生成 的条件是
的条件是______ 。
③若曲线c、d分别代表反应 、
、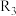 的平衡常数随温度的变化,则表示反应
的平衡常数随温度的变化,则表示反应 的平衡常数随温度变化的曲线为
的平衡常数随温度变化的曲线为______ 。
(4)某温度下,将一定量的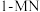 、投入一密闭容器中,检测到四种有机物的物质的量随时间的变化关系如图乙所示。
、投入一密闭容器中,检测到四种有机物的物质的量随时间的变化关系如图乙所示。
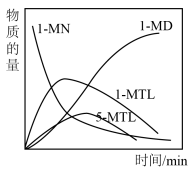
在此温度下,如何更多的得到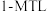
______ 。
a.延长反应时间
b.增大压强
c.使用选择性更高的催化剂
d反应初期生成较多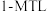 时,及时分离出
时,及时分离出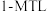
(5) 时,在体积恒定的密闭容器中投入一定量的
时,在体积恒定的密闭容器中投入一定量的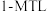 ,假定只发生
,假定只发生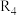 过程,
过程, 足量,且反应过程中氢气的浓度恒定为
足量,且反应过程中氢气的浓度恒定为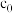 ,当
,当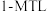 的转化率为a时,反应的平衡常数为
的转化率为a时,反应的平衡常数为______ 。
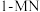 )制备四氢萘类物质(
)制备四氢萘类物质( ,包括
,包括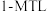 和
和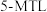 )。反应过程中伴有生成十氢萘(
)。反应过程中伴有生成十氢萘(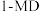 )的副反应,涉及反应如图:
)的副反应,涉及反应如图:
请回答下列问题:
(1)已知一定条件下反应
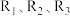 的焓变分别为
的焓变分别为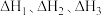 ,则反应
,则反应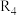 的焓变
的焓变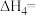
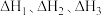 的代数式表示)。
的代数式表示)。(2)根据
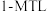 和
和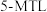 的结构及命名方式,
的结构及命名方式,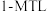 和
和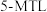 的一种同分异构体
的一种同分异构体 的名称为
的名称为 。
。(3)四个平衡体系的平衡常数与温度的关系如图所示。

①
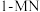 ,
, ,
,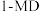 中最稳定的是
中最稳定的是②不考虑生成
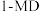 ,从反应进行程度上考虑,利于生成
,从反应进行程度上考虑,利于生成 的条件是
的条件是③若曲线c、d分别代表反应
 、
、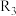 的平衡常数随温度的变化,则表示反应
的平衡常数随温度的变化,则表示反应 的平衡常数随温度变化的曲线为
的平衡常数随温度变化的曲线为(4)某温度下,将一定量的
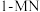 、投入一密闭容器中,检测到四种有机物的物质的量随时间的变化关系如图乙所示。
、投入一密闭容器中,检测到四种有机物的物质的量随时间的变化关系如图乙所示。
在此温度下,如何更多的得到
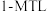
a.延长反应时间
b.增大压强
c.使用选择性更高的催化剂
d反应初期生成较多
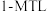 时,及时分离出
时,及时分离出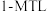
(5)
 时,在体积恒定的密闭容器中投入一定量的
时,在体积恒定的密闭容器中投入一定量的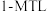 ,假定只发生
,假定只发生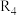 过程,
过程, 足量,且反应过程中氢气的浓度恒定为
足量,且反应过程中氢气的浓度恒定为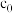 ,当
,当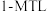 的转化率为a时,反应的平衡常数为
的转化率为a时,反应的平衡常数为
您最近一年使用:0次
2023-12-08更新
|
396次组卷
|
2卷引用:湖北省十一校2023-2024学年高三上学期第一次联考化学试题
解题方法
3 . 以钛铁矿(主要成分 ,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为: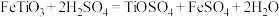 。
。
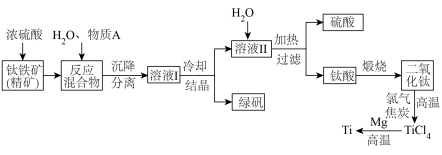
回答下列问题:
(1)钛铁矿和浓硫酸反应属于___________ (选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止 被氧化,物质A是
被氧化,物质A是___________ ,上述制备 的过程中,所得到的副产物和可回收利用的物质分别是
的过程中,所得到的副产物和可回收利用的物质分别是___________ 、___________ 。
(3)反应 在Ar气氛中进行的理由是
在Ar气氛中进行的理由是___________ 。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
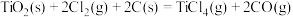
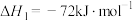

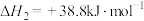

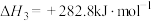
反应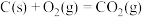 的
的
___________ 。
 ,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为: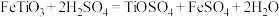 。
。
回答下列问题:
(1)钛铁矿和浓硫酸反应属于
(2)上述生产流程中加入物质A的目的是防止
 被氧化,物质A是
被氧化,物质A是 的过程中,所得到的副产物和可回收利用的物质分别是
的过程中,所得到的副产物和可回收利用的物质分别是(3)反应
 在Ar气氛中进行的理由是
在Ar气氛中进行的理由是(4)由二氧化钛制取四氯化钛所涉及的反应有:
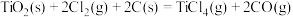
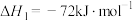

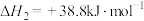

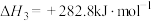
反应
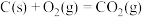 的
的
您最近一年使用:0次
2023-11-26更新
|
46次组卷
|
2卷引用:湖北省黄州中学(黄冈市外国语学校)2023-2024学年高二上学期9月月考化学试题
名校
解题方法
4 . 氮氧化物(NOx)的排放对环境造成严重污染。工业上可利用C(s)+2NO(g)⇌CO2(g)+N2(g)反应处理氮氧化物。回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1,碳的燃烧热为393.5kJ·mol-1,则C(s)+2NO(g)⇌CO2(g)+N2(g) ΔH2=_______ kJ·mol-1
(2)一定温度下,在恒容密闭容器中充入足量单质C和一定量NO,发生上述反应。下列情况能说明反应达到化学平衡状态的是_______ (填字母标号),反应达平衡后继续通入一定量NO,NO的转化率_______ (填“增大”、“减小”或“不变”)。
A.υ(NO)=2υ(CO2) B.容器内气体的压强保持不变
C.NO与CO2的浓度比保持不变 D.混合气体的平均相对分子质量保持不变
(3)某温度下,向盛有足量单质C的恒容密闭容器通入NO,使其初始浓度为1mol·L-1,根据平衡时以某物质表示的 正(或
正(或 逆)、浓度的数值,绘制出图中甲乙两点。
逆)、浓度的数值,绘制出图中甲乙两点。
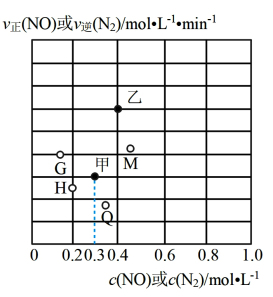
①甲点对应的物质是_______ (填化学式);该反应的平衡常数为_______ 。
②将温度降低至某一温度时,反应重新达到平衡,此时体系的压强为p=105Pa,NO的体积分数为30%,则N2的分压为p(N2)=_______ Pa(气体分压=总压×该气体物质的量分数),则图中甲点可能移动至点位置_______ (填字母标号)。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1,碳的燃烧热为393.5kJ·mol-1,则C(s)+2NO(g)⇌CO2(g)+N2(g) ΔH2=
(2)一定温度下,在恒容密闭容器中充入足量单质C和一定量NO,发生上述反应。下列情况能说明反应达到化学平衡状态的是
A.υ(NO)=2υ(CO2) B.容器内气体的压强保持不变
C.NO与CO2的浓度比保持不变 D.混合气体的平均相对分子质量保持不变
(3)某温度下,向盛有足量单质C的恒容密闭容器通入NO,使其初始浓度为1mol·L-1,根据平衡时以某物质表示的
 正(或
正(或 逆)、浓度的数值,绘制出图中甲乙两点。
逆)、浓度的数值,绘制出图中甲乙两点。
①甲点对应的物质是
②将温度降低至某一温度时,反应重新达到平衡,此时体系的压强为p=105Pa,NO的体积分数为30%,则N2的分压为p(N2)=
您最近一年使用:0次
名校
5 . 近年来我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知:

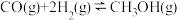
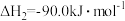
写出 催化氢化合成甲醇的热化学方程式
催化氢化合成甲醇的热化学方程式_____ 。
(2)为提高 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是______ (填序号)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由 催化氢化合成
催化氢化合成 ,如图为不同投料比
,如图为不同投料比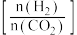 时某反应物X的平衡转化率的变化曲线。
时某反应物X的平衡转化率的变化曲线。
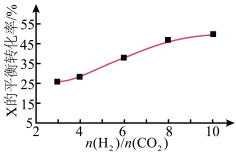
反应物X是___ (填“ ”或“
”或“ ”)。
”)。
(4)250℃时,在体积为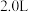 的恒容密闭容器中加入
的恒容密闭容器中加入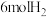 、
、 和催化剂,10min时反应达到平衡,测得
和催化剂,10min时反应达到平衡,测得 。
。
①前10min内 的平均反应速率
的平均反应速率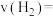
____  。
。
②化学平衡常数
________ 。
③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
根据上表所给数据,用 生产甲醇的最优条件为
生产甲醇的最优条件为___ (填实验编号)。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:(1)已知:


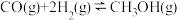
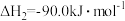
写出
 催化氢化合成甲醇的热化学方程式
催化氢化合成甲醇的热化学方程式(2)为提高
 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由
 催化氢化合成
催化氢化合成 ,如图为不同投料比
,如图为不同投料比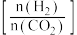 时某反应物X的平衡转化率的变化曲线。
时某反应物X的平衡转化率的变化曲线。
反应物X是
 ”或“
”或“ ”)。
”)。(4)250℃时,在体积为
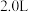 的恒容密闭容器中加入
的恒容密闭容器中加入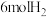 、
、 和催化剂,10min时反应达到平衡,测得
和催化剂,10min时反应达到平衡,测得 。
。①前10min内
 的平均反应速率
的平均反应速率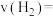
 。
。②化学平衡常数

③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
实验编号 | 温度/K | 催化剂 |
| 甲醇的选择性/% |
A | 543 |
|
|
|
B | 543 |
|
|
|
C | 553 |
|
|
|
D | 553 |
|
|
|
根据上表所给数据,用
 生产甲醇的最优条件为
生产甲醇的最优条件为
您最近一年使用:0次
2020-10-10更新
|
338次组卷
|
8卷引用:湖北省沙市中学2022-2023学年高二上学期第二次月考化学试题
湖北省沙市中学2022-2023学年高二上学期第二次月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第4节 化学反应条件的优化——工业合成氨 高效手册人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第四节 化学反应的调控四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题甘肃省武威市民勤县第一中学2020-2021学年高二上学期12月月考化学试题(理科)广东省揭阳华侨高级中学2021-2022学年高二上学期期中考试化学试题广东省江门市新会区陈经纶中学2022-2023学年高二上学期第5段月考化学试题(已下线)化学反应速率与化学平衡——课时7化学反应的调控
解题方法
6 . 2018年6月27日,国务院发布《打赢蓝天保卫战三年行动计划》,该计划是中国政府部署的一项污染防治行动计划,旨在持续改善空气质量,为群众留住更多蓝天。对废气的进行必要的处理,让空气更加清洁是环境科学的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反应的平衡常数表达式为 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式_________________ 。
(2)用如图所示的电解装置可将雾霾中的NO、SO2分别转化为NH 和SO
和SO
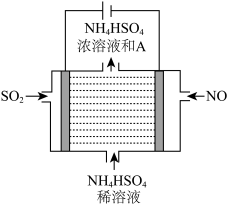
①写出物质A的化学式____________ 。
②NO在电极上发生的反应为_________________ 。
SO2在电极上发生的反应为__________________ 。
(3)工业上常用氨水吸收SO2,可生成NH4HSO3和(NH4)2SO3。
①某同学测得氨水吸收SO2所得溶液中NH4HSO3和(NH4)2SO3的物质的量之比恰好为2:1,写出该吸收过程的总反应方程式______________________________________ 。
②已知常温下H2S的电离常数Ka1=1.3×10-7,Ka2=7.1×10-15,将等物质的量浓度的NaHS与Na2S溶液等体积混合,所得溶液中离子浓度大小顺序为__________________ 。(用物质的量浓度符号由大到小排列)
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反应的平衡常数表达式为
 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)用如图所示的电解装置可将雾霾中的NO、SO2分别转化为NH
 和SO
和SO

①写出物质A的化学式
②NO在电极上发生的反应为
SO2在电极上发生的反应为
(3)工业上常用氨水吸收SO2,可生成NH4HSO3和(NH4)2SO3。
①某同学测得氨水吸收SO2所得溶液中NH4HSO3和(NH4)2SO3的物质的量之比恰好为2:1,写出该吸收过程的总反应方程式
②已知常温下H2S的电离常数Ka1=1.3×10-7,Ka2=7.1×10-15,将等物质的量浓度的NaHS与Na2S溶液等体积混合,所得溶液中离子浓度大小顺序为
您最近一年使用:0次
7 . 多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
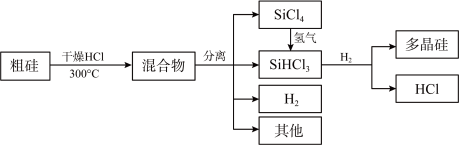
回答下列问题:
Ⅰ.硅粉与 在300℃时反应生成
在300℃时反应生成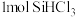 气体和
气体和 ,放出
,放出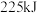 热量,该反应的热化学方程式为
热量,该反应的热化学方程式为________________________ 。 的电子式为
的电子式为__________________ 。
Ⅱ.将 氢化为
氢化为 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①

②
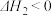
③
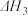
(1)氢化过程中所需的高纯度 可用惰性电极电解
可用惰性电极电解 溶液制备,写出产生
溶液制备,写出产生 的电极名称
的电极名称______ (填“阳极”或“阴极”),该电极反应方程式为________________________ 。

(2)已知体系自由能变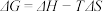 ,
,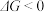 时反应自发进行。三个氢化反应的
时反应自发进行。三个氢化反应的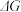 与温度的关系如图1所示,可知:反应①能自发进行的最低温度是
与温度的关系如图1所示,可知:反应①能自发进行的最低温度是____________ ;相同温度下,反应②比反应①的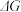 小,主要原因是
小,主要原因是________________________ 。
(3)不同温度下反应②中 转化率如图2所示。下列叙述正确的是
转化率如图2所示。下列叙述正确的是______ (填序号)。
a.B点: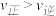 b.
b. :A点
:A点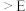 点 c.反应适宜温度:
点 c.反应适宜温度: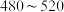 ℃
℃
(4)反应③的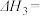
______ (用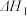 ,
,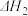 表示)。温度升高,反应③的平衡常数
表示)。温度升高,反应③的平衡常数
______ (填“增大”、“减小”或“不变”)。
(5)由粗硅制备多晶硅过程中循环使用的物质除 、
、 和
和 外,还有
外,还有______ (填分子式)。

回答下列问题:
Ⅰ.硅粉与
 在300℃时反应生成
在300℃时反应生成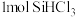 气体和
气体和 ,放出
,放出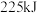 热量,该反应的热化学方程式为
热量,该反应的热化学方程式为 的电子式为
的电子式为Ⅱ.将
 氢化为
氢化为 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:①


②

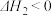
③

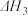
(1)氢化过程中所需的高纯度
 可用惰性电极电解
可用惰性电极电解 溶液制备,写出产生
溶液制备,写出产生 的电极名称
的电极名称
(2)已知体系自由能变
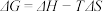 ,
,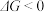 时反应自发进行。三个氢化反应的
时反应自发进行。三个氢化反应的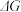 与温度的关系如图1所示,可知:反应①能自发进行的最低温度是
与温度的关系如图1所示,可知:反应①能自发进行的最低温度是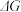 小,主要原因是
小,主要原因是(3)不同温度下反应②中
 转化率如图2所示。下列叙述正确的是
转化率如图2所示。下列叙述正确的是a.B点:
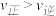 b.
b. :A点
:A点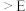 点 c.反应适宜温度:
点 c.反应适宜温度: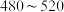 ℃
℃(4)反应③的
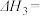
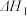 ,
,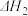 表示)。温度升高,反应③的平衡常数
表示)。温度升高,反应③的平衡常数
(5)由粗硅制备多晶硅过程中循环使用的物质除
 、
、 和
和 外,还有
外,还有
您最近一年使用:0次
2019-06-09更新
|
6307次组卷
|
9卷引用:湖北省黄石市有色第一中学2020-2021学年高二上学期期末考试化学试题
湖北省黄石市有色第一中学2020-2021学年高二上学期期末考试化学试题2019年天津高考化学试题(已下线)专题09 反应速率、化学平衡——2019年高考真题和模拟题化学分项汇编贵州省遵义市南白中学2019-2020学年高二上学期第三次月考化学试题(已下线)2.4+化学反应进行的方向-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)题型68 以流程为载体考查硅及其化合物的制备(已下线)专题17 原理综合题(已下线)T10-原理综合题
8 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=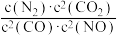 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:_______ ;下列措施能够增大此反应中NO的转化率的是(填字母代号)_______ 。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
①T1℃,0~5min内,以CO2表示的该反应速率v(CO2)=_______ ,该条件下的平衡常数K=_______ 。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______ 移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=_______ 。
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=
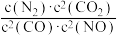 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
②第15 min后,温度调整到T2,数据变化如上表所示,则T1
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应
您最近一年使用:0次
2018-09-10更新
|
353次组卷
|
6卷引用:湖北省随州市第二高级中学2018-2019学年高二9月起点考试(B+C班)化学试题

 纳米棒
纳米棒