解题方法
1 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖。工业合成氨生产示意图如图所示。

(1)下列有关合成氨工业的说法正确的是_________
(2)循环利用的Y是氮气和氢气,目的是__________________ 。
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有_________ (填编号)。
①使用催化剂 ②恒温恒容,增大原料气 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体 使压强增大
使压强增大
(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分 值。
值。
分析数据可知:
①在 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻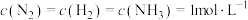 ,此时
,此时
_________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②人类不适合大规模模拟大气固氮的原因是__________________ 。
(5)为获得合成氨的原料气氢气,某科研小组以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下。
的过程如下。
已知: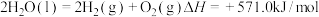 。
。
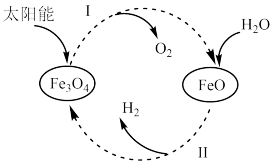
过程Ⅰ: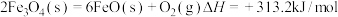
过程Ⅱ:……
过程Ⅱ的热化学方程式为_________ 。

(1)下列有关合成氨工业的说法正确的是_________
| A.工业合成氨的反应是熵减小的放热反应,在低温或常温时可自发进行 |
| B.合成氨反应中,反应物的总键能小于产物的总键能 |
C.合成氨厂一般采用的压强为 ,因为该压强下铁触媒的活性最高 ,因为该压强下铁触媒的活性最高 |
D. 的量越多, 的量越多, 的转化率越大,因此,充入的 的转化率越大,因此,充入的 越多越有利于 越多越有利于 的合成 的合成 |
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有
①使用催化剂 ②恒温恒容,增大原料气
 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体
 使压强增大
使压强增大(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分
 值。
值。| 反应 | 大气固氮 | 工业固氮 | |||
温度 | 27 | 2000 | 25 | 400 | 450 |
 |  | 0.1 | 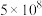 | 0.507 | 0.152 |
①在
 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻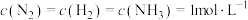 ,此时
,此时
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②人类不适合大规模模拟大气固氮的原因是
(5)为获得合成氨的原料气氢气,某科研小组以太阳能为热源分解
 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下。
的过程如下。已知:
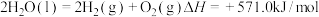 。
。
过程Ⅰ:
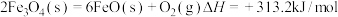
过程Ⅱ:……
过程Ⅱ的热化学方程式为
您最近一年使用:0次
2 . 能源是国民经济发展的重要基础。请根据所学知识回答下列问题:
Ⅰ.在标准状况下,1.68L家用燃料(仅由C、H两种元素组成的某气体)质量为1.2g,在25℃和101kPa下完全燃烧生成 和
和 时,放出66.77kJ的热量。
时,放出66.77kJ的热量。
(1)该气体的分子式为___________ 。该气体的燃烧热
___________ 。(保留一位小数)
Ⅱ.火箭发射时可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。
和水蒸气。
已知:
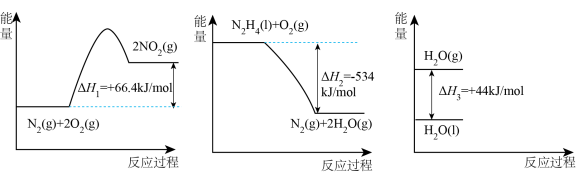
(2)请写出 与
与 反应的热化学方程式
反应的热化学方程式___________ 。
(3)32g液态肼与足量 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是___________ kJ。
(4)上述反应用于火箭推进器的原因:①能快速产生大量气体;②___________ 。
Ⅲ.氢能是一种极具发展潜力的清洁能源。 可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
已知:在25℃、101kPa下,
①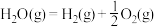
②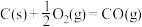
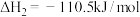
③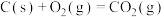

(5)25℃、101kPa下,CO与水蒸气反应转化为 和
和 的热化学方程式为
的热化学方程式为___________ 。
Ⅰ.在标准状况下,1.68L家用燃料(仅由C、H两种元素组成的某气体)质量为1.2g,在25℃和101kPa下完全燃烧生成
 和
和 时,放出66.77kJ的热量。
时,放出66.77kJ的热量。(1)该气体的分子式为

Ⅱ.火箭发射时可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。
和水蒸气。已知:

(2)请写出
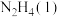 与
与 反应的热化学方程式
反应的热化学方程式(3)32g液态肼与足量
 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是(4)上述反应用于火箭推进器的原因:①能快速产生大量气体;②
Ⅲ.氢能是一种极具发展潜力的清洁能源。
 可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一已知:在25℃、101kPa下,
①
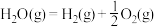
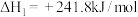
②
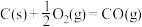
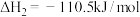
③
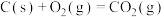

(5)25℃、101kPa下,CO与水蒸气反应转化为
 和
和 的热化学方程式为
的热化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题:
(1)工业生产中可利用 还原
还原 制备清洁能源甲醇。
制备清洁能源甲醇。
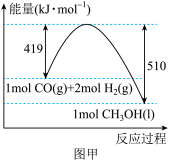
①已知 和
和 的燃烧热分别为283.0
的燃烧热分别为283.0 、285.8
、285.8 。
。 与
与 合成甲醇的能量变化如图甲所示,则用
合成甲醇的能量变化如图甲所示,则用 和
和 制备甲醇和液态水的热化学方程式为
制备甲醇和液态水的热化学方程式为_______ 。
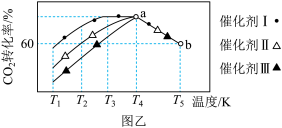
②将一定量的 和
和 充入某恒容密闭容器中,测得在不同催化剂作用下,相同时间内
充入某恒容密闭容器中,测得在不同催化剂作用下,相同时间内 的转化率与温度的变化如图乙所示,该反应在a点达到平衡状态,a点的转化率比b点的高,其原因
的转化率与温度的变化如图乙所示,该反应在a点达到平衡状态,a点的转化率比b点的高,其原因_______ 。
(2)利用 和水蒸气可生产
和水蒸气可生产 ,反应的化学方程式为CO(g)+H2O(g)
,反应的化学方程式为CO(g)+H2O(g)  CO2(g)+H2(g) 。将不同量的
CO2(g)+H2(g) 。将不同量的 和
和 分别通入体积为2L的恒容密闭容器中进行上述反应,得到数据如下表所示
分别通入体积为2L的恒容密闭容器中进行上述反应,得到数据如下表所示
①该反应的正反应为_______ 反应(填“放热”或“吸热”)。
②900℃时,从开始到达平衡时的反应速率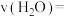
_______ (保留2位小数),达到平衡时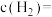
_______ 。
(3)利用废弃的 的热分解可生产
的热分解可生产 :2H2S(g)
:2H2S(g)  2H2(g)+ S2(g)。现将0.20
2H2(g)+ S2(g)。现将0.20
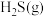 通入某恒压(压强
通入某恒压(压强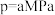 )密闭容器中,在不同温度下测得
)密闭容器中,在不同温度下测得 的平衡转化率如图所示。
的平衡转化率如图所示。
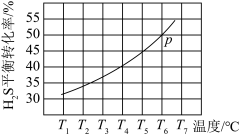
已知:对于气相反应,用某组分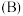 的平衡压强
的平衡压强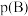 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数。温度为T 6℃时,该反应的平衡常数
也可表示平衡常数。温度为T 6℃时,该反应的平衡常数
_______ (用a的代数式表示)。
(1)工业生产中可利用
 还原
还原 制备清洁能源甲醇。
制备清洁能源甲醇。①已知
 和
和 的燃烧热分别为283.0
的燃烧热分别为283.0 、285.8
、285.8 。
。 与
与 合成甲醇的能量变化如图甲所示,则用
合成甲醇的能量变化如图甲所示,则用 和
和 制备甲醇和液态水的热化学方程式为
制备甲醇和液态水的热化学方程式为

②将一定量的
 和
和 充入某恒容密闭容器中,测得在不同催化剂作用下,相同时间内
充入某恒容密闭容器中,测得在不同催化剂作用下,相同时间内 的转化率与温度的变化如图乙所示,该反应在a点达到平衡状态,a点的转化率比b点的高,其原因
的转化率与温度的变化如图乙所示,该反应在a点达到平衡状态,a点的转化率比b点的高,其原因(2)利用
 和水蒸气可生产
和水蒸气可生产 ,反应的化学方程式为CO(g)+H2O(g)
,反应的化学方程式为CO(g)+H2O(g)  CO2(g)+H2(g) 。将不同量的
CO2(g)+H2(g) 。将不同量的 和
和 分别通入体积为2L的恒容密闭容器中进行上述反应,得到数据如下表所示
分别通入体积为2L的恒容密闭容器中进行上述反应,得到数据如下表所示| 温度/℃ | 起始量 | 达到平衡 | |||
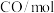 | 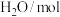 | 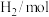 |  转化率 转化率 | 时间/min | |
| 650 | 4 | 2 | 1.6 | 6 | |
| 900 | 3 | 2 |  | 3 | |
②900℃时,从开始到达平衡时的反应速率
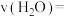
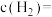
(3)利用废弃的
 的热分解可生产
的热分解可生产 :2H2S(g)
:2H2S(g)  2H2(g)+ S2(g)。现将0.20
2H2(g)+ S2(g)。现将0.20
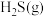 通入某恒压(压强
通入某恒压(压强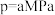 )密闭容器中,在不同温度下测得
)密闭容器中,在不同温度下测得 的平衡转化率如图所示。
的平衡转化率如图所示。
已知:对于气相反应,用某组分
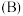 的平衡压强
的平衡压强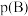 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数。温度为T 6℃时,该反应的平衡常数
也可表示平衡常数。温度为T 6℃时,该反应的平衡常数
您最近一年使用:0次
解题方法
4 .  、
、 是大气污染物,
是大气污染物, 在空气中易转化成
在空气中易转化成 。化学方程式为
。化学方程式为

(I) 和
和 反应历程有两步,如图1所示。
反应历程有两步,如图1所示。
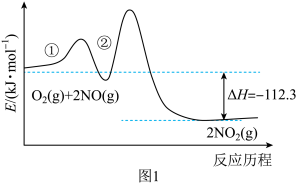
①

②

(1)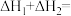
_______  。
。
(2)化学反应速率较大的基元反应是_______ (填“①”或“②”)。
(3)在密闭容器中投入 和
和 发生上述反应,达到平衡后,仅改变下列一个条件,
发生上述反应,达到平衡后,仅改变下列一个条件, 的平衡转化率和反应速率都增大的是_______(填字母)。
的平衡转化率和反应速率都增大的是_______(填字母)。
(II)在体积相同的甲、乙密闭容器中都充入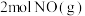 和
和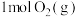 ,分别在“恒温恒容”和“绝热恒容”条件下发生上述反应,测得混合气体总压强与时间变化关系如图2所示。
,分别在“恒温恒容”和“绝热恒容”条件下发生上述反应,测得混合气体总压强与时间变化关系如图2所示。
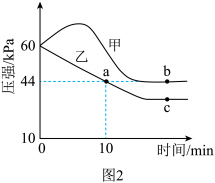
(4)在绝热恒容条件下达到平衡的容器是_______ (填“甲”或“乙”)。
(5)下列情况表明达到c点的反应状态的是_______。
(6)比较反应速率:b_______ c(填“>”“<”或“=”,下同)。比较 :a
:a_______ b。a点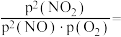
_______  。
。
(7)乙容器中, 内
内 平均分压变化率为
平均分压变化率为_______ 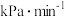 。
。
 、
、 是大气污染物,
是大气污染物, 在空气中易转化成
在空气中易转化成 。化学方程式为
。化学方程式为

(I)
 和
和 反应历程有两步,如图1所示。
反应历程有两步,如图1所示。
①


②


(1)
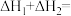
 。
。(2)化学反应速率较大的基元反应是
(3)在密闭容器中投入
 和
和 发生上述反应,达到平衡后,仅改变下列一个条件,
发生上述反应,达到平衡后,仅改变下列一个条件, 的平衡转化率和反应速率都增大的是_______(填字母)。
的平衡转化率和反应速率都增大的是_______(填字母)。| A.加入催化剂 | B.增大压强 | C.增大 浓度 浓度 | D.升高温度 |
(II)在体积相同的甲、乙密闭容器中都充入
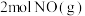 和
和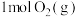 ,分别在“恒温恒容”和“绝热恒容”条件下发生上述反应,测得混合气体总压强与时间变化关系如图2所示。
,分别在“恒温恒容”和“绝热恒容”条件下发生上述反应,测得混合气体总压强与时间变化关系如图2所示。
(4)在绝热恒容条件下达到平衡的容器是
(5)下列情况表明达到c点的反应状态的是_______。
| A.混合气体密度不再变化 | B.气体总压强不再变化 |
| C.气体平均摩尔质量不再变化 | D. 消耗速率等于 消耗速率等于 生成速率 生成速率 |
 :a
:a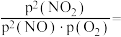
 。
。(7)乙容器中,
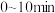 内
内 平均分压变化率为
平均分压变化率为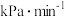 。
。
您最近一年使用:0次
5 . 我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。甲烷重整是提高甲烷利用率的重要方式。
回答下列问题:
(1)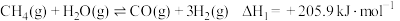 ①
①
 ②
②
写出 与
与 反应生成CO和
反应生成CO和 的热化学方程式:
的热化学方程式:_______ 。
(2)高温下,在1L密闭容器中通入1mol甲烷,发生如下反应: 。反应在初期阶段的速率方程为
。反应在初期阶段的速率方程为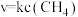 ,其中
,其中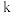 为反应速率常数。
为反应速率常数。
①设反应开始时的反应速率为 ,甲烷的转化率为
,甲烷的转化率为 时的反应速率为
时的反应速率为 ,则
,则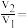
_______ 。
②对于处于初期阶段的该反应,下列说法正确的是_______ (填字母)。
A.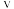 与甲烷浓度成正比
与甲烷浓度成正比
B.压强不变时,反应到达平衡状态
C.乙烷的生成速率逐渐增大
D.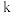 与温度无关
与温度无关
③平衡时,再通入1 mol甲烷,则反应的平衡常数K_______ (填“增大”“减小”或“不变”,下同),甲烷的转化率
_______ 。
(3) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
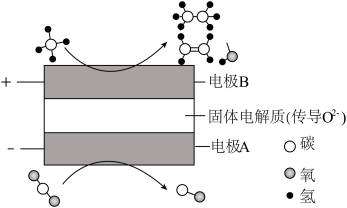
当在某电极上生成的两种有机物物质的量之比为1:1时,该电极上的电极反应式为_______ 。 和
和 的物质的量比为
的物质的量比为_______ 。
(4)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步: 催化裂解生成
催化裂解生成 和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如
和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如 ;第二步:碳(或碳氢物种)和
;第二步:碳(或碳氢物种)和 反应生成
反应生成 和
和 ,如
,如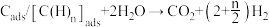 ,反应过程和能量变化残图如下:
,反应过程和能量变化残图如下:
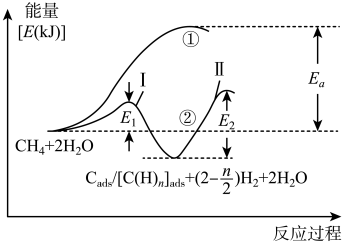
判断_______ (填序号)过程加入催化剂,原因是_______ 。控制整个过程②反应速率的是第Ⅱ步,其原因为_______ 。
回答下列问题:
(1)
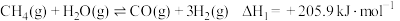 ①
① ②
②写出
 与
与 反应生成CO和
反应生成CO和 的热化学方程式:
的热化学方程式:(2)高温下,在1L密闭容器中通入1mol甲烷,发生如下反应:
 。反应在初期阶段的速率方程为
。反应在初期阶段的速率方程为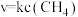 ,其中
,其中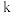 为反应速率常数。
为反应速率常数。①设反应开始时的反应速率为
 ,甲烷的转化率为
,甲烷的转化率为 时的反应速率为
时的反应速率为 ,则
,则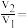
②对于处于初期阶段的该反应,下列说法正确的是
A.
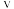 与甲烷浓度成正比
与甲烷浓度成正比B.压强不变时,反应到达平衡状态
C.乙烷的生成速率逐渐增大
D.
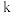 与温度无关
与温度无关③平衡时,再通入1 mol甲烷,则反应的平衡常数K

(3)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
当在某电极上生成的两种有机物物质的量之比为1:1时,该电极上的电极反应式为
 和
和 的物质的量比为
的物质的量比为(4)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:
 催化裂解生成
催化裂解生成 和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如
和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如 ;第二步:碳(或碳氢物种)和
;第二步:碳(或碳氢物种)和 反应生成
反应生成 和
和 ,如
,如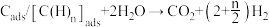 ,反应过程和能量变化残图如下:
,反应过程和能量变化残图如下:
判断
您最近一年使用:0次
2022-12-20更新
|
358次组卷
|
2卷引用:湖北省蕲春县实验高级中学2022届高三第一次模拟训练化学试题
解题方法
6 . 氮的氧化物、硫的氧化物是主要的大气污染物,对这些有害气体的治理及合理利用显得尤为重要。回答下列问题:
I.某MOFs多孔材料孔径大小和形状恰好将N2O4 “固定”,能高效选择性吸附NO2。
废气中的NO2被吸附后,将材料泡入水中并通入氧气能全部转化为HNO3。原理示意图如下:
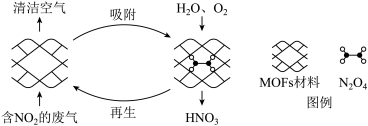
已知: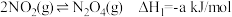

(1)请从温度和压强两个角度分析利于NO2吸附的条件_______ 。
(2)①当10 g材料吸附NO2到质量不再发生变化时,下列_______ 也能说明吸附反应已达到极限。
A.颜色不再发生变化 B.n(NO2):n(N2O4)=2:1
C.2v正(NO2)=v逆(N2O4) D.混合气体的平均分子质量不再发生变化
②当吸附反应达到极限时,测得材料内温度为40℃,压强为10.0 MPa,混合气体平均相对分子质量为69,吸附反应的Kp=_______ 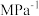 。
。
(3)由N2O4转化生成HNO3的热化学反应方程式_______ 。
Ⅱ.ClO2可对烟气中NO、SO2进行协同脱除。
(4)利用 ClO2气体脱硫脱硝的过程中涉及的部分反应及速率常数如下:
a.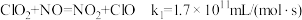
b.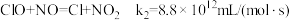
c.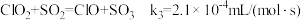
d.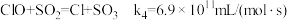
①反应d的历程如下图所示。该历程中最大活化能E正=_______ kJ/mol。
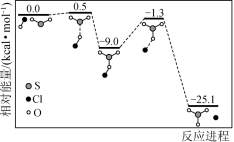
②保持其他条件不变,随着 的增加,SO2脱除效率的逐渐增加的原因是
的增加,SO2脱除效率的逐渐增加的原因是_______ 。
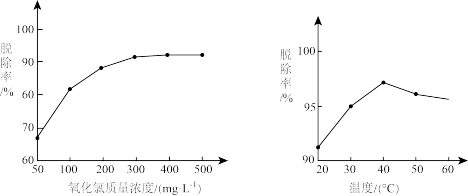
(5)利用 ClO2溶液脱硫脱硝的过程中,ClO2质量浓度和溶液温度对NO脱除率的影响如下图所示,则最佳的质量浓度和溶液温度是_______ 。
I.某MOFs多孔材料孔径大小和形状恰好将N2O4 “固定”,能高效选择性吸附NO2。
废气中的NO2被吸附后,将材料泡入水中并通入氧气能全部转化为HNO3。原理示意图如下:

已知:

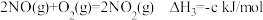
(1)请从温度和压强两个角度分析利于NO2吸附的条件
(2)①当10 g材料吸附NO2到质量不再发生变化时,下列
A.颜色不再发生变化 B.n(NO2):n(N2O4)=2:1
C.2v正(NO2)=v逆(N2O4) D.混合气体的平均分子质量不再发生变化
②当吸附反应达到极限时,测得材料内温度为40℃,压强为10.0 MPa,混合气体平均相对分子质量为69,吸附反应的Kp=
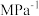 。
。(3)由N2O4转化生成HNO3的热化学反应方程式
Ⅱ.ClO2可对烟气中NO、SO2进行协同脱除。
(4)利用 ClO2气体脱硫脱硝的过程中涉及的部分反应及速率常数如下:
a.
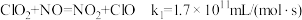
b.
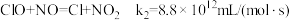
c.
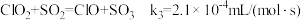
d.
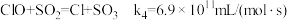
①反应d的历程如下图所示。该历程中最大活化能E正=

②保持其他条件不变,随着
 的增加,SO2脱除效率的逐渐增加的原因是
的增加,SO2脱除效率的逐渐增加的原因是(5)利用 ClO2溶液脱硫脱硝的过程中,ClO2质量浓度和溶液温度对NO脱除率的影响如下图所示,则最佳的质量浓度和溶液温度是

您最近一年使用:0次
2022-12-14更新
|
148次组卷
|
2卷引用:湖北省部分学校2022-2023学年高三上学期12月联考化学试题
7 . 回答下列问题
(1)二甲醚又称甲醚,简称DME,结构简式为CH3OCH3,是一种无色气体,被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,在医药、燃料、农药工业中有许多独特的用途。
CO(g)+2H2(g)=CH3OH(g) ΔH1=−90.1kJ⋅mol−1
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=−49.0kJ⋅mol−1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=−41.1kJ⋅mol−1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=−24.5kJ⋅mol−1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为_______ ;
(2)二甲醚还可作燃料电池的燃料,以H2SO4作为电解质,一极充入二甲醚,另一极充入空气和CO2气体。
①该电池的负极反应式为_______ 。
②如图,若b极通入二甲醚,则电解池的阳极反应式为_______ ;若a极通入二甲醚,电解池的反应式为_______ ,当有1mol的二甲醚参与反应时,电解池阳极附近生成的气体的体积(标准状况下)为_______ 。
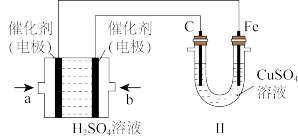
③用该二甲醚燃料电池电解300mL饱和食盐水。电解一段时间后,当溶液pH值为13(室温下测定)时,消耗二甲醚的物质量为_______ 。(忽略溶液体积变化,不考虑损耗)
(1)二甲醚又称甲醚,简称DME,结构简式为CH3OCH3,是一种无色气体,被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,在医药、燃料、农药工业中有许多独特的用途。
CO(g)+2H2(g)=CH3OH(g) ΔH1=−90.1kJ⋅mol−1
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=−49.0kJ⋅mol−1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=−41.1kJ⋅mol−1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=−24.5kJ⋅mol−1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为
(2)二甲醚还可作燃料电池的燃料,以H2SO4作为电解质,一极充入二甲醚,另一极充入空气和CO2气体。
①该电池的负极反应式为
②如图,若b极通入二甲醚,则电解池的阳极反应式为
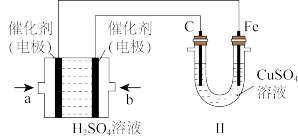
③用该二甲醚燃料电池电解300mL饱和食盐水。电解一段时间后,当溶液pH值为13(室温下测定)时,消耗二甲醚的物质量为
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.在火箭推进器中装有强还原剂肼( )和强氧化剂(
)和强氧化剂( ),当它们混合时,即产生大量的
),当它们混合时,即产生大量的 和水蒸气,并放出大量热。已知
和水蒸气,并放出大量热。已知 液态肼和足量
液态肼和足量 反应,生成氮气和水蒸气,放出
反应,生成氮气和水蒸气,放出 的热量。
的热量。
(1)写出该反应的热化学方程式___________ 。
(2)已知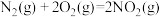 ;
;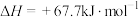 ,
,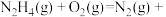
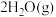 ;
;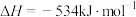 ,根据盖斯定律写出肼与
,根据盖斯定律写出肼与 完全反应生成氮气和气态水的热化学方程式
完全反应生成氮气和气态水的热化学方程式___________ 。
(3)已知:
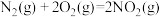
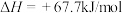 ,
,

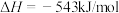 ,
,
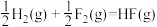
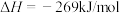 ,
,
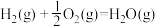
 ,
,
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:___________ 。
Ⅱ.已知100℃时水的离子积 是
是 ,回答下列问题:
,回答下列问题:
(4)常温下,在 的
的 溶液中加入等体积的
溶液中加入等体积的 的稀盐酸后,溶液呈中性。则
的稀盐酸后,溶液呈中性。则 的
的
___________ 。
(5)难溶电解质在水溶液中存在着电离平衡。在常温下,溶液中各离子浓度以它们的系数为次方的乘积是一个常数,这个常数叫溶度积( )如
)如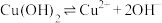 ,
,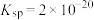 溶液里各离子浓度(包括其次方)的乘积大于溶度积时则出现沉淀;反之则沉淀溶解。
溶液里各离子浓度(包括其次方)的乘积大于溶度积时则出现沉淀;反之则沉淀溶解。
①某 溶液里,
溶液里,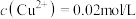 ,如果要生成
,如果要生成 沉淀,应调整溶液的pH,使之大于
沉淀,应调整溶液的pH,使之大于___________ 。
②要使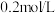
 溶液中的
溶液中的 沉淀较为完全(使
沉淀较为完全(使 溶液降低至原来的千分之一),则应向溶液中加入
溶液降低至原来的千分之一),则应向溶液中加入 溶液,使溶液pH为
溶液,使溶液pH为___________ 。
(6)25℃在等体积的① 的
的 溶液,②
溶液,② 的
的 溶液,,③
溶液,,③ 的
的 溶液,④
溶液,④ 的
的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是___________
(7)在100℃时,向
 的盐酸中滴加
的盐酸中滴加 的
的 溶液
溶液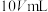 ,所得混合溶液中
,所得混合溶液中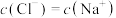 ,则此时
,则此时 的值为
的值为___________ 。
 )和强氧化剂(
)和强氧化剂( ),当它们混合时,即产生大量的
),当它们混合时,即产生大量的 和水蒸气,并放出大量热。已知
和水蒸气,并放出大量热。已知 液态肼和足量
液态肼和足量 反应,生成氮气和水蒸气,放出
反应,生成氮气和水蒸气,放出 的热量。
的热量。(1)写出该反应的热化学方程式
(2)已知
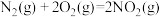 ;
;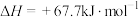 ,
,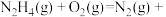
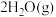 ;
;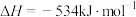 ,根据盖斯定律写出肼与
,根据盖斯定律写出肼与 完全反应生成氮气和气态水的热化学方程式
完全反应生成氮气和气态水的热化学方程式(3)已知:
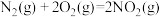
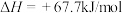 ,
,
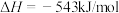 ,
,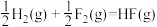
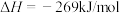 ,
,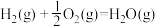
 ,
,有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:
Ⅱ.已知100℃时水的离子积
 是
是 ,回答下列问题:
,回答下列问题:(4)常温下,在
 的
的 溶液中加入等体积的
溶液中加入等体积的 的稀盐酸后,溶液呈中性。则
的稀盐酸后,溶液呈中性。则 的
的
(5)难溶电解质在水溶液中存在着电离平衡。在常温下,溶液中各离子浓度以它们的系数为次方的乘积是一个常数,这个常数叫溶度积(
 )如
)如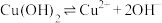 ,
,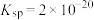 溶液里各离子浓度(包括其次方)的乘积大于溶度积时则出现沉淀;反之则沉淀溶解。
溶液里各离子浓度(包括其次方)的乘积大于溶度积时则出现沉淀;反之则沉淀溶解。①某
 溶液里,
溶液里,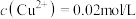 ,如果要生成
,如果要生成 沉淀,应调整溶液的pH,使之大于
沉淀,应调整溶液的pH,使之大于②要使
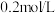
 溶液中的
溶液中的 沉淀较为完全(使
沉淀较为完全(使 溶液降低至原来的千分之一),则应向溶液中加入
溶液降低至原来的千分之一),则应向溶液中加入 溶液,使溶液pH为
溶液,使溶液pH为(6)25℃在等体积的①
 的
的 溶液,②
溶液,② 的
的 溶液,,③
溶液,,③ 的
的 溶液,④
溶液,④ 的
的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是(7)在100℃时,向

 的盐酸中滴加
的盐酸中滴加 的
的 溶液
溶液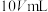 ,所得混合溶液中
,所得混合溶液中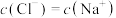 ,则此时
,则此时 的值为
的值为
您最近一年使用:0次
解题方法
9 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是_______(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
计算可得:2HCl(g)=H2(g)+Cl2(g) △H=_______ kJ/mol
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.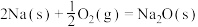
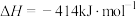
II.
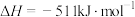
写出Na2O2与Na反应生成Na2O的热化学方程式:_______ 。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
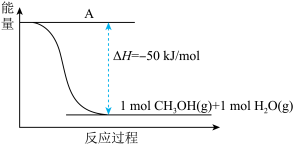
①补全上图:图中A处应填入_______ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H_______ (填“变大”“变小”或“不变”)。
③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。
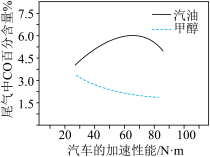
据图信息分析,与汽油相比,甲醇作为燃料的优点是_______ 。
(1)下列反应中,属于吸热反应的是_______(填字母)。
| A.NaHCO3与盐酸反应 | B.甲烷的燃烧反应 |
| C.Ba(OH)2·8H2O与氯化铵反应 | D.锌与盐酸反应 |
①通过化学键的键能计算。已知:
| 化学键种类 | H-H | Cl-Cl | H-Cl |
| 键能(kJ/mol) | 436 | 247 | 434 |
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.
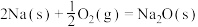
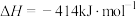
II.

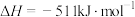
写出Na2O2与Na反应生成Na2O的热化学方程式:
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

①补全上图:图中A处应填入
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H
③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

据图信息分析,与汽油相比,甲醇作为燃料的优点是
您最近一年使用:0次
2022-11-29更新
|
113次组卷
|
2卷引用:湖北省武汉市问津联合体2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
10 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与储存,过程如下:
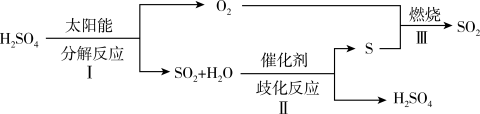
(1)反应I由两步反应完成:a. H2SO4(l) SO3(g)+H2O(g) △H1 = +177 kJ/mol
SO3(g)+H2O(g) △H1 = +177 kJ/mol
b. 2SO3(g) 2SO2(g) +O2(g) △H2 = +197 kJ/mol
2SO2(g) +O2(g) △H2 = +197 kJ/mol
①请写出反应I的热化学反应方程式:_________________________________ 。
②硫酸工业中可通过反应b的逆反应合成SO3,下表列出了不同温度、压强下SO2的平衡转化率:
在实际生产中,选定温度为400~500 ℃的原因是_________________ ;选定压强为常压的原因是_____________________ 。
(2) 可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:
可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:
i.SO2+4I-+4H+= S↓+2I2+2H2O ii.
某实验小组为探究i、ii反应速率与SO2歧化反应速率的关系,进行如下实验:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①请补全反应ii:___________________________________ 。
②比较A、B、C,可得出的结论是:______________________ 。
③D是A的对比实验,则a=__________ 。
④实验表明,SO2的歧化反应速率D>A,则反应速率:i____ ii(填“>”、“=”或“<”)。

(1)反应I由两步反应完成:a. H2SO4(l)
 SO3(g)+H2O(g) △H1 = +177 kJ/mol
SO3(g)+H2O(g) △H1 = +177 kJ/molb. 2SO3(g)
 2SO2(g) +O2(g) △H2 = +197 kJ/mol
2SO2(g) +O2(g) △H2 = +197 kJ/mol①请写出反应I的热化学反应方程式:
②硫酸工业中可通过反应b的逆反应合成SO3,下表列出了不同温度、压强下SO2的平衡转化率:
温度/℃ | SO2的平衡转化率/% | ||||
0.1 MPa | 0.5 MPa | 1 MPa | 5 MPa | 10 MPa | |
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
在实际生产中,选定温度为400~500 ℃的原因是
(2)
 可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:
可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:i.SO2+4I-+4H+= S↓+2I2+2H2O ii.
某实验小组为探究i、ii反应速率与SO2歧化反应速率的关系,进行如下实验:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
A | B | C | D | |
试剂组成 | 0.4 mol/L KI | 0.4 mol/L KI 0.2 mol/L H2SO4 | 0.2 mol/L H2SO4 | 0.2 mol/L KI a mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色成黄色,出现浑浊较A快 |
①请补全反应ii:
②比较A、B、C,可得出的结论是:
③D是A的对比实验,则a=
④实验表明,SO2的歧化反应速率D>A,则反应速率:i
您最近一年使用:0次



