1 . 合成氨的反应对人类解决粮食问题贡献巨大,德国化学家F.Haber因合成氨而获得诺贝尔奖。合成氨反应热化学方程式如下:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
(1)已知N2(g)+3H2(g) 2NH3(g)不加入催化剂时正反应的活化能为326kJ/mol,则该反应逆反应的活化能为
2NH3(g)不加入催化剂时正反应的活化能为326kJ/mol,则该反应逆反应的活化能为_______ kJ/mol。
(2)已知N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
H2的燃烧热△H=-285.8kJ/mol
则NH3(g)+ O2(g)=NO(g)+
O2(g)=NO(g)+ H2O(l) △H=
H2O(l) △H=_______ kJ/mol。
(3)一定温度下,向恒容的密闭容器中充入一定量的N2和H2发生反应,测得各组分浓度随时间变化如图所示。
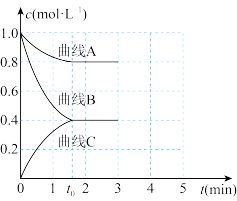
①表示c(H2)变化的曲线是_______ (填“曲线A”“曲线B”或“曲线C”)。
②0~t0时用NH3表示的化学反应速率为v(NH3)=_______ mol·L-1·min-1。
③下列能说明该反应达到平衡状态的是_______ (填标号)。
A.容器中混合气体的密度不随时间变化
B.容器中的n(N2)与n(H2)的比值不随时间变化
C.断裂3molH-H的同时断裂6molN-H键
D.3v正(H2)=2v逆(NH3)
(4)合成氨反应在某催化剂条件下的相对能量-反应历程如图所示(ad为吸附态):
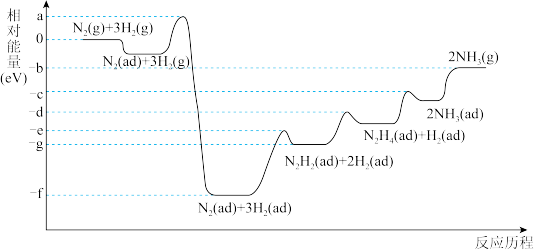
①该过程中含氮的中间产物有_______ 种(填数字)。
②活化能最大的那一步基元反应方程式为_______ 。
③下列说法正确的是_______ (填标号)。
A.最后一步NH3(ad)变为NH3(g)为吸热过程。
B.催化剂参与反应,但不改变合成氨反应的△H
C.催化剂和升温都能降低反应的活化能,加快合成氨的反应速率
D.使用催化剂和压缩容器体积加压都能增大活化分子百分数,加快合成氨反应速率
 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol(1)已知N2(g)+3H2(g)
 2NH3(g)不加入催化剂时正反应的活化能为326kJ/mol,则该反应逆反应的活化能为
2NH3(g)不加入催化剂时正反应的活化能为326kJ/mol,则该反应逆反应的活化能为(2)已知N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
H2的燃烧热△H=-285.8kJ/mol
则NH3(g)+
 O2(g)=NO(g)+
O2(g)=NO(g)+ H2O(l) △H=
H2O(l) △H=(3)一定温度下,向恒容的密闭容器中充入一定量的N2和H2发生反应,测得各组分浓度随时间变化如图所示。

①表示c(H2)变化的曲线是
②0~t0时用NH3表示的化学反应速率为v(NH3)=
③下列能说明该反应达到平衡状态的是
A.容器中混合气体的密度不随时间变化
B.容器中的n(N2)与n(H2)的比值不随时间变化
C.断裂3molH-H的同时断裂6molN-H键
D.3v正(H2)=2v逆(NH3)
(4)合成氨反应在某催化剂条件下的相对能量-反应历程如图所示(ad为吸附态):

①该过程中含氮的中间产物有
②活化能最大的那一步基元反应方程式为
③下列说法正确的是
A.最后一步NH3(ad)变为NH3(g)为吸热过程。
B.催化剂参与反应,但不改变合成氨反应的△H
C.催化剂和升温都能降低反应的活化能,加快合成氨的反应速率
D.使用催化剂和压缩容器体积加压都能增大活化分子百分数,加快合成氨反应速率
您最近一年使用:0次
解题方法
2 . N2O是《联合国气候变化框架公约》所列六种温室气体之一。目前,直接催化分解法是消除N2O的主要方法,该过程中发生的反应如下:
i.2N2O(g) 2N2(g)+O2(g) △H1
2N2(g)+O2(g) △H1
ii.2N2O(g) N2(g)+2NO(g) △H2
N2(g)+2NO(g) △H2
iii.4N2O(g) 3N2(g)+2NO2(g) △H3
3N2(g)+2NO2(g) △H3
回答下列问题:
(1)根据盖斯定律,反应2NO(g)+O2(g) 2NO2(g)的△H=
2NO2(g)的△H=_______ (写出代数式即可)。
(2)已知反应i在任意温度下均能自发进行,则反应i为_______ (填“吸热”或“放热”)反应。
(3)反应i的势能曲线示意图如图(…表示吸附作用,A表示催化剂,TS表示过渡态分子):
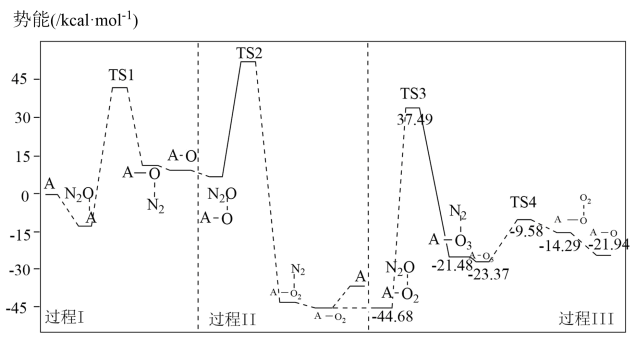
①过程III中最大势能垒(活化能)为_______ kcal·mol-1。
②下列有关反应i的说法不正确的是_______ (填标号)。
A.过程I中有极性键断裂
B.过程I、II、III中都有N2生成
C.该反应中只有两种物质能够吸附N2O分子
D.过程II中间体A-O2可释放O2也可吸附N2O分子
(4)模拟废气中N2O直接催化分解过程。
①515℃时,将模拟废气(N2O体积分数为40%)以6000m3·h-1的速度通过催化剂,测得N2O的转化率为40%,则平均反应速率v(N2O)为_______ m3·h-1。欲提高N2O的转化率,可采取的措施为_______ (任写一条)。
②T℃和P0kPa时,在恒压密闭容器中进行模拟实验。各组分的相关信息如表:
其中x=_______ ;该温度下,反应2N2O(g)  2N2(g)+O2(g)的压强平衡常数Kp=
2N2(g)+O2(g)的压强平衡常数Kp=_______ kPa(以分压表示,分压=总压×物质的量分数)。
i.2N2O(g)
 2N2(g)+O2(g) △H1
2N2(g)+O2(g) △H1ii.2N2O(g)
 N2(g)+2NO(g) △H2
N2(g)+2NO(g) △H2iii.4N2O(g)
 3N2(g)+2NO2(g) △H3
3N2(g)+2NO2(g) △H3回答下列问题:
(1)根据盖斯定律,反应2NO(g)+O2(g)
 2NO2(g)的△H=
2NO2(g)的△H=(2)已知反应i在任意温度下均能自发进行,则反应i为
(3)反应i的势能曲线示意图如图(…表示吸附作用,A表示催化剂,TS表示过渡态分子):

①过程III中最大势能垒(活化能)为
②下列有关反应i的说法不正确的是
A.过程I中有极性键断裂
B.过程I、II、III中都有N2生成
C.该反应中只有两种物质能够吸附N2O分子
D.过程II中间体A-O2可释放O2也可吸附N2O分子
(4)模拟废气中N2O直接催化分解过程。
①515℃时,将模拟废气(N2O体积分数为40%)以6000m3·h-1的速度通过催化剂,测得N2O的转化率为40%,则平均反应速率v(N2O)为
②T℃和P0kPa时,在恒压密闭容器中进行模拟实验。各组分的相关信息如表:
| 物质 | N2 | N2O | O2 | CO2 | NO | NO2 |
| n(投料)/mol | 19 | 34 | 6.5 | 25 | 0 | 0 |
| n(平衡)/mol | 50 | x | 20 | 25 | 2 | 2 |
 2N2(g)+O2(g)的压强平衡常数Kp=
2N2(g)+O2(g)的压强平衡常数Kp=
您最近一年使用:0次
名校
解题方法
3 . 氮的氧化物是大气污染物之一、研究它们的反应机理,对于消除环境污染,促进社会可持续发展有重要意义。回答下列问题:
(1)已知:①
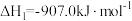 ;
;
②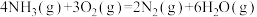
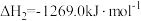 。
。
若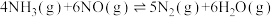 的逆反应活化能为
的逆反应活化能为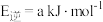 ,则其正反应活化能为
,则其正反应活化能为_______  (用含a的代数式表示)。
(用含a的代数式表示)。
(2)氢气选择性催化还原NO是一种比 还原NO更为理想的方法,备受研究者关注。以Pt-HY为催化剂,氢气选择性催化还原NO在催化剂表面的反应机理如图:
还原NO更为理想的方法,备受研究者关注。以Pt-HY为催化剂,氢气选择性催化还原NO在催化剂表面的反应机理如图:
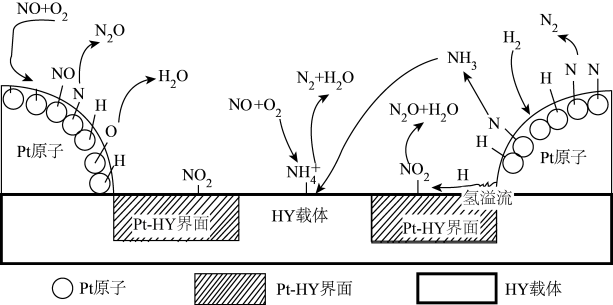
①Pt原子表面上发生的反应除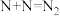 、
、 外还有
外还有_______ 。
②已知在HY载体表面发生反应的NO、 的物质的量之比为1:1,补充并配平下列离子方程式:
的物质的量之比为1:1,补充并配平下列离子方程式:
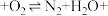 _______。
_______。_______
(3)在密闭容器中充入4mol NO和5mol ,发生反应:
,发生反应: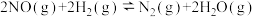
 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。
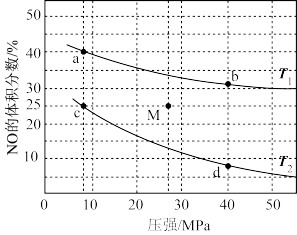
①下列物理量中,图中d点大于b点的是_______ (填字母)。
A.正反应速率 B.逆反应速率 C. (g)的浓度 D.对应温度的平衡常数
(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为_______ 。
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点。_______
(4)T℃时,向容积为2L的恒容容器中充入0.4mol NO、0.8mol ,发生反应:
,发生反应: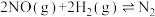
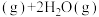 ,体系的总压强p随时间t的变化如下表所示:
,体系的总压强p随时间t的变化如下表所示:
①0~20min内该反应的平均反应速率
_______  。
。
②该温度下反应的平衡常数
_______  (用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
(用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
(1)已知:①

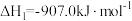 ;
;②
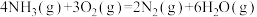
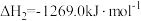 。
。若
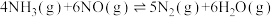 的逆反应活化能为
的逆反应活化能为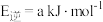 ,则其正反应活化能为
,则其正反应活化能为 (用含a的代数式表示)。
(用含a的代数式表示)。(2)氢气选择性催化还原NO是一种比
 还原NO更为理想的方法,备受研究者关注。以Pt-HY为催化剂,氢气选择性催化还原NO在催化剂表面的反应机理如图:
还原NO更为理想的方法,备受研究者关注。以Pt-HY为催化剂,氢气选择性催化还原NO在催化剂表面的反应机理如图:
①Pt原子表面上发生的反应除
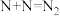 、
、 外还有
外还有②已知在HY载体表面发生反应的NO、
 的物质的量之比为1:1,补充并配平下列离子方程式:
的物质的量之比为1:1,补充并配平下列离子方程式:
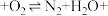 _______。
_______。(3)在密闭容器中充入4mol NO和5mol
 ,发生反应:
,发生反应: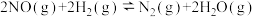
 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。
①下列物理量中,图中d点大于b点的是
A.正反应速率 B.逆反应速率 C.
 (g)的浓度 D.对应温度的平衡常数
(g)的浓度 D.对应温度的平衡常数②c点NO的平衡转化率为
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点。
(4)T℃时,向容积为2L的恒容容器中充入0.4mol NO、0.8mol
 ,发生反应:
,发生反应: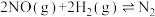
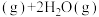 ,体系的总压强p随时间t的变化如下表所示:
,体系的总压强p随时间t的变化如下表所示:| t/min | 0 | 10 | 20 | 30 | 40 |
| p/kPa | 240 | 226 | 216 | 210 | 210 |

 。
。②该温度下反应的平衡常数

 (用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
(用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
您最近一年使用:0次
2022-04-16更新
|
732次组卷
|
4卷引用:湖北省九师联盟2022届高三 三模考试化学试题
湖北省九师联盟2022届高三 三模考试化学试题河北省名校联盟2021-2022学年高三下学期4月质量检测化学试题(已下线)考点23 化学平衡常数-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)T28-原理综合题
名校
4 . 清洁能源的综合利用可有效降低碳排放,是实现“碳中和、碳达峰”的重要途径。
(1)以环己烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。
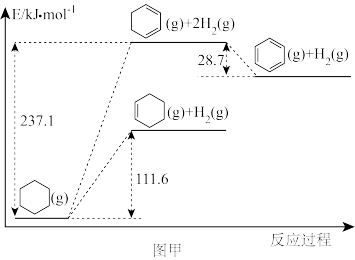
芳构化反应: (g)→
(g)→ (g)+3H2(g)
(g)+3H2(g) 
_______ kJ/mol。
(2) 和
和 合成乙醇反应为:
合成乙醇反应为: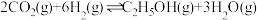 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的关系如图乙。
的体积分数随温度和压强的关系如图乙。
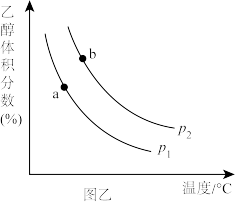
①压强P1_______ P2(填“>”“=”或“<”,下同),a、b两点的平衡常数Ka_______ Kb。
②已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
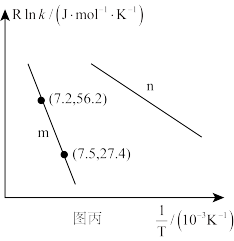
在m催化剂作用下,该反应的活化能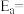
_______ J/mol。从图中信息获知催化效能较高的催化剂是_______ (填“m”或“n”),判断理由是_______ 。
(3) 和CO合成甲烷反应为:
和CO合成甲烷反应为: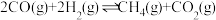 。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率
。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率 ,其中p为分压,该温度下
,其中p为分压,该温度下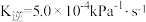 。反应达平衡时测得v正=
。反应达平衡时测得v正=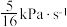 。CO的平衡转化率为
。CO的平衡转化率为_______ ,该温度下反应的Kp=_______ 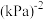 (用组分的分压计算的平衡常数)。
(用组分的分压计算的平衡常数)。
(1)以环己烷为原料通过芳构化反应生产苯,同时可获取氢气。图甲是该反应过程中几种物质间的能量关系。

芳构化反应:
 (g)→
(g)→ (g)+3H2(g)
(g)+3H2(g) 
(2)
 和
和 合成乙醇反应为:
合成乙醇反应为: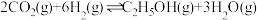 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的关系如图乙。
的体积分数随温度和压强的关系如图乙。
①压强P1
②已知Arrhenius经验公式为
 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能,进行了实验探究,依据实验数据获得图丙曲线。
在m催化剂作用下,该反应的活化能
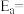
(3)
 和CO合成甲烷反应为:
和CO合成甲烷反应为: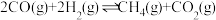 。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率
。T℃将等物质的量CO和H2充入恒压(200KPa)的密闭容器中。已知逆反应速率 ,其中p为分压,该温度下
,其中p为分压,该温度下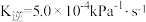 。反应达平衡时测得v正=
。反应达平衡时测得v正=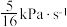 。CO的平衡转化率为
。CO的平衡转化率为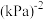 (用组分的分压计算的平衡常数)。
(用组分的分压计算的平衡常数)。
您最近一年使用:0次
2022-04-14更新
|
1515次组卷
|
10卷引用:化学-2022年高考考前押题密卷(湖北卷)
(已下线)化学-2022年高考考前押题密卷(湖北卷)山东省青岛市2021-2022学年高三下学期第一次模拟考试化学试题(已下线)化学-2022年高考押题预测卷02(辽宁卷)(已下线)押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)山东省泰安市2022届高三下学期三轮验收考试化学试题广东省珠海市实验中学、东莞市第六高级中学、河源高级中学、中山市实验中学2021-2022学年下学期高三第五次联考化学试题山西省晋中市平遥县第二中学校2021-2022学年高二下学期升级化学试题山东省滨州市2023届高三上学期期末综合测试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(原理综合题)湖南省醴陵市第一中学2023届高三下学期第七次月考化学试题
5 . 2020年已提出:我国将力争2030年前实现碳达峰、2060年前实现碳中和。研究 的转化和
的转化和 资源化利用对缓解碳减排压力和推进能源绿色转型,实现“碳达峰、碳中和”具有重要意义。
资源化利用对缓解碳减排压力和推进能源绿色转型,实现“碳达峰、碳中和”具有重要意义。
(1) 与
与 催化重整制合成气是研究热点之一。发生的主要反应有:
催化重整制合成气是研究热点之一。发生的主要反应有:
反应①: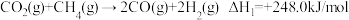
反应②: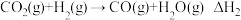
有关化学键键能数据如表:
则反应②的反应热
_______  。
。
(2)对于上述反应体系,下列说法错误的是_______ 。
A.增大 的浓度,反应①②的正反应速率均增加
的浓度,反应①②的正反应速率均增加
B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,可提高 的平衡转化率
的平衡转化率
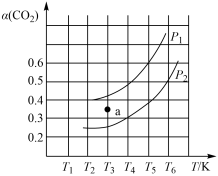
(3)在体积为 的刚性容器中进行“合成气催化重整”,反应的化学方程式为
的刚性容器中进行“合成气催化重整”,反应的化学方程式为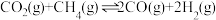 。当投料比,
。当投料比,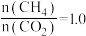 时,
时, 的平衡转化率(
的平衡转化率( )与温度(T)、初始压强(p)的关系如图所示。压强
)与温度(T)、初始压强(p)的关系如图所示。压强
_______ (填“>”“<”或“=”,下同) ;当温度为
;当温度为 、压强为
、压强为 时,a点时的v(正)
时,a点时的v(正)_______ v(逆);起始时向容器中加入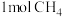 和
和 ,在温度为
,在温度为 、初始压强为
、初始压强为 时反应,该反应的
时反应,该反应的
_______ 。
(4)科学家利用电化学装置实现 和
和 两种分子的耦合转化来达到减碳的目的,其原理如图所示:
两种分子的耦合转化来达到减碳的目的,其原理如图所示:
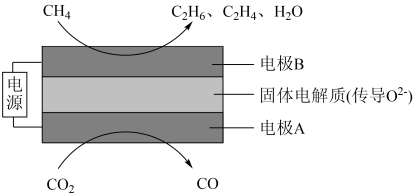
①电极A上的电极反应式为_______ 。
②若生成的乙烯和乙烷的物质的量比为1∶1,则消耗的 和
和 的物质的量之比为
的物质的量之比为_______ 。
 的转化和
的转化和 资源化利用对缓解碳减排压力和推进能源绿色转型,实现“碳达峰、碳中和”具有重要意义。
资源化利用对缓解碳减排压力和推进能源绿色转型,实现“碳达峰、碳中和”具有重要意义。(1)
 与
与 催化重整制合成气是研究热点之一。发生的主要反应有:
催化重整制合成气是研究热点之一。发生的主要反应有:反应①:
反应②:
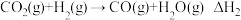
有关化学键键能数据如表:
| 化学键 |  |  |  |  |
键能/ | 436 | 463 | 803 | 1076 |

 。
。(2)对于上述反应体系,下列说法错误的是
A.增大
 的浓度,反应①②的正反应速率均增加
的浓度,反应①②的正反应速率均增加B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,可提高
 的平衡转化率
的平衡转化率(3)在体积为
 的刚性容器中进行“合成气催化重整”,反应的化学方程式为
的刚性容器中进行“合成气催化重整”,反应的化学方程式为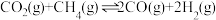 。当投料比,
。当投料比,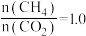 时,
时, 的平衡转化率(
的平衡转化率( )与温度(T)、初始压强(p)的关系如图所示。压强
)与温度(T)、初始压强(p)的关系如图所示。压强
 ;当温度为
;当温度为 、压强为
、压强为 时,a点时的v(正)
时,a点时的v(正)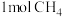 和
和 ,在温度为
,在温度为 、初始压强为
、初始压强为 时反应,该反应的
时反应,该反应的

(4)科学家利用电化学装置实现
 和
和 两种分子的耦合转化来达到减碳的目的,其原理如图所示:
两种分子的耦合转化来达到减碳的目的,其原理如图所示:
①电极A上的电极反应式为
②若生成的乙烯和乙烷的物质的量比为1∶1,则消耗的
 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
解题方法
6 . 回答下列问题:
(1)已知稀溶液中,1mol H2SO4与2mol NaOH恰好完全反应时,放出114.6kJ热量,写出该反应表示中和热的热化学方程式:_______ 。
(2)利用甲烷的还原性,可以对大气中的氮氧化合物进行处理。已知一定条件下:
①4NO(g)=2NO2(g)+N2(g) ∆H1= -293kJ·mol-l
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ∆H2= -1160kJ·mol-1
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ∆H=_______ kJ·mol-1,该反应能在_______ 下自发进行。(选填“低温”、“高温”或“任何温度”)
(3)①恒温恒容的密闭容器中,发生反应CO (g) +H2S (g) COS (g) +H2 (g), 若反应前只充10mol CO和x mol H2S,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1,则x=
COS (g) +H2 (g), 若反应前只充10mol CO和x mol H2S,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1,则x=_______ mol。
②恒温恒容时,能表明Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)达平衡状态的是
2Fe(s)+3CO2(g)达平衡状态的是_______ ( 填字母)。
A.单位时间内生成n mol CO同时消耗n mol CO2
B. c(CO)不随时间改变
C. CO2的体积分数不变
D. Fe 的浓度不变
(4)某种新工艺装置是氯碱工业装置和另一种电化学装置组合而成,相关物料的传输与转化关系如图所示,其中电极未标出,所用的离子交换膜都只允许阳离子通过。
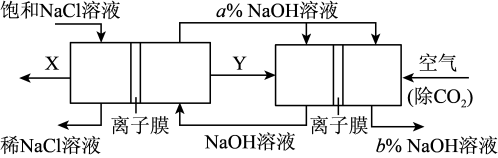
图中物质Y的电子式_______ , 图中b%_______ a%(填“<”或“>”或“=”),通入除去CO2的空气一极的电极反应式为_______ 。
(1)已知稀溶液中,1mol H2SO4与2mol NaOH恰好完全反应时,放出114.6kJ热量,写出该反应表示中和热的热化学方程式:
(2)利用甲烷的还原性,可以对大气中的氮氧化合物进行处理。已知一定条件下:
①4NO(g)=2NO2(g)+N2(g) ∆H1= -293kJ·mol-l
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ∆H2= -1160kJ·mol-1
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ∆H=
(3)①恒温恒容的密闭容器中,发生反应CO (g) +H2S (g)
 COS (g) +H2 (g), 若反应前只充10mol CO和x mol H2S,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1,则x=
COS (g) +H2 (g), 若反应前只充10mol CO和x mol H2S,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1,则x=②恒温恒容时,能表明Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)达平衡状态的是
2Fe(s)+3CO2(g)达平衡状态的是A.单位时间内生成n mol CO同时消耗n mol CO2
B. c(CO)不随时间改变
C. CO2的体积分数不变
D. Fe 的浓度不变
(4)某种新工艺装置是氯碱工业装置和另一种电化学装置组合而成,相关物料的传输与转化关系如图所示,其中电极未标出,所用的离子交换膜都只允许阳离子通过。

图中物质Y的电子式
您最近一年使用:0次
名校
7 . 有机反应往往具有可逆性,同时还伴随副反应发生。请回答下列问题:
Ⅰ.利用甲醇(CH3OH)在一定条件下直接脱氢可制甲醛(HCHO),反应方程式为:CH3OH(g) HCHO(g)+H2(g) △H>0。
HCHO(g)+H2(g) △H>0。
(1)已知CH3OH可以由CO和H2反应制备,制备过程中发生的反应有:
①CO(g)+2H2(g) CH3OH(g) △H=-90.7kJ/mol
CH3OH(g) △H=-90.7kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
则反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H=
CH3OCH3(g)+CO2(g)的△H=____ 。
(2)若在恒温恒容容器中进行上述制甲醛的反应,可判断反应达到平衡状态的是____ (填序号)。
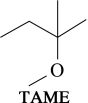
Ⅱ.2—甲氧基—2—甲基丁烷(TAME)常用作汽油添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如图反应:
反应Ⅰ: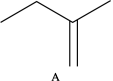 +CH3OH
+CH3OH
 △H1
△H1
反应Ⅱ: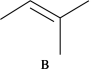 +CH3OH
+CH3OH
 △H2
△H2
反应Ⅲ: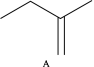

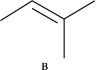 △H3
△H3
(3)反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。据图判断,A和B中相对稳定的是____ 。

(4)为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为a。已知反应Ⅲ的平衡常数Kx3=8,则平衡体系中B的物质的量为____ mol,反应I的平衡常数Kx1=____ 。
(5)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为____ (填“X”或“Y”);t=100s时,反应Ⅲ的V正____ V逆(填“>”“<”或“=”)。

Ⅰ.利用甲醇(CH3OH)在一定条件下直接脱氢可制甲醛(HCHO),反应方程式为:CH3OH(g)
 HCHO(g)+H2(g) △H>0。
HCHO(g)+H2(g) △H>0。(1)已知CH3OH可以由CO和H2反应制备,制备过程中发生的反应有:
①CO(g)+2H2(g)
 CH3OH(g) △H=-90.7kJ/mol
CH3OH(g) △H=-90.7kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol则反应3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g)的△H=
CH3OCH3(g)+CO2(g)的△H=(2)若在恒温恒容容器中进行上述制甲醛的反应,可判断反应达到平衡状态的是
| A.混合气体的密度不变 |
| B.CH3OH、HCHO的物质的量浓度之比为1:1 |
| C.H2的体积分数不再改变 |
| D.混合气体的平均相对分子质量不变 |
Ⅱ.2—甲氧基—2—甲基丁烷(TAME)常用作汽油添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如图反应:
反应Ⅰ:
 +CH3OH
+CH3OH
 △H1
△H1反应Ⅱ:
 +CH3OH
+CH3OH
 △H2
△H2反应Ⅲ:


 △H3
△H3(3)反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。据图判断,A和B中相对稳定的是

(4)为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为a。已知反应Ⅲ的平衡常数Kx3=8,则平衡体系中B的物质的量为
(5)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为

您最近一年使用:0次
8 . 我国提出争取在2030年前实现碳峰值、2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。将CO2 转化为清洁能源是促进碳中和最直接有效的方法。
(1)H2还原CO2制取CH4的部分反应如下:
①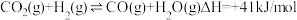
②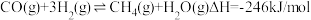
③
反应2C(s)+2H2O(g)=CH4(g)+CO2(g)的∆H=___________ kJ/mol。
(2)恒温条件下,向2L恒容密闭容器中充入1molCO和2molH2,只发生如下反应:CO(g)+3H2 (g)=CH4(g)+H2O(g),反应4min后,测得CO的物质的量为0.8mol,下列有关说法正确的是___________ (填字母。)
A. 利用合适的催化剂可增大该反应的平衡常数
B. 容器内气体的平均相对分子质量保持不变,说明该反应达到平衡状态
C. 用 H2表示该反应4min内的平均速率为0.075mol·L-1·s-1
D. 其它条件不变,升高温度,CO的平衡转化率降低
(3)在一定条件下,向某0.5L恒容密闭容器中充入xmolCO2和ymolH2,发生反应:
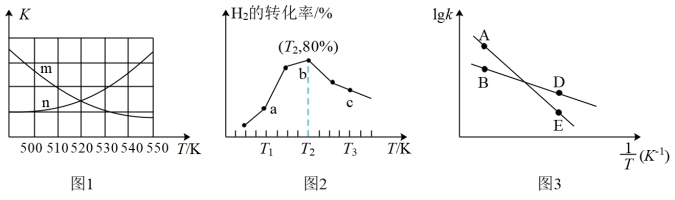
①图1中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线___________ (填“m” 或“n”),判断依据是___________ 。
②若x=2、y=3,测得在相同时间内,不同温度下H 2的转化率如图2所示,v(a) 逆___________ v(c) 逆(填“>”、<”或“=”);T2时,起始压强为2.5MPa,则Kp=___________ MPa-2(保留二位小数;K p为以分压表示的平衡常数,分压=总压×物质的量分数)。
③已知速率方程 v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响。图3表示速率常数的对数lgk与温度的倒数 之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是
之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是___________ (填“A”、“B”、“D”或“E”)。
(1)H2还原CO2制取CH4的部分反应如下:
①
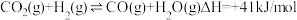
②
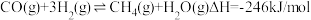
③

反应2C(s)+2H2O(g)=CH4(g)+CO2(g)的∆H=
(2)恒温条件下,向2L恒容密闭容器中充入1molCO和2molH2,只发生如下反应:CO(g)+3H2 (g)=CH4(g)+H2O(g),反应4min后,测得CO的物质的量为0.8mol,下列有关说法正确的是
A. 利用合适的催化剂可增大该反应的平衡常数
B. 容器内气体的平均相对分子质量保持不变,说明该反应达到平衡状态
C. 用 H2表示该反应4min内的平均速率为0.075mol·L-1·s-1
D. 其它条件不变,升高温度,CO的平衡转化率降低
(3)在一定条件下,向某0.5L恒容密闭容器中充入xmolCO2和ymolH2,发生反应:


①图1中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线
②若x=2、y=3,测得在相同时间内,不同温度下H 2的转化率如图2所示,v(a) 逆
③已知速率方程 v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响。图3表示速率常数的对数lgk与温度的倒数
 之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是
之间的关系,A、B、D、E分别代表图2中a点、c点的lgk,其中表示c点的lgk逆的是
您最近一年使用:0次
2022-04-09更新
|
1123次组卷
|
6卷引用:湖北省襄阳市第五中学2022届高三适应性考试(一)化学试题
湖北省襄阳市第五中学2022届高三适应性考试(一)化学试题吉林省长春市2022届高三质量监测线上考试(三)理综化学试题(已下线)【奋进985】05-备战2022年高考化学名校进阶模拟卷(通用版)湖南省浏阳市第一中学2022届高三下学期期中考试化学试题江西省重点校2022-2023学年高三上学期第三次联考化学试题.(已下线)化学反应速率和化学平衡
名校
解题方法
9 . 氢气在化学工业中应用广泛,回答下列问题:
(1)已知:I.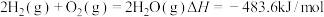 ;
;
Ⅱ.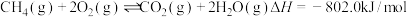 ;
;
Ⅲ.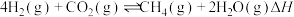
若反应Ⅲ的逆反应活化能为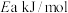 ,则正反应活化能为
,则正反应活化能为_______  (用含
(用含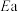 的式子表示)。
的式子表示)。
(2)在有机合成中,氢气常用于不饱和烃的加成,如: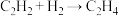 、
、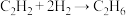 。一定温度和催化剂作用下,将
。一定温度和催化剂作用下,将 和
和 按照体积比为4:1充入恒容密闭容器中发生上述反应,当
按照体积比为4:1充入恒容密闭容器中发生上述反应,当 完全反应时,乙烯的体积分数为20%,则
完全反应时,乙烯的体积分数为20%,则 的转化率为
的转化率为_______ , 的选择性为
的选择性为_______ (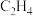 的选择性
的选择性 )。
)。
(3)一定条件下, 能与
能与 反应,反应热化学方程式为
反应,反应热化学方程式为 。在某恒容密闭容器中按投料比
。在某恒容密闭容器中按投料比 发生上述反应,不同催化剂条件下反应相同时间测得
发生上述反应,不同催化剂条件下反应相同时间测得 转化率与温度的关系如图所示。
转化率与温度的关系如图所示。

①下列能够说明该反应已达到化学平衡状态的是_______ (填字母)。
A.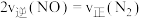 B.混合气体的密度不再变化
B.混合气体的密度不再变化
C.容器内总压强不再变化 D.混合气体的平均相对分子质量不再变化
②使用催化剂乙时, 转化率随温度升高先增大后减小的原因可能是
转化率随温度升高先增大后减小的原因可能是_______ 。
③研究表明该反应速率方程式为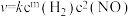 ,其中k为速率常数,与温度、活化能有关。若投料比
,其中k为速率常数,与温度、活化能有关。若投料比 ,
, 时的初始速率为
时的初始速率为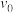 ,当
,当 转化率为50%时,反应速率为
转化率为50%时,反应速率为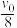 ,由此可知m=
,由此可知m=_______ 。设此时反应的活化能为Ea',不同温度 、
、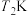 条件下对应的速率常数分别为k1、k2,存在关系: lg
条件下对应的速率常数分别为k1、k2,存在关系: lg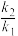 =-
=-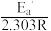
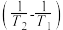 为(R为常数),据此推测:活化能越大,升高温度,速率常数增大的倍数
为(R为常数),据此推测:活化能越大,升高温度,速率常数增大的倍数_______ (填“越大”,“越小”或“不变”)。
(1)已知:I.
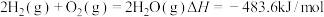 ;
;Ⅱ.
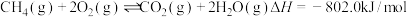 ;
;Ⅲ.
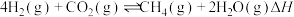
若反应Ⅲ的逆反应活化能为
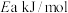 ,则正反应活化能为
,则正反应活化能为 (用含
(用含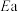 的式子表示)。
的式子表示)。(2)在有机合成中,氢气常用于不饱和烃的加成,如:
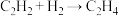 、
、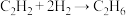 。一定温度和催化剂作用下,将
。一定温度和催化剂作用下,将 和
和 按照体积比为4:1充入恒容密闭容器中发生上述反应,当
按照体积比为4:1充入恒容密闭容器中发生上述反应,当 完全反应时,乙烯的体积分数为20%,则
完全反应时,乙烯的体积分数为20%,则 的转化率为
的转化率为 的选择性为
的选择性为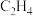 的选择性
的选择性 )。
)。(3)一定条件下,
 能与
能与 反应,反应热化学方程式为
反应,反应热化学方程式为 。在某恒容密闭容器中按投料比
。在某恒容密闭容器中按投料比 发生上述反应,不同催化剂条件下反应相同时间测得
发生上述反应,不同催化剂条件下反应相同时间测得 转化率与温度的关系如图所示。
转化率与温度的关系如图所示。
①下列能够说明该反应已达到化学平衡状态的是
A.
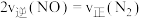 B.混合气体的密度不再变化
B.混合气体的密度不再变化C.容器内总压强不再变化 D.混合气体的平均相对分子质量不再变化
②使用催化剂乙时,
 转化率随温度升高先增大后减小的原因可能是
转化率随温度升高先增大后减小的原因可能是③研究表明该反应速率方程式为
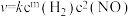 ,其中k为速率常数,与温度、活化能有关。若投料比
,其中k为速率常数,与温度、活化能有关。若投料比 ,
, 时的初始速率为
时的初始速率为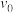 ,当
,当 转化率为50%时,反应速率为
转化率为50%时,反应速率为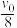 ,由此可知m=
,由此可知m= 、
、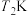 条件下对应的速率常数分别为k1、k2,存在关系: lg
条件下对应的速率常数分别为k1、k2,存在关系: lg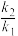 =-
=-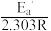
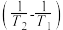 为(R为常数),据此推测:活化能越大,升高温度,速率常数增大的倍数
为(R为常数),据此推测:活化能越大,升高温度,速率常数增大的倍数
您最近一年使用:0次
10 . 碳和碳的化合物在生产、生活中有着重要的作用,甲烷、甲醇等都是重要的能源物质。
(1)甲醇-水蒸气重整在工业生产中用途广泛,主要反应为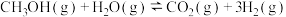 ∆H。
∆H。
已知同时还进行的反应有:
Ⅰ.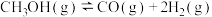 ∆H1=+90.8kJ∙mol
∆H1=+90.8kJ∙mol
Ⅱ. ∆H2=-41.1kJ∙mol
∆H2=-41.1kJ∙mol
则:
①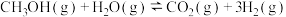 ∆H=
∆H=___________ 。
②该反应自发进行的条件是___________ (填字母)。
A.高温 B.低温 C.所有温度 D.所有温度均不自发
③甲醇-水蒸气重整制氢是电动汽车氢氧燃料电池理想的氢源。CO会损坏燃料电池的交换膜。工业生产过程中会向重整系统中加入适量轻质多孔的生石灰,以减轻燃料电池的交换膜的损坏,主要原因为___________ 。
(2)甲烷通常也可通过多种重整方式进行利用,如二氧化碳重整甲烷反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),实验测定该反应的反应速率v正=k正∙c(CH4)∙c(CO2),v逆=k逆∙c2(CO) c2(H2),k正、k逆 分别是正、逆反应速率常数,且只与温度有关。T℃时,向某恒温恒容密闭容器中充入物质的量浓度均为1mol∙L-1的CH4 (g)和CO2 (g),发生重整反应,测得体系中CH4 (g)和CO(g)的物质的量浓度随时间的变化如图所示:
2CO(g)+2H2(g),实验测定该反应的反应速率v正=k正∙c(CH4)∙c(CO2),v逆=k逆∙c2(CO) c2(H2),k正、k逆 分别是正、逆反应速率常数,且只与温度有关。T℃时,向某恒温恒容密闭容器中充入物质的量浓度均为1mol∙L-1的CH4 (g)和CO2 (g),发生重整反应,测得体系中CH4 (g)和CO(g)的物质的量浓度随时间的变化如图所示:

①B点的坐标为___________ 。
②反应进行到5min时,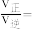
___________ 。
(3)二氧化碳的资源化利用是科学工作者研究的重要方向。我国科学家开发的特殊催化剂用于CO2制备CH2=CH2,有利于实现“双碳”目标: ∆H=-127.8kJ∙mol,过程中可得副产物甲酸:
∆H=-127.8kJ∙mol,过程中可得副产物甲酸: ∆H=-31.4kJ∙mol 。
∆H=-31.4kJ∙mol 。
①在合适催化剂的作用下,在恒容容器中充入一定量的CO2与H2,反应进行相同的时间测得体系中HCOOH和C2H4的体积分数随温度的变化如图所示,则主反应与副反应中活化能较大的反应是___________ (填“主反应”或“副反应”);600K后,C2H4的体积分数减小的主要原因为___________ 。

②一定温度下,在容积为1L的恒容密闭容器中充入2mol CO2(g)和6mol H2(g),同时发生了主反应和副反应,达到平衡时CH2=CH2的物质的量为0.5mol,H2的物质的量为2.5mol,则该温度下,副反应的平衡常数K=___________ 。
(1)甲醇-水蒸气重整在工业生产中用途广泛,主要反应为
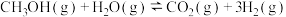 ∆H。
∆H。 已知同时还进行的反应有:
Ⅰ.
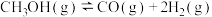 ∆H1=+90.8kJ∙mol
∆H1=+90.8kJ∙mol Ⅱ.
 ∆H2=-41.1kJ∙mol
∆H2=-41.1kJ∙mol 则:
①
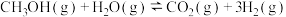 ∆H=
∆H=②该反应自发进行的条件是
A.高温 B.低温 C.所有温度 D.所有温度均不自发
③甲醇-水蒸气重整制氢是电动汽车氢氧燃料电池理想的氢源。CO会损坏燃料电池的交换膜。工业生产过程中会向重整系统中加入适量轻质多孔的生石灰,以减轻燃料电池的交换膜的损坏,主要原因为
(2)甲烷通常也可通过多种重整方式进行利用,如二氧化碳重整甲烷反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g),实验测定该反应的反应速率v正=k正∙c(CH4)∙c(CO2),v逆=k逆∙c2(CO) c2(H2),k正、k逆 分别是正、逆反应速率常数,且只与温度有关。T℃时,向某恒温恒容密闭容器中充入物质的量浓度均为1mol∙L-1的CH4 (g)和CO2 (g),发生重整反应,测得体系中CH4 (g)和CO(g)的物质的量浓度随时间的变化如图所示:
2CO(g)+2H2(g),实验测定该反应的反应速率v正=k正∙c(CH4)∙c(CO2),v逆=k逆∙c2(CO) c2(H2),k正、k逆 分别是正、逆反应速率常数,且只与温度有关。T℃时,向某恒温恒容密闭容器中充入物质的量浓度均为1mol∙L-1的CH4 (g)和CO2 (g),发生重整反应,测得体系中CH4 (g)和CO(g)的物质的量浓度随时间的变化如图所示: 
①B点的坐标为
②反应进行到5min时,
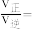
(3)二氧化碳的资源化利用是科学工作者研究的重要方向。我国科学家开发的特殊催化剂用于CO2制备CH2=CH2,有利于实现“双碳”目标:
 ∆H=-127.8kJ∙mol,过程中可得副产物甲酸:
∆H=-127.8kJ∙mol,过程中可得副产物甲酸: ∆H=-31.4kJ∙mol 。
∆H=-31.4kJ∙mol 。①在合适催化剂的作用下,在恒容容器中充入一定量的CO2与H2,反应进行相同的时间测得体系中HCOOH和C2H4的体积分数随温度的变化如图所示,则主反应与副反应中活化能较大的反应是

②一定温度下,在容积为1L的恒容密闭容器中充入2mol CO2(g)和6mol H2(g),同时发生了主反应和副反应,达到平衡时CH2=CH2的物质的量为0.5mol,H2的物质的量为2.5mol,则该温度下,副反应的平衡常数K=
您最近一年使用:0次
2022-04-01更新
|
672次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2022届高三学业水平等级考试模拟演练(一)化学试题



