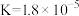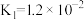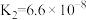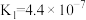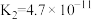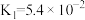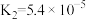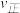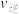Ⅰ.在火箭推进器中装有强还原剂肼( )和强氧化剂(
)和强氧化剂( ),当它们混合时,即产生大量的
),当它们混合时,即产生大量的 和水蒸气,并放出大量热。已知
和水蒸气,并放出大量热。已知 液态肼和足量
液态肼和足量 反应,生成氮气和水蒸气,放出
反应,生成氮气和水蒸气,放出 的热量。
的热量。
(1)写出该反应的热化学方程式___________ 。
(2)已知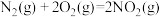 ;
;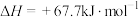 ,
,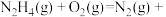
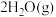 ;
;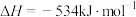 ,根据盖斯定律写出肼与
,根据盖斯定律写出肼与 完全反应生成氮气和气态水的热化学方程式
完全反应生成氮气和气态水的热化学方程式___________ 。
(3)已知:
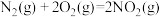
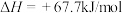 ,
,

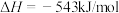 ,
,
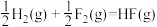
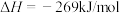 ,
,
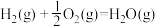
 ,
,
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:___________ 。
Ⅱ.已知100℃时水的离子积 是
是 ,回答下列问题:
,回答下列问题:
(4)常温下,在 的
的 溶液中加入等体积的
溶液中加入等体积的 的稀盐酸后,溶液呈中性。则
的稀盐酸后,溶液呈中性。则 的
的
___________ 。
(5)难溶电解质在水溶液中存在着电离平衡。在常温下,溶液中各离子浓度以它们的系数为次方的乘积是一个常数,这个常数叫溶度积( )如
)如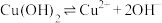 ,
,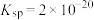 溶液里各离子浓度(包括其次方)的乘积大于溶度积时则出现沉淀;反之则沉淀溶解。
溶液里各离子浓度(包括其次方)的乘积大于溶度积时则出现沉淀;反之则沉淀溶解。
①某 溶液里,
溶液里,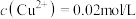 ,如果要生成
,如果要生成 沉淀,应调整溶液的pH,使之大于
沉淀,应调整溶液的pH,使之大于___________ 。
②要使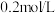
 溶液中的
溶液中的 沉淀较为完全(使
沉淀较为完全(使 溶液降低至原来的千分之一),则应向溶液中加入
溶液降低至原来的千分之一),则应向溶液中加入 溶液,使溶液pH为
溶液,使溶液pH为___________ 。
(6)25℃在等体积的① 的
的 溶液,②
溶液,② 的
的 溶液,,③
溶液,,③ 的
的 溶液,④
溶液,④ 的
的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是___________
(7)在100℃时,向
 的盐酸中滴加
的盐酸中滴加 的
的 溶液
溶液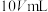 ,所得混合溶液中
,所得混合溶液中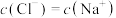 ,则此时
,则此时 的值为
的值为___________ 。
 )和强氧化剂(
)和强氧化剂( ),当它们混合时,即产生大量的
),当它们混合时,即产生大量的 和水蒸气,并放出大量热。已知
和水蒸气,并放出大量热。已知 液态肼和足量
液态肼和足量 反应,生成氮气和水蒸气,放出
反应,生成氮气和水蒸气,放出 的热量。
的热量。(1)写出该反应的热化学方程式
(2)已知
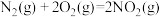 ;
;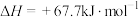 ,
,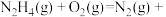
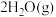 ;
;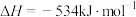 ,根据盖斯定律写出肼与
,根据盖斯定律写出肼与 完全反应生成氮气和气态水的热化学方程式
完全反应生成氮气和气态水的热化学方程式(3)已知:
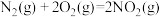
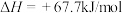 ,
,
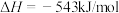 ,
,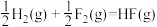
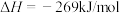 ,
,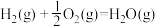
 ,
,有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:
Ⅱ.已知100℃时水的离子积
 是
是 ,回答下列问题:
,回答下列问题:(4)常温下,在
 的
的 溶液中加入等体积的
溶液中加入等体积的 的稀盐酸后,溶液呈中性。则
的稀盐酸后,溶液呈中性。则 的
的
(5)难溶电解质在水溶液中存在着电离平衡。在常温下,溶液中各离子浓度以它们的系数为次方的乘积是一个常数,这个常数叫溶度积(
 )如
)如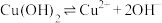 ,
,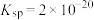 溶液里各离子浓度(包括其次方)的乘积大于溶度积时则出现沉淀;反之则沉淀溶解。
溶液里各离子浓度(包括其次方)的乘积大于溶度积时则出现沉淀;反之则沉淀溶解。①某
 溶液里,
溶液里,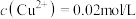 ,如果要生成
,如果要生成 沉淀,应调整溶液的pH,使之大于
沉淀,应调整溶液的pH,使之大于②要使
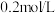
 溶液中的
溶液中的 沉淀较为完全(使
沉淀较为完全(使 溶液降低至原来的千分之一),则应向溶液中加入
溶液降低至原来的千分之一),则应向溶液中加入 溶液,使溶液pH为
溶液,使溶液pH为(6)25℃在等体积的①
 的
的 溶液,②
溶液,② 的
的 溶液,,③
溶液,,③ 的
的 溶液,④
溶液,④ 的
的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是(7)在100℃时,向

 的盐酸中滴加
的盐酸中滴加 的
的 溶液
溶液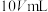 ,所得混合溶液中
,所得混合溶液中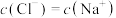 ,则此时
,则此时 的值为
的值为
更新时间:2022-12-08 17:11:18
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】 作为自然界丰富的“碳源”化合物,将
作为自然界丰富的“碳源”化合物,将 转化为
转化为 、
、 等燃料,不仅能缓解碳排放带来的环境问题,还将成为理想的能源补充形式。
等燃料,不仅能缓解碳排放带来的环境问题,还将成为理想的能源补充形式。
(1)已知25℃和101 时,①
时,① 的燃烧热
的燃烧热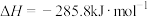 ;
;
② 的燃烧热
的燃烧热
 ;
;
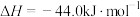 。
。
则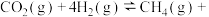
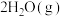

___________  。
。
(2)控制起始时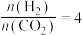 ,
, (
( 表示标准大气压),在恒容密闭容器中,发生反应[同时有副反应
表示标准大气压),在恒容密闭容器中,发生反应[同时有副反应
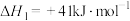 发生],平衡时各物质的物质的量分数随温度的变化如图所示:
发生],平衡时各物质的物质的量分数随温度的变化如图所示:
①平衡时 的物质的量分数随温度变化的曲线为
的物质的量分数随温度变化的曲线为___________ 。
②温度高于500℃时, 的物质的量分数不断增大的原因是
的物质的量分数不断增大的原因是___________ 。
(3)催化制氢是目前大规模制取氢气的方法之一:

 。在
。在 ℃时,将0.10
℃时,将0.10
 与0.40
与0.40
 充入5L的容器中,反应平衡后
充入5L的容器中,反应平衡后 的体积分数
的体积分数 。
。
①反应平衡常数
___________ (结果保留2位有效数字)。
②保持K不变,提高 平衡转化率的措施有
平衡转化率的措施有___________ (任意一条)。
③由 ℃时上述实验数据计算得到
℃时上述实验数据计算得到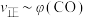 (体积分数,下同)和
(体积分数,下同)和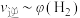 的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,表示
的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,表示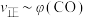 的点是
的点是___________ (填字母,下同),表示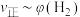 的点是
的点是___________ 。
(4)近年来,生物电催化技术运用微生物电解池实现了 的甲烷化,其工作原理如图所示。
的甲烷化,其工作原理如图所示。
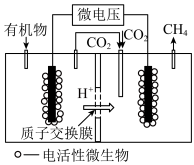
①微生物电解池实现 甲烷化的阴极的电极反应式为
甲烷化的阴极的电极反应式为___________ 。
②如果处理有机物[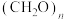 ]产生标准状况下112
]产生标准状况下112
 ,那么理论上导线中通过电子的物质的量为
,那么理论上导线中通过电子的物质的量为___________ 。
 作为自然界丰富的“碳源”化合物,将
作为自然界丰富的“碳源”化合物,将 转化为
转化为 、
、 等燃料,不仅能缓解碳排放带来的环境问题,还将成为理想的能源补充形式。
等燃料,不仅能缓解碳排放带来的环境问题,还将成为理想的能源补充形式。(1)已知25℃和101
 时,①
时,① 的燃烧热
的燃烧热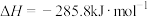 ;
;②
 的燃烧热
的燃烧热
 ;
;
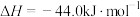 。
。则
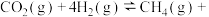
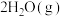

 。
。(2)控制起始时
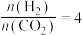 ,
, (
( 表示标准大气压),在恒容密闭容器中,发生反应[同时有副反应
表示标准大气压),在恒容密闭容器中,发生反应[同时有副反应
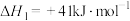 发生],平衡时各物质的物质的量分数随温度的变化如图所示:
发生],平衡时各物质的物质的量分数随温度的变化如图所示:
①平衡时
 的物质的量分数随温度变化的曲线为
的物质的量分数随温度变化的曲线为②温度高于500℃时,
 的物质的量分数不断增大的原因是
的物质的量分数不断增大的原因是(3)催化制氢是目前大规模制取氢气的方法之一:


 。在
。在 ℃时,将0.10
℃时,将0.10
 与0.40
与0.40
 充入5L的容器中,反应平衡后
充入5L的容器中,反应平衡后 的体积分数
的体积分数 。
。①反应平衡常数

②保持K不变,提高
 平衡转化率的措施有
平衡转化率的措施有③由
 ℃时上述实验数据计算得到
℃时上述实验数据计算得到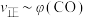 (体积分数,下同)和
(体积分数,下同)和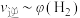 的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,表示
的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,表示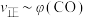 的点是
的点是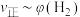 的点是
的点是
(4)近年来,生物电催化技术运用微生物电解池实现了
 的甲烷化,其工作原理如图所示。
的甲烷化,其工作原理如图所示。
①微生物电解池实现
 甲烷化的阴极的电极反应式为
甲烷化的阴极的电极反应式为②如果处理有机物[
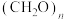 ]产生标准状况下112
]产生标准状况下112
 ,那么理论上导线中通过电子的物质的量为
,那么理论上导线中通过电子的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】生活和工业中SO2、CO、NOx等污染物的来源很多,它们的过度排放会对环境和人体健康带来极大的危害。据报道,从2023年7月1日开始,我国将全面实行燃油车“国六B标准”排放,届时汽车尾气中的各类污染物的排放量均进一步减少。工业上可采取多种方法减少这些有害气体的排放。回答下列问题:
I.
(1)25℃时,若用氢氧化钠溶液吸收SO2,当得到pH=9的吸收液时,该吸收液中c( ):c(
):c( )=
)=___________ 。(已知25℃时,亚硫酸Ka1=1.3×10-2;Ka2=6.2×10-7)
Ⅱ.汽车尾气中的NO和CO在催化转化器中反应生成两种无毒无害的气体:2NO+2CO⇌N2+2CO2,可减少尾气中有害气体排放。已知该反应的 正=k正c2(NO)c2(CO),
正=k正c2(NO)c2(CO), 逆=k逆c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
逆=k逆c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
(2)已知:碳的燃烧热为393.5kJ/mol
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) ΔH2=-221kJ/mol
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=
N2(g)+2CO2(g) ΔH=___________ 。该反应在常温下可自发进行的原因是___________ 。若平衡后升高温度,则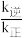
___________ (填“增大”、“不变”或“减小”)。
(3)将CO和NO按不同比例投入一密闭容器中,控制一定温度(T1或T2),发生反应并达到平衡时,所得的混合气体中含N2的体积分数随 的变化曲线如图所示。
的变化曲线如图所示。
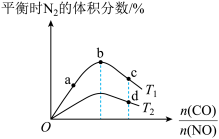
①图中a、b、c、d中对应NO转化率最大的是____________ 。
②若 =1,T1温度下,反应达平衡时,体系的总压强为aPa、N2的体积分数为20%,该温度下反应的平衡常数Kp为
=1,T1温度下,反应达平衡时,体系的总压强为aPa、N2的体积分数为20%,该温度下反应的平衡常数Kp为___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)催化剂性能决定了尾气处理效果。将NO和CO以一定的流速通过两种不同的催化剂(I、Ⅱ)进行反应,测量逸出气体中NO含量,可测算尾气脱氮率。相同时间内,脱氮率随温度变化曲线如图所示。
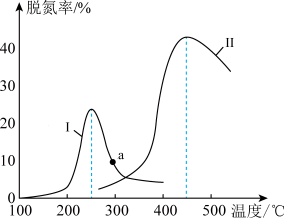
①曲线上a点的脱氮率___________ (填“>”、“<”或“=”)对应温度下的平衡脱氮率。
②催化剂Ⅱ条件下,450℃后,脱氮率随温度升高而下降的原因可能是___________ 。
I.
(1)25℃时,若用氢氧化钠溶液吸收SO2,当得到pH=9的吸收液时,该吸收液中c(
 ):c(
):c( )=
)=Ⅱ.汽车尾气中的NO和CO在催化转化器中反应生成两种无毒无害的气体:2NO+2CO⇌N2+2CO2,可减少尾气中有害气体排放。已知该反应的
 正=k正c2(NO)c2(CO),
正=k正c2(NO)c2(CO), 逆=k逆c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
逆=k逆c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。(2)已知:碳的燃烧热为393.5kJ/mol
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) ΔH2=-221kJ/mol
则反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH=
N2(g)+2CO2(g) ΔH=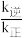
(3)将CO和NO按不同比例投入一密闭容器中,控制一定温度(T1或T2),发生反应并达到平衡时,所得的混合气体中含N2的体积分数随
 的变化曲线如图所示。
的变化曲线如图所示。
①图中a、b、c、d中对应NO转化率最大的是
②若
 =1,T1温度下,反应达平衡时,体系的总压强为aPa、N2的体积分数为20%,该温度下反应的平衡常数Kp为
=1,T1温度下,反应达平衡时,体系的总压强为aPa、N2的体积分数为20%,该温度下反应的平衡常数Kp为(4)催化剂性能决定了尾气处理效果。将NO和CO以一定的流速通过两种不同的催化剂(I、Ⅱ)进行反应,测量逸出气体中NO含量,可测算尾气脱氮率。相同时间内,脱氮率随温度变化曲线如图所示。

①曲线上a点的脱氮率
②催化剂Ⅱ条件下,450℃后,脱氮率随温度升高而下降的原因可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】温室效应和污染正在成为日益严重的环境问题。
Ⅰ.煤制得的化工原料中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
①水解反应:COS(g)+H2O(g) H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1
②氢解反应:COS(g)+H2(g) H2S(g)+CO(g) ΔH2=-54 kJ·mol-1
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1
(1)请计算CO(g)+H2O(g) H2(g)+CO2(g) ΔH3=
H2(g)+CO2(g) ΔH3=_________ kJ·mol-1。
(2)在定温定容条件下,下列事实说明反应①达到平衡状态的是________ (填字母)。
A.容器的压强不再改变 B.混合气体的密度不再改变
C.H2S的百分含量不再改变 D.生成1 mol H—O键,同时生成1 mol H—S键
(3)一定温度和压强下,在1 L的密闭容器中,充入1 mol CO2和3 mol H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
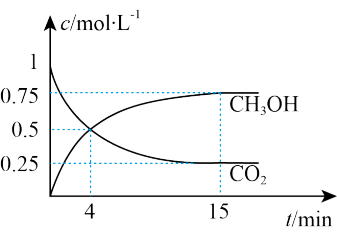
①反应进行到4 min 时,v(正)______ v(逆) (填“>”“<"或“=”)。0~4 min,H2的平均反应速率v(H2)=___ mol· L-1·min-1。
②写出一种在该温度下提高CH3OH产率的方法_____________________ 。
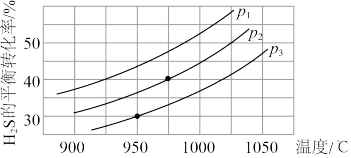
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:
2H2S(g) 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。
(4)该反应ΔH_________ 0;ΔS________ 0。(填“>”或“<”)
(5)图中压强P1、P2、P3由大到小的顺序是__________________ 。
(6)在压强为P2,温度为975℃时,该反应的平衡常数K=___________ (保留2位有效数字)
Ⅰ.煤制得的化工原料中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
①水解反应:COS(g)+H2O(g)
 H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1②氢解反应:COS(g)+H2(g)
 H2S(g)+CO(g) ΔH2=-54 kJ·mol-1
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1(1)请计算CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH3=
H2(g)+CO2(g) ΔH3=(2)在定温定容条件下,下列事实说明反应①达到平衡状态的是
A.容器的压强不再改变 B.混合气体的密度不再改变
C.H2S的百分含量不再改变 D.生成1 mol H—O键,同时生成1 mol H—S键
(3)一定温度和压强下,在1 L的密闭容器中,充入1 mol CO2和3 mol H2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
①反应进行到4 min 时,v(正)
②写出一种在该温度下提高CH3OH产率的方法
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:
2H2S(g)
 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。(4)该反应ΔH
(5)图中压强P1、P2、P3由大到小的顺序是
(6)在压强为P2,温度为975℃时,该反应的平衡常数K=

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】按要求完成下列填空
(1)常温下,0.01mol/LNaOH溶液的
_______ ;将该溶液加水稀释 倍后
倍后
_______ ,则稀释后 溶液中水电离产生的
溶液中水电离产生的 是
是 的
的 溶液中水电离产生的
溶液中水电离产生的 的
的_______ 倍。
(2)将等 等体积的
等体积的 和
和 分别稀释
分别稀释 倍和
倍和 倍,稀释后两溶液的
倍,稀释后两溶液的 仍相等,则m
仍相等,则m_______ n(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(3)已知 时,水的离子积为
时,水的离子积为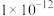 ,该温度下测得某溶液
,该温度下测得某溶液 ,该溶液显
,该溶液显_______ (填“酸”、“碱”或“中”)性;将此温度下 的
的 溶液
溶液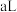 与
与 的
的 溶液
溶液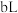 混合,若所得混合液
混合,若所得混合液 ,则a:b=
,则a:b=_______ 。
(1)常温下,0.01mol/LNaOH溶液的

 倍后
倍后
 溶液中水电离产生的
溶液中水电离产生的 是
是 的
的 溶液中水电离产生的
溶液中水电离产生的 的
的(2)将等
 等体积的
等体积的 和
和 分别稀释
分别稀释 倍和
倍和 倍,稀释后两溶液的
倍,稀释后两溶液的 仍相等,则m
仍相等,则m ”、“
”、“ ”或“
”或“ ”)。
”)。(3)已知
 时,水的离子积为
时,水的离子积为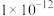 ,该温度下测得某溶液
,该温度下测得某溶液 ,该溶液显
,该溶液显 的
的 溶液
溶液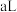 与
与 的
的 溶液
溶液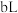 混合,若所得混合液
混合,若所得混合液 ,则a:b=
,则a:b=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】草酸(H2C2O4,二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用,常温下,H2C2O4:Ka1=5.4×10-2,Ka2=5.4×10-5。H2CO3:K1=4×10-7K2=6×10-11。
(1)NaHCO3溶液显____ 性。
(2)常温下,0.1mol·L-1的Na2C2O4溶液pH=a,0.1 mol·L-1的Na2CO3溶液pH=b,则a___ b(填“>”“<”或“=”)。
(3)常温下,pH=3的H2C2O4溶液的物质的量浓度为c1,水电离出的c(H+)为c3;pH=4的H2C2O4溶液的物质的量浓度为c2,水电离出的c(H+)为c4。则c1_____ 10c2(填“>”“<”或“=”,下同);10c3___ c4。
(4)常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)=c(Na+)

①该草酸溶液的物质的量浓度为_________ (结果保留三位小数)。
②a点所示溶液中各离子的浓度由大到小的顺序为__________ 。
(1)NaHCO3溶液显
(2)常温下,0.1mol·L-1的Na2C2O4溶液pH=a,0.1 mol·L-1的Na2CO3溶液pH=b,则a
(3)常温下,pH=3的H2C2O4溶液的物质的量浓度为c1,水电离出的c(H+)为c3;pH=4的H2C2O4溶液的物质的量浓度为c2,水电离出的c(H+)为c4。则c1
(4)常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)=c(Na+)

①该草酸溶液的物质的量浓度为
②a点所示溶液中各离子的浓度由大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】盐在化学工业中有重要的应用,请回答下列问题。
(1)用离子方程式表示FeCl3可作净水剂的原因:______________________________ 。
(2)常温下,在pH=3的硫酸与pH =11的Na2S溶液中,水电离出来的c(OH-)之比为_______
(3)物质的量浓度相等的下列溶液①NH4Cl②NH4 HSO4③(NH4 ) 2SO4④CH3 COONH4⑤NH3 • H2O,溶液中的C(NH4 +)由大到小的顺序是__________________ (用序号表示)。
(4)25℃,两种酸的电离平衡常数如下表:
①0.10 mol • L-1NaHSO3溶液中离子浓度由大到小的顺序为__________________
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为__________________________
(5)已知 25 ℃ 时 Ksp[Mg(OH)2] =1.8×10-11, Ksp[Cu(OH)2] =2.2 ×10-20.25 ℃时,向浓度均为0.1 mol • L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________ (填化学式)沉淀;当体系中两种沉淀共存时,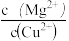 =
=_______ 。
(1)用离子方程式表示FeCl3可作净水剂的原因:
(2)常温下,在pH=3的硫酸与pH =11的Na2S溶液中,水电离出来的c(OH-)之比为
(3)物质的量浓度相等的下列溶液①NH4Cl②NH4 HSO4③(NH4 ) 2SO4④CH3 COONH4⑤NH3 • H2O,溶液中的C(NH4 +)由大到小的顺序是
(4)25℃,两种酸的电离平衡常数如下表:
| Ka1 | Ka2 | |
| H2SO3 | 1.3x10-2 | 6.3x10-8 |
| H2CO3 | 4.2x10-7 | 5.6x10-11 |
①0.10 mol • L-1NaHSO3溶液中离子浓度由大到小的顺序为
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为
(5)已知 25 ℃ 时 Ksp[Mg(OH)2] =1.8×10-11, Ksp[Cu(OH)2] =2.2 ×10-20.25 ℃时,向浓度均为0.1 mol • L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
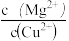 =
=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·6H2O):
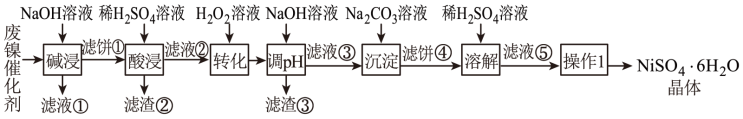
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是①溶解铝及其氧化物,②_______ 。
(2)“转化”过程中反应的离子方程式为_______ ,c(H2O2)随时间t的变化关系如图所示,反应开始10~20min内c(H2O2)迅速减小,原因可能是_______ (不考虑溶液温度变化)。

(3)利用上述表格数据,计算Ni(OH)2的Ksp=_______ 。如果“转化”后的溶液中Ni2+浓度为1.0mol·L−1,则“调pH”应控制的pH范围是_______ 。
(4)硫酸镍结晶水合物的形态与温度的关系如下表。
从滤液⑤中获得稳定NiSO4·6H2O晶体的操作1依次是蒸发浓缩、_______ 、过滤、洗涤、干燥。
(5)分离出NiSO4·6H2O晶体后的剩余液体要循环使用,则应该回流到流程中滤液_______ 的位置(填②、③、⑤),其目的是_______ 。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mol·L−1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10−5mol·L−1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是①溶解铝及其氧化物,②
(2)“转化”过程中反应的离子方程式为

(3)利用上述表格数据,计算Ni(OH)2的Ksp=
(4)硫酸镍结晶水合物的形态与温度的关系如下表。
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 | NiSO4·7H2O | NiSO4·6H2O | 多种结晶水合物 | NiSO4 |
从滤液⑤中获得稳定NiSO4·6H2O晶体的操作1依次是蒸发浓缩、
(5)分离出NiSO4·6H2O晶体后的剩余液体要循环使用,则应该回流到流程中滤液
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料,一种以含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如表:
(1)调节pH步骤中,溶液pH的调节范围是___________ 。
(2)滤渣1主要成分是_______________ ;滤渣2主要成分是_________________
(3)写出氧化步骤中加入H2O2发生反应的离子方程式_________ 。
(4)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式____________ 。
(5)沉镍过程中,若c(Ni2+)=2.0mol/L,欲使100mL该滤液中的Ni2+沉淀物完全,[c(Ni2+)≤10﹣5 mol/L],则需要加入Na2CO3固体的质量最少为_____ g(保留小数点后1位)
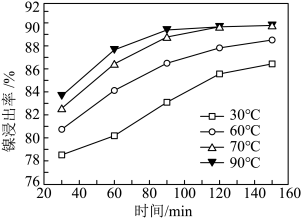
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸。酸浸出率随时间变化如图。酸浸的最佳温度与时间分别为____________ 。

相关离子生成氢氧化物的pH和相关物质的溶解性如表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) | |
| Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10﹣6 |
(1)调节pH步骤中,溶液pH的调节范围是
(2)滤渣1主要成分是
(3)写出氧化步骤中加入H2O2发生反应的离子方程式
(4)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式
(5)沉镍过程中,若c(Ni2+)=2.0mol/L,欲使100mL该滤液中的Ni2+沉淀物完全,[c(Ni2+)≤10﹣5 mol/L],则需要加入Na2CO3固体的质量最少为
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸。酸浸出率随时间变化如图。酸浸的最佳温度与时间分别为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】重铬酸钠( )俗称红矾钠,主要用于颜料、鞣革、电镀等工业。我国目前主要是以铬铁矿(主要成分为
)俗称红矾钠,主要用于颜料、鞣革、电镀等工业。我国目前主要是以铬铁矿(主要成分为 ,还含有
,还含有 、
、 等杂质)为原料进行生产,其主要工艺流程如下:
等杂质)为原料进行生产,其主要工艺流程如下:

已知焙烧时涉及的化学反应有:
主反应:
副反应: 、
、
请回答下列问题:
(1)焙烧时,矿料粉碎的目的是_______ 。
(2)滤渣2的成分有_______ (填化学式)。
(3)加 酸化的作用是
酸化的作用是_______ (用离子方程式表示,下同);采用硫酸而不用盐酸酸化,理由是_______ 。
(4)制取红矾钠后的废水还含有少量的 ,根据有关标准,废水中
,根据有关标准,废水中 的浓度降至
的浓度降至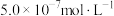 以下才能排放。废水可加入可溶性钡盐生成
以下才能排放。废水可加入可溶性钡盐生成 沉淀
沉淀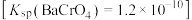 ,再加入可溶性硫酸盐处理多余的
,再加入可溶性硫酸盐处理多余的 。则加入的
。则加入的 的浓度应不小于
的浓度应不小于_______  。
。
(5)工业上可通过电解 溶液直接制取
溶液直接制取 ,装置如图所示,则N电极的电极反应式为
,装置如图所示,则N电极的电极反应式为_______ 。

 )俗称红矾钠,主要用于颜料、鞣革、电镀等工业。我国目前主要是以铬铁矿(主要成分为
)俗称红矾钠,主要用于颜料、鞣革、电镀等工业。我国目前主要是以铬铁矿(主要成分为 ,还含有
,还含有 、
、 等杂质)为原料进行生产,其主要工艺流程如下:
等杂质)为原料进行生产,其主要工艺流程如下:
已知焙烧时涉及的化学反应有:
主反应:

副反应:
 、
、
请回答下列问题:
(1)焙烧时,矿料粉碎的目的是
(2)滤渣2的成分有
(3)加
 酸化的作用是
酸化的作用是(4)制取红矾钠后的废水还含有少量的
 ,根据有关标准,废水中
,根据有关标准,废水中 的浓度降至
的浓度降至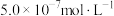 以下才能排放。废水可加入可溶性钡盐生成
以下才能排放。废水可加入可溶性钡盐生成 沉淀
沉淀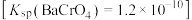 ,再加入可溶性硫酸盐处理多余的
,再加入可溶性硫酸盐处理多余的 。则加入的
。则加入的 的浓度应不小于
的浓度应不小于 。
。(5)工业上可通过电解
 溶液直接制取
溶液直接制取 ,装置如图所示,则N电极的电极反应式为
,装置如图所示,则N电极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】乙酸、碳酸、次氯酸、草酸在生产、生活及医药方面有广泛用途。回答下列问题:
Ⅰ.已知25℃时, 、
、 、HClO和
、HClO和 的电离平衡常数如下:
的电离平衡常数如下:
(1) 的下列四种溶液,pH由小到大的顺序是________(填标号)。
的下列四种溶液,pH由小到大的顺序是________(填标号)。
(2)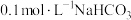 的溶液中
的溶液中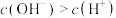 ,结合数据用化学用语解释原因
,结合数据用化学用语解释原因_____ 。
(3)向NaClO溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(4)向NaClO溶液中分别加入下列物质,能增大 的是_____(填标号)。
的是_____(填标号)。
Ⅱ.乙二酸( )俗称草酸,在实验研究和化学工业中应用广泛。
)俗称草酸,在实验研究和化学工业中应用广泛。
室温下,测得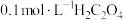 溶液的
溶液的 ,草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
,草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
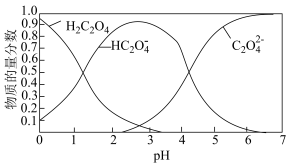
(5)向草酸溶液中滴加KOH溶液至 时发生的主要反应的离子方程式是
时发生的主要反应的离子方程式是________ 。
(6)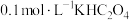 溶液中,下列粒子浓度关系正确的是
溶液中,下列粒子浓度关系正确的是______ (填序号)。
a.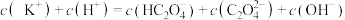
b.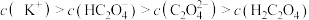
c.
Ⅰ.已知25℃时,
 、
、 、HClO和
、HClO和 的电离平衡常数如下:
的电离平衡常数如下:| 化学式 |  |  | HClO |  |
| 电离平衡常数(Ka) | 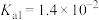 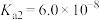 | 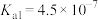  |  |  |
(1)
 的下列四种溶液,pH由小到大的顺序是________(填标号)。
的下列四种溶液,pH由小到大的顺序是________(填标号)。A. | B. | C.NaClO | D. |
(2)
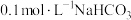 的溶液中
的溶液中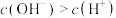 ,结合数据用化学用语解释原因
,结合数据用化学用语解释原因(3)向NaClO溶液中通入少量
 ,反应的离子方程式为
,反应的离子方程式为(4)向NaClO溶液中分别加入下列物质,能增大
 的是_____(填标号)。
的是_____(填标号)。A. | B. | C. | D.NaOH |
Ⅱ.乙二酸(
 )俗称草酸,在实验研究和化学工业中应用广泛。
)俗称草酸,在实验研究和化学工业中应用广泛。室温下,测得
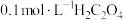 溶液的
溶液的 ,草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
,草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
(5)向草酸溶液中滴加KOH溶液至
 时发生的主要反应的离子方程式是
时发生的主要反应的离子方程式是(6)
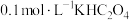 溶液中,下列粒子浓度关系正确的是
溶液中,下列粒子浓度关系正确的是a.
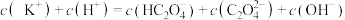
b.
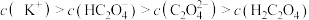
c.

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】结合表回答下列问题(均为常温下的数据):
请回答下列问题:
(1)同浓度的 、
、 、
、 、
、 、
、 中结合
中结合 的能力最强的是
的能力最强的是___________________ 。
(2)常温下0.1mol/L的 溶液在加水稀释过程中,下列表达式的数据一定变小的是 (填字母)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是 (填字母)。
(3)取等体积pH相等的 、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:
、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为: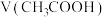
___________________ V(HClO)(填“>”、“<”或“=”)。
(4)向0.1mol/L的草酸氢钠溶液里滴加KOH溶液至中性,此时溶液里各粒子浓度关系正确的是 (填字母代号)。
(5)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为_______________ (已知: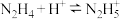 的
的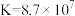 ;
;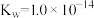 )。联氨与硫酸形成的酸式盐的化学式为
)。联氨与硫酸形成的酸式盐的化学式为______________________________________ 。
化学式 |
|
| HClO |
|
|
电离平衡常数 |
|
|
|
|
|
请回答下列问题:
(1)同浓度的
 、
、 、
、 、
、 、
、 中结合
中结合 的能力最强的是
的能力最强的是(2)常温下0.1mol/L的
 溶液在加水稀释过程中,下列表达式的数据一定变小的是 (填字母)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是 (填字母)。A. | B. | C. | D. |
 、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:
、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为: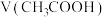
(4)向0.1mol/L的草酸氢钠溶液里滴加KOH溶液至中性,此时溶液里各粒子浓度关系正确的是 (填字母代号)。
A.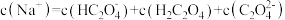 |
B.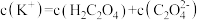 |
C. |
D.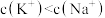 |
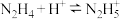 的
的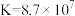 ;
;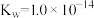 )。联氨与硫酸形成的酸式盐的化学式为
)。联氨与硫酸形成的酸式盐的化学式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g) + O2(g) 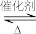 2SO3(g) + Q
2SO3(g) + Q 
(1)若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
(2)2SO2(g) + O2(g) 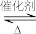 2SO3(g)过程的能量变化如图所示。下列说法正确的是
2SO3(g)过程的能量变化如图所示。下列说法正确的是_________

A.加入催化剂,X点位置升高
B.反应热 = E1 + E2
C.反应物总能量低于生成物
D.加入催化剂,E2不变
(3)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验1从开始到反应达到化学平衡时,用去时间2分钟,则υ(SO2)表示的反应速率为_________ ;T1________ T2(填“>”、“<”或“=”)。制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
(4)0.1mol/L的NaHSO3溶液中c(H+) > c(OH-),用水解和电离理论的角度解释其原因___________________ ;若往溶液中加入氨水至中性,则c(Na+)______ c(HSO3-) + c(SO32-) + c(H2SO3)(填“>”、“﹤”或“=”)。
(5)往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固体,完全溶解后溶液中c(Na+) : c(SO32-)的比值____________ (填“变大”、“变小”或“保持不变”)。
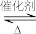 2SO3(g) + Q
2SO3(g) + Q 
(1)若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
|
| 平衡常数K |
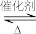 2SO3(g)过程的能量变化如图所示。下列说法正确的是
2SO3(g)过程的能量变化如图所示。下列说法正确的是
A.加入催化剂,X点位置升高
B.反应热 = E1 + E2
C.反应物总能量低于生成物
D.加入催化剂,E2不变
(3)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
(4)0.1mol/L的NaHSO3溶液中c(H+) > c(OH-),用水解和电离理论的角度解释其原因
(5)往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固体,完全溶解后溶液中c(Na+) : c(SO32-)的比值
您最近一年使用:0次