解题方法
1 . 乙烯是一种重要的有机化工原料。利用二氧化碳氧化乙烷制备乙烯的原理如下:
I.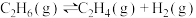

II.
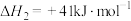
(1)①总反应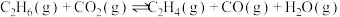 的
的 为
为_______  。
。
②一定温度下,向初始压强为2p的刚性容器中充入等物质的量的乙烷和二氧化碳,发生上述总反应,乙烷的平衡转化率为a,则反应的压强平衡常数
_______ 。
(2)K为总反应的平衡常数,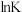 与温度的倒数
与温度的倒数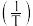 的变化如下图所示:
的变化如下图所示:
以上曲线中表示总反应的曲线的是_______ (填标号),理由是_______ 。
(3)在高温条件下,乙烷脱氢会发生副反应: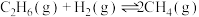 ;
;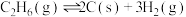 。
。
在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 的平衡转化率和
的平衡转化率和 的平衡选择性随温度的变化如下表所示:(
的平衡选择性随温度的变化如下表所示:( 的选择性
的选择性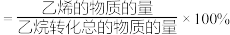 )
)
①乙烯的平衡选择性随温度升高而降低的原因是_______ 。
②研究发现,向反应体系中增加 ,产物中C(s)会减少,请用方程式说明原因
,产物中C(s)会减少,请用方程式说明原因_______ 。
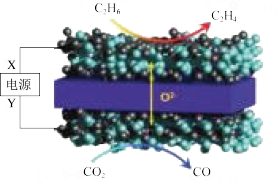
(4)科学家利用固体氧化物电解池也能实现 和
和 的耦合转化,原理如下图所示。则Y是电源的
的耦合转化,原理如下图所示。则Y是电源的_______ (填“正极”或“负极”);正极区的电极反应式为_______ 。
I.
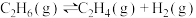

II.

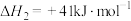
(1)①总反应
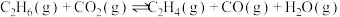 的
的 为
为 。
。②一定温度下,向初始压强为2p的刚性容器中充入等物质的量的乙烷和二氧化碳,发生上述总反应,乙烷的平衡转化率为a,则反应的压强平衡常数

(2)K为总反应的平衡常数,
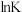 与温度的倒数
与温度的倒数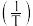 的变化如下图所示:
的变化如下图所示:
以上曲线中表示总反应的曲线的是
(3)在高温条件下,乙烷脱氢会发生副反应:
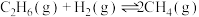 ;
;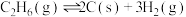 。
。在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 的平衡转化率和
的平衡转化率和 的平衡选择性随温度的变化如下表所示:(
的平衡选择性随温度的变化如下表所示:( 的选择性
的选择性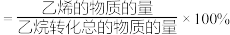 )
)| 温度/℃ |  平衡转化率/% 平衡转化率/% |  平衡选择性/% 平衡选择性/% |
| 625 | 10.5 | 96.5 |
| 650 | 17.8 | 96.0 |
| 675 | 25.2 | 95.1 |
| 700 | 35 | 92.6 |
②研究发现,向反应体系中增加
 ,产物中C(s)会减少,请用方程式说明原因
,产物中C(s)会减少,请用方程式说明原因(4)科学家利用固体氧化物电解池也能实现
 和
和 的耦合转化,原理如下图所示。则Y是电源的
的耦合转化,原理如下图所示。则Y是电源的
您最近一年使用:0次
2 . 2022年冬奥会的国家速滑馆“冰丝带”采用二氧化碳跨临界制冰, 的资源化可以
的资源化可以 推动经济高质量发展和生态环境质量的持续改善。
推动经济高质量发展和生态环境质量的持续改善。
Ⅰ.二氧化碳催化加氢可合成低碳烯烃,合成乙烯( )的反应为:
)的反应为:

 ,该过程分两步进行:
,该过程分两步进行:
第一步:
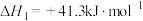
第二步: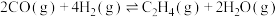
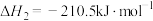
(1)
_______  ,该反应在
,该反应在_______ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)在恒容密闭容器中,起始压强相同,反应温度、投料比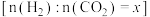 对
对 平衡转化率的影响如图所示。据图判断:
平衡转化率的影响如图所示。据图判断:
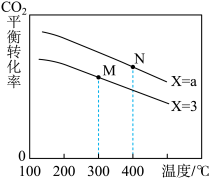
①a_______ 3(填“>”、“<”或“=”)
②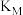
_______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
Ⅱ.以与为原料可以合成尿素 。主要反应可表示为
。主要反应可表示为
 。
。
(3)T℃时,若向容积为2L的密闭容器中加入3mol 和1mol
和1mol ,达到平衡时,容器内压强为开始时的0.75倍。则该反应平衡常数
,达到平衡时,容器内压强为开始时的0.75倍。则该反应平衡常数
_______ 。若保持其他条件不变,向该容器中再加入1mol 和1mol
和1mol ,
, 的转化率将
的转化率将_______ (填“增大”、“减小”或“不变”)。
(4)在恒温恒容条件下,能说明反应已达平衡状态的是_______ (填序号)。
①混合气体的压强不变
②单位时间内生成1mol 同时消耗了1mol
同时消耗了1mol
③混合气体的密度保持不变
④
⑤平衡时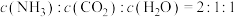
⑥断裂6mol 键同时断裂2mol
键同时断裂2mol 键
键
 的资源化可以
的资源化可以 推动经济高质量发展和生态环境质量的持续改善。
推动经济高质量发展和生态环境质量的持续改善。Ⅰ.二氧化碳催化加氢可合成低碳烯烃,合成乙烯(
 )的反应为:
)的反应为:
 ,该过程分两步进行:
,该过程分两步进行:第一步:

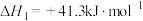
第二步:
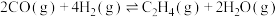
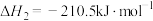
(1)

 ,该反应在
,该反应在(2)在恒容密闭容器中,起始压强相同,反应温度、投料比
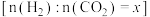 对
对 平衡转化率的影响如图所示。据图判断:
平衡转化率的影响如图所示。据图判断:
①a
②
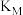
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)Ⅱ.以与为原料可以合成尿素
 。主要反应可表示为
。主要反应可表示为
 。
。(3)T℃时,若向容积为2L的密闭容器中加入3mol
 和1mol
和1mol ,达到平衡时,容器内压强为开始时的0.75倍。则该反应平衡常数
,达到平衡时,容器内压强为开始时的0.75倍。则该反应平衡常数
 和1mol
和1mol ,
, 的转化率将
的转化率将(4)在恒温恒容条件下,能说明反应已达平衡状态的是
①混合气体的压强不变
②单位时间内生成1mol
 同时消耗了1mol
同时消耗了1mol
③混合气体的密度保持不变
④

⑤平衡时
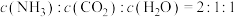
⑥断裂6mol
 键同时断裂2mol
键同时断裂2mol 键
键
您最近一年使用:0次
名校
解题方法
3 . 甲醇制烯烃是一项非石油路线烯烃生产技术,可以减少我国对石油进口的依赖度。回答下列问题:
(1)甲醇可通过煤的液化过程获得,该过程是_______ (填“物理"或“化学")变化。
(2)甲醇制烯烃的反应是不可逆反应,烯烃产物之间存在如下转化关系:
反应I.
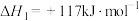
反应II.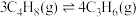
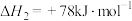
反应III.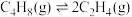

反应达平衡时,三种组分的物质的量分数x随温度T的变化关系如图1所示。

①反应III的
_______  。
。
②图1中曲线a代表的组分是_______ ,700K后,曲线a下降的原因是_______ 。
③图1中P点坐标为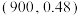 ,900K时,反应III的物质的量分数平衡常数
,900K时,反应III的物质的量分数平衡常数
_______ (以物质的量分数代替浓度计算)。
(3)甲醇制丙烯的反应为 ,速率常数k与反应温度T的关系遵循Arrhenius方程,实验数据如图2所示。已知Arrhenius方程为
,速率常数k与反应温度T的关系遵循Arrhenius方程,实验数据如图2所示。已知Arrhenius方程为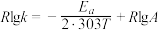 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比; 为活化能;
为活化能; ,A为常数)。
,A为常数)。

①该反应的活化能
_______  (计算结果保留1位小数)。
(计算结果保留1位小数)。
②下列措施能使速率常数k增大的是_______ (填标号)。
A.升高温度 B.增大压强 C.增大 D.更换适宜催化剂
D.更换适宜催化剂
(1)甲醇可通过煤的液化过程获得,该过程是
(2)甲醇制烯烃的反应是不可逆反应,烯烃产物之间存在如下转化关系:
反应I.

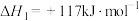
反应II.
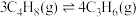
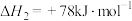
反应III.
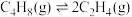

反应达平衡时,三种组分的物质的量分数x随温度T的变化关系如图1所示。

①反应III的

 。
。②图1中曲线a代表的组分是
③图1中P点坐标为
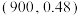 ,900K时,反应III的物质的量分数平衡常数
,900K时,反应III的物质的量分数平衡常数
(3)甲醇制丙烯的反应为
 ,速率常数k与反应温度T的关系遵循Arrhenius方程,实验数据如图2所示。已知Arrhenius方程为
,速率常数k与反应温度T的关系遵循Arrhenius方程,实验数据如图2所示。已知Arrhenius方程为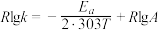 (其中k为速率常数,反应速率与其成正比;
(其中k为速率常数,反应速率与其成正比; 为活化能;
为活化能; ,A为常数)。
,A为常数)。
①该反应的活化能

 (计算结果保留1位小数)。
(计算结果保留1位小数)。②下列措施能使速率常数k增大的是
A.升高温度 B.增大压强 C.增大
 D.更换适宜催化剂
D.更换适宜催化剂
您最近一年使用:0次
2022-09-17更新
|
478次组卷
|
3卷引用:湖北省武汉市部分学校2022-2023学年高三上学期9月调研考试化学试题
4 . NO2和N2O4是氮的两种重要氧化物。回答下列问题:
Ⅰ.已知下列反应在298K时的反应焓变:
①N2(g)+O2(g)=2NO(g) △H1=180.5 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-112 kJ·mol-1
③N2(g)+2O2(g)=N2O4(g) △H3=10.7 kJ·mol-1
(1)写出N2O4(g)转化为NO2(g)的热化学方程式:_______ 。
Ⅱ.298K时,在2 L的恒容绝热密闭容器中发生反应:N2O4(g) 2NO2(g)反应过程中各气体浓度随时间变化的情况如图所示。
2NO2(g)反应过程中各气体浓度随时间变化的情况如图所示。
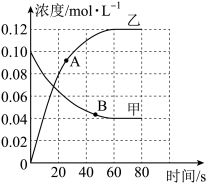
(2)代表NO2气体浓度随时间变化的曲线为_______ (填“甲”或“乙”)。
(3)当N2O4的浓度为0.08 mol·L-1时,反应时间为t s,则0~t s时,用NO2气体的浓度变化量表达该反应的平均速率为_______ 。
(4)A、B两点对应时刻,反应速率大小:vA_______ vB(填“>”“<”或“=”)。
(5)不能说明该反应达到平衡状态的是_______ (填序号)。
a.混合气体的温度不再改变 b.2v正(N2O4)=v逆(NO2)
c.容器内气体颜色不再改变 d.容器内气体的密度不再改变
(6)化学平衡常数(K)是指一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡状态,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积的比值。例如:aA(g)+bB(g) pC(g)+qD(g) K=
pC(g)+qD(g) K=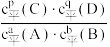 ,计算298K时,反应N2O4(g)
,计算298K时,反应N2O4(g)  2NO2(g)的平衡常数K=
2NO2(g)的平衡常数K=_______ 。
Ⅰ.已知下列反应在298K时的反应焓变:
①N2(g)+O2(g)=2NO(g) △H1=180.5 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-112 kJ·mol-1
③N2(g)+2O2(g)=N2O4(g) △H3=10.7 kJ·mol-1
(1)写出N2O4(g)转化为NO2(g)的热化学方程式:
Ⅱ.298K时,在2 L的恒容绝热密闭容器中发生反应:N2O4(g)
 2NO2(g)反应过程中各气体浓度随时间变化的情况如图所示。
2NO2(g)反应过程中各气体浓度随时间变化的情况如图所示。
(2)代表NO2气体浓度随时间变化的曲线为
(3)当N2O4的浓度为0.08 mol·L-1时,反应时间为t s,则0~t s时,用NO2气体的浓度变化量表达该反应的平均速率为
(4)A、B两点对应时刻,反应速率大小:vA
(5)不能说明该反应达到平衡状态的是
a.混合气体的温度不再改变 b.2v正(N2O4)=v逆(NO2)
c.容器内气体颜色不再改变 d.容器内气体的密度不再改变
(6)化学平衡常数(K)是指一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡状态,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积的比值。例如:aA(g)+bB(g)
 pC(g)+qD(g) K=
pC(g)+qD(g) K=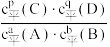 ,计算298K时,反应N2O4(g)
,计算298K时,反应N2O4(g)  2NO2(g)的平衡常数K=
2NO2(g)的平衡常数K=
您最近一年使用:0次
2022-09-14更新
|
439次组卷
|
3卷引用:湖北省襄阳市第三中学2022-2023学年高二上学期12月月考化学试题
5 . 环境保护是当今社会的热门问题,而氮的氧化物是大气污染的主要物质,研究氮的氧化物的反应对于减少污染有重要意义。请根据所学化学知识回答下列问题:
(1)汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成N2,可有效降低汽车尾气污染。已知:
N2(g)+O2(g) 2NO(g) △H=+180.5 kJ·mol-1
2NO(g) △H=+180.5 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221.0 kJ·mol-1
2CO(g) △H=-221.0 kJ·mol-1
则尾气转化反应2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=___________ kJ·mol-1
(2)向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
①下列事实能说明反应达平衡状态的是___________ (填序号)
A.容器内气体的压强不变
B.容器内气体的密度不变
C.容器内气体的平均相对分子质量不变
②计算此温度下,该反应的平衡常数K=___________ L·mol-1。
③保持温度和容积不变,向平衡体系中再充入NO和N2,使二者浓度均增加至原来的两倍,此时平衡移动___________ (填“向正反应方向”“向逆反应方向”或“不”)。
④实验测得,v正=k正・c2(NO)・c2(CO),v逆=k逆•c2(N2)·c (CO2)、(k正、k逆为速率常数,只与温度有关)。达到平衡后,仅升高温度,k正增大的倍数___________ (填“>”“<”或“=")k逆增大的倍数。
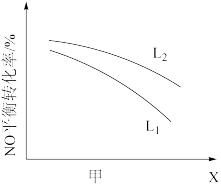
⑤L、X可分别代表压强或温度。图甲表示L一定时,NO(g)的平衡转化率随X的变化关系,则X代表___________ 。判断L1、L2的大小关系,并简述理由:___________
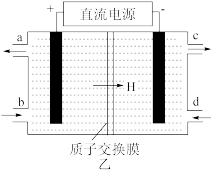
(3)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO 和NO
和NO 。可采用电解法将上述吸收液中的NO
。可采用电解法将上述吸收液中的NO 转化为无毒物质,同时再生Ce4+,其原理如图乙所示。写出阴极的电极反应式
转化为无毒物质,同时再生Ce4+,其原理如图乙所示。写出阴极的电极反应式___________ 。
(1)汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成N2,可有效降低汽车尾气污染。已知:
N2(g)+O2(g)
 2NO(g) △H=+180.5 kJ·mol-1
2NO(g) △H=+180.5 kJ·mol-1C(s)+O2(g)
 CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-12C(s)+O2(g)
 2CO(g) △H=-221.0 kJ·mol-1
2CO(g) △H=-221.0 kJ·mol-1则尾气转化反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=(2)向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(NO)/(10-3 mol·L-1) | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
| c(CO)/(10-3 mol·L-1) | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
①下列事实能说明反应达平衡状态的是
A.容器内气体的压强不变
B.容器内气体的密度不变
C.容器内气体的平均相对分子质量不变
②计算此温度下,该反应的平衡常数K=
③保持温度和容积不变,向平衡体系中再充入NO和N2,使二者浓度均增加至原来的两倍,此时平衡移动
④实验测得,v正=k正・c2(NO)・c2(CO),v逆=k逆•c2(N2)·c (CO2)、(k正、k逆为速率常数,只与温度有关)。达到平衡后,仅升高温度,k正增大的倍数
⑤L、X可分别代表压强或温度。图甲表示L一定时,NO(g)的平衡转化率随X的变化关系,则X代表


(3)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO
 和NO
和NO 。可采用电解法将上述吸收液中的NO
。可采用电解法将上述吸收液中的NO 转化为无毒物质,同时再生Ce4+,其原理如图乙所示。写出阴极的电极反应式
转化为无毒物质,同时再生Ce4+,其原理如图乙所示。写出阴极的电极反应式
您最近一年使用:0次
2022-09-09更新
|
183次组卷
|
2卷引用:湖北省“宜荆荆恩”2023届高三上学期起点考试化学试题
名校
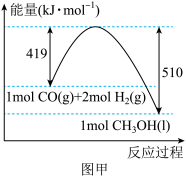
6 . 氢是人们公认的清洁能源,作为零碳能源正在脱颖而出,氢的获得及以氢为原料的工业生产工艺成为科技工作者研究的重要课题。
(1)工业生产中可利用 还原
还原 制备清洁能源甲醇。
制备清洁能源甲醇。
①已知 和
和 的燃烧热(
的燃烧热( )分别为
)分别为 、
、 。
。 与
与 合成甲醇的能量变化如图甲所示,则用
合成甲醇的能量变化如图甲所示,则用 和
和 制备甲醇和液态水的热化学方程式为
制备甲醇和液态水的热化学方程式为___________ 。
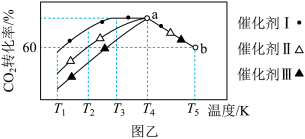
②将一定量的 和
和 充入某恒容密闭容器中,测得在不同催化剂作用下,相同时间内
充入某恒容密闭容器中,测得在不同催化剂作用下,相同时间内 的转化率与温度的变化如图乙所示,催化效果最好的是催化剂
的转化率与温度的变化如图乙所示,催化效果最好的是催化剂___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”);该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是___________ 。
(2)利用 和水蒸气可生产
和水蒸气可生产 ,反应的化学方程式为
,反应的化学方程式为 。将不同量的
。将不同量的 和
和 分别通入体积为2L的恒容密闭容器中进行上述反应,得到数据如下表所示
分别通入体积为2L的恒容密闭容器中进行上述反应,得到数据如下表所示
①该反应的正反应为___________ 反应(填“放热”或“吸热”)。
②900℃时,从开始到达到平衡时的反应速率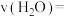
___________ (保留2位小数),达到平衡时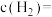
___________ 。
(3)利用废弃的 的热分解可生产
的热分解可生产 :
: 。现将
。现将 通入某恒压(压强
通入某恒压(压强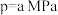 )密闭容器中,在不同温度下测得
)密闭容器中,在不同温度下测得 的平衡转化率如图所示。
的平衡转化率如图所示。
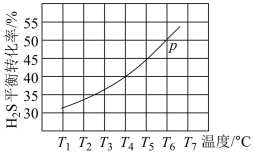
已知:对于气相反应,用某组分(B)的平衡压强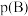 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数。温度为
也可表示平衡常数。温度为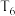 ℃时,该反应的平衡常数
℃时,该反应的平衡常数
___________  (用a的代数式表示)。
(用a的代数式表示)。
(1)工业生产中可利用
 还原
还原 制备清洁能源甲醇。
制备清洁能源甲醇。①已知
 和
和 的燃烧热(
的燃烧热( )分别为
)分别为 、
、 。
。 与
与 合成甲醇的能量变化如图甲所示,则用
合成甲醇的能量变化如图甲所示,则用 和
和 制备甲醇和液态水的热化学方程式为
制备甲醇和液态水的热化学方程式为
②将一定量的
 和
和 充入某恒容密闭容器中,测得在不同催化剂作用下,相同时间内
充入某恒容密闭容器中,测得在不同催化剂作用下,相同时间内 的转化率与温度的变化如图乙所示,催化效果最好的是催化剂
的转化率与温度的变化如图乙所示,催化效果最好的是催化剂
(2)利用
 和水蒸气可生产
和水蒸气可生产 ,反应的化学方程式为
,反应的化学方程式为 。将不同量的
。将不同量的 和
和 分别通入体积为2L的恒容密闭容器中进行上述反应,得到数据如下表所示
分别通入体积为2L的恒容密闭容器中进行上述反应,得到数据如下表所示| 温度/℃ | 起始量 | 达到平衡 | |||
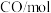 | 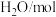 | 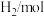 |  转化率 转化率 | 时间/min | |
| 650 | 4 | 2 | 1.6 | 6 | |
| 900 | 3 | 2 |  | 3 | |
②900℃时,从开始到达到平衡时的反应速率
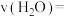
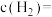
(3)利用废弃的
 的热分解可生产
的热分解可生产 :
: 。现将
。现将 通入某恒压(压强
通入某恒压(压强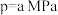 )密闭容器中,在不同温度下测得
)密闭容器中,在不同温度下测得 的平衡转化率如图所示。
的平衡转化率如图所示。
已知:对于气相反应,用某组分(B)的平衡压强
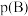 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数。温度为
也可表示平衡常数。温度为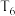 ℃时,该反应的平衡常数
℃时,该反应的平衡常数
 (用a的代数式表示)。
(用a的代数式表示)。
您最近一年使用:0次
2022-09-01更新
|
142次组卷
|
2卷引用:湖北省宜城一中、枣阳一中等六校联考2022-2023学年高二上学期期中考试化学试题
7 . I.习总书记曾提出“绿水青山就是金山银山”的科学论断,研究二氧化碳的资源化利用具有重要的意义。请回答下列问题:
(1)已知下列热化学方程式:
①
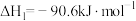
②
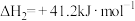
则CO2与H2反应生成甲醇气体和水蒸气的热化学方程式为:_______ 。
(2)一定温度和压强为1MPa条件下,将 和
和 按物质的量之比为1∶4通入容积可变的密闭容器中发生反应,假设只发生反应:
按物质的量之比为1∶4通入容积可变的密闭容器中发生反应,假设只发生反应:
a. ;
;
b. ;
;
10min两个反应均达到平衡时,CO2平衡转化率为60%,CH4选择性为50%,[CH4的选择性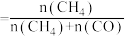 ]。该温度下,反应b的Kp=
]。该温度下,反应b的Kp=_______ (保留两位有效数字),已知Kp是用反应体系中气体物质的分压来表示的平衡常数,气体分压=总压×气体物质的量分数),用CH4的分压变化表示反应a在10分钟内达到平衡的平均速率为_______  (保留两位有效数字)。
(保留两位有效数字)。
II.燃煤排放的烟气含有和NOx,形成酸雨、污染大气。采用化学吸收剂对烟气进行脱硫、脱硝,对环境保护有着重要的意义。回答下列问题:
(3)在不同温度下, 溶液脱硫、脱硝的反应中,
溶液脱硫、脱硝的反应中, 和NO的平衡分压
和NO的平衡分压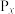 如图所示。
如图所示。
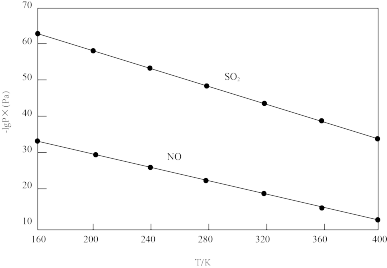
由图分析可知。反应温度升高,脱硫、脱硝反应的平衡常数均_______ (填“增大”“不变”或“减小”)。原因可能是_______ (写出一条原因即可)。
(4)以连二亚硫酸根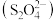 为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
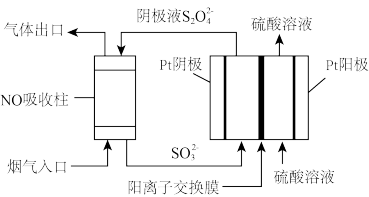
①阴极区的电极反应式为_______ 。
②NO吸收转化后的主要产物为N2,若通电时电路中转移了0.5mole—,则此通电过程中理论上吸收的NO在标准状况下的体积为_______ L。
(1)已知下列热化学方程式:
①

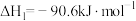
②

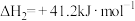
则CO2与H2反应生成甲醇气体和水蒸气的热化学方程式为:
(2)一定温度和压强为1MPa条件下,将
 和
和 按物质的量之比为1∶4通入容积可变的密闭容器中发生反应,假设只发生反应:
按物质的量之比为1∶4通入容积可变的密闭容器中发生反应,假设只发生反应:a.
 ;
;b.
 ;
;10min两个反应均达到平衡时,CO2平衡转化率为60%,CH4选择性为50%,[CH4的选择性
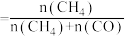 ]。该温度下,反应b的Kp=
]。该温度下,反应b的Kp= (保留两位有效数字)。
(保留两位有效数字)。II.燃煤排放的烟气含有和NOx,形成酸雨、污染大气。采用化学吸收剂对烟气进行脱硫、脱硝,对环境保护有着重要的意义。回答下列问题:
(3)在不同温度下,
 溶液脱硫、脱硝的反应中,
溶液脱硫、脱硝的反应中, 和NO的平衡分压
和NO的平衡分压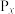 如图所示。
如图所示。
由图分析可知。反应温度升高,脱硫、脱硝反应的平衡常数均
(4)以连二亚硫酸根
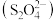 为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
①阴极区的电极反应式为
②NO吸收转化后的主要产物为N2,若通电时电路中转移了0.5mole—,则此通电过程中理论上吸收的NO在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
8 . 研究氮及其化合物的应用对治理大气污染、建设生态文明具有重要意义。回答下列问题:
(1)已知 与CO反应生成无污染气体:
与CO反应生成无污染气体: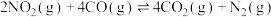

ⅰ.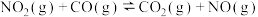
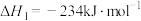
ⅱ.
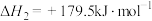
ⅲ.
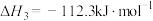
①
_______  ,反应ⅲ在
,反应ⅲ在_______ (填“高温”“低温”或“任何条件”)能自发进行。
②下列可判断反应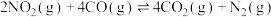 达到平衡的是
达到平衡的是_______ (填字母)。
A.混合气体的平均相对分子质量不变 B.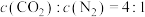
C. 的质量保持不变 D.
的质量保持不变 D.
(2)反应
 的净速率:
的净速率: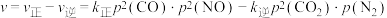 ,其中
,其中 、
、 分别为正、逆反应的速率常数(只与温度有关),p为气体的分压(分压=总压×物质的量分数)。
分别为正、逆反应的速率常数(只与温度有关),p为气体的分压(分压=总压×物质的量分数)。
①升高温度,
_______ (填“增大”“减小”或“不变”)。
②在压强为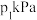 ,温度为T K的体系中,投料比
,温度为T K的体系中,投料比 时,CO的平衡转化率为80%,则当体系中
时,CO的平衡转化率为80%,则当体系中 的体积分数为
的体积分数为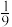 时,
时,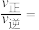
_______ 。
③反应在不同催化剂甲、乙条件下,NO的脱氮率在相同时间内随温度的变化如图1所示。在工业生产中应选用_______ 催化剂(填“甲”或“乙”),理由是_______ 。

(3)工业上,常温下将含 的尾气与
的尾气与 的混合气体通入
的混合气体通入 与
与 的混合溶液中进行无害化处理,原理如图2所示。该吸收过程中,
的混合溶液中进行无害化处理,原理如图2所示。该吸收过程中,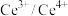 的作用是
的作用是_______ ,其中反应Ⅱ的离子方程式为_______ 。

(1)已知
 与CO反应生成无污染气体:
与CO反应生成无污染气体: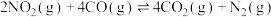

ⅰ.
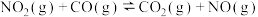
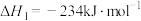
ⅱ.

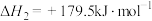
ⅲ.

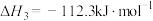
①

 ,反应ⅲ在
,反应ⅲ在②下列可判断反应
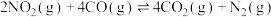 达到平衡的是
达到平衡的是A.混合气体的平均相对分子质量不变 B.
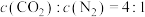
C.
 的质量保持不变 D.
的质量保持不变 D.
(2)反应

 的净速率:
的净速率: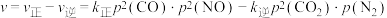 ,其中
,其中 、
、 分别为正、逆反应的速率常数(只与温度有关),p为气体的分压(分压=总压×物质的量分数)。
分别为正、逆反应的速率常数(只与温度有关),p为气体的分压(分压=总压×物质的量分数)。①升高温度,

②在压强为
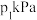 ,温度为T K的体系中,投料比
,温度为T K的体系中,投料比 时,CO的平衡转化率为80%,则当体系中
时,CO的平衡转化率为80%,则当体系中 的体积分数为
的体积分数为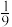 时,
时,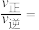
③反应在不同催化剂甲、乙条件下,NO的脱氮率在相同时间内随温度的变化如图1所示。在工业生产中应选用

(3)工业上,常温下将含
 的尾气与
的尾气与 的混合气体通入
的混合气体通入 与
与 的混合溶液中进行无害化处理,原理如图2所示。该吸收过程中,
的混合溶液中进行无害化处理,原理如图2所示。该吸收过程中,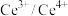 的作用是
的作用是
您最近一年使用:0次
2022-08-29更新
|
573次组卷
|
5卷引用:湖北九师联盟2023届高三上学期开学考试化学试题
9 . 尿素[CO(NH2)2]是首个由无机物人工合成的有机物。
(1)在尿素合成塔中发生的反应可表示为2NH3(g)+CO2(g)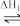 NH2COONH4(l)
NH2COONH4(l)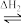 [CO(NH2)2](s)+H2O(g);已知第一步反应为快速反应,△H1=-119.2kJ·mol-1,第二步反应为慢速反应,△H2=+15.5kJ·mol-1,则2NH3(g)+CO2(g)
[CO(NH2)2](s)+H2O(g);已知第一步反应为快速反应,△H1=-119.2kJ·mol-1,第二步反应为慢速反应,△H2=+15.5kJ·mol-1,则2NH3(g)+CO2(g) [CO(NH2)2](s)+H2O(g) △H3=
[CO(NH2)2](s)+H2O(g) △H3=_____ kJ·mol-1,下列图象能表示尿素合成塔中发生反应的能量变化历程的是_____ (填标号)。
A.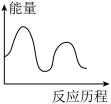 B.
B. C.
C. D.
D.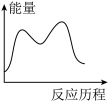
(2)T℃,在2L的密闭容器中,通入2molNH3和1molCO2,保持体积不变,发生反应2NH3(g)+CO2(g) [CO(NH2)2](s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
[CO(NH2)2](s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
①NH3的平衡转化率为_____ 。
②能说明上述反应达到平衡状态的是_____ (填标号)。
A.n(CO2):n(NH3)=1:2
B.混合气体的密度不再发生变化
C.单位时间内消耗2molNH3,同时生成1molH2O
D.CO2的体积分数在混合气体中保持不变
(3)一定温度下,某恒容密闭容器中发生反应2NH3(g)+CO2(g) [CO(NH2)2](s)+H2O(g),若原料气中
[CO(NH2)2](s)+H2O(g),若原料气中 =m,测得m与CO2的平衡转化率(α)的关系如图甲所示。
=m,测得m与CO2的平衡转化率(α)的关系如图甲所示。
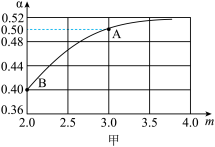
①若平衡时A点容器内总压强为0.5MPa,则上述反应的平衡常数Kp=____ (MPa)2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②若平衡时A、B对应容器的压强相等,则A、B对应的容器中,起始时投入氨气的物质的量之比nA(NH3):nB(NH3)=____ 。
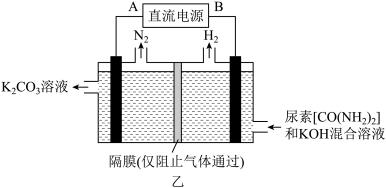
(4)用惰性电极电解尿素[CO(NH2)2]的碱性溶液可制取氢气,装置如图乙所示,则B为直流电源的____ 极,写出该装置阳极的电极反应式:_____ 。
(1)在尿素合成塔中发生的反应可表示为2NH3(g)+CO2(g)
 NH2COONH4(l)
NH2COONH4(l) [CO(NH2)2](s)+H2O(g);已知第一步反应为快速反应,△H1=-119.2kJ·mol-1,第二步反应为慢速反应,△H2=+15.5kJ·mol-1,则2NH3(g)+CO2(g)
[CO(NH2)2](s)+H2O(g);已知第一步反应为快速反应,△H1=-119.2kJ·mol-1,第二步反应为慢速反应,△H2=+15.5kJ·mol-1,则2NH3(g)+CO2(g) [CO(NH2)2](s)+H2O(g) △H3=
[CO(NH2)2](s)+H2O(g) △H3=A.
 B.
B. C.
C. D.
D.
(2)T℃,在2L的密闭容器中,通入2molNH3和1molCO2,保持体积不变,发生反应2NH3(g)+CO2(g)
 [CO(NH2)2](s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
[CO(NH2)2](s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:①NH3的平衡转化率为
②能说明上述反应达到平衡状态的是
A.n(CO2):n(NH3)=1:2
B.混合气体的密度不再发生变化
C.单位时间内消耗2molNH3,同时生成1molH2O
D.CO2的体积分数在混合气体中保持不变
(3)一定温度下,某恒容密闭容器中发生反应2NH3(g)+CO2(g)
 [CO(NH2)2](s)+H2O(g),若原料气中
[CO(NH2)2](s)+H2O(g),若原料气中 =m,测得m与CO2的平衡转化率(α)的关系如图甲所示。
=m,测得m与CO2的平衡转化率(α)的关系如图甲所示。
①若平衡时A点容器内总压强为0.5MPa,则上述反应的平衡常数Kp=
②若平衡时A、B对应容器的压强相等,则A、B对应的容器中,起始时投入氨气的物质的量之比nA(NH3):nB(NH3)=
(4)用惰性电极电解尿素[CO(NH2)2]的碱性溶液可制取氢气,装置如图乙所示,则B为直流电源的

您最近一年使用:0次
2022-08-27更新
|
978次组卷
|
3卷引用:武汉市第六中学2022-2023学年高二上学期第二次月考化学试题
解题方法
10 . 煤制天然气工艺是煤高效洁净利用的新途径之一,其生产流程简图如下所示:

(1)“煤气化”涉及反应: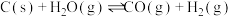
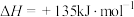 ,通常该步骤中要通入适量氧气。请利用能量转化及平衡移动原理说明通入氧气的主要作用:
,通常该步骤中要通入适量氧气。请利用能量转化及平衡移动原理说明通入氧气的主要作用:_______ 。
(2)“水气变换"涉及的反应如下:
反应Ⅰ: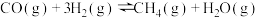

反应Ⅱ:
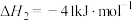
反应Ⅲ:

①
_______  ,反应Ⅲ在什么温度下能自发进行
,反应Ⅲ在什么温度下能自发进行_______ (填“高温”或“低温”)。
②下图是计算机模拟出反应Ⅱ的反应历程,吸附在催化剂表面的物种用“*”标注。

在反应过程中,能量变化相同的过程是_______ 和_______ ,原因是_______ 。
③向一定温度下的2L刚性容器中充入1molCO和3mol ,5min后体系达到平衡状态,此时容器中含有0.4mol
,5min后体系达到平衡状态,此时容器中含有0.4mol 和0.3mol
和0.3mol ,则5min时,
,则5min时, 的浓度是
的浓度是_______ mol/L,反应Ⅲ的平衡常数K为_______ (列计算式);可通过_______ 方法(任写一种)提高CO和 的平衡转化率。
的平衡转化率。
(3)“酸气脱除”分别除掉的是 和
和_______ 气体。
(4)“甲烷化”的一种电化学方法装置如下图所示,理论上每生成0.15mol ,阳极室生成
,阳极室生成 的体积是
的体积是_______ L(标准状况下)。


(1)“煤气化”涉及反应:
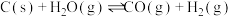
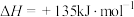 ,通常该步骤中要通入适量氧气。请利用能量转化及平衡移动原理说明通入氧气的主要作用:
,通常该步骤中要通入适量氧气。请利用能量转化及平衡移动原理说明通入氧气的主要作用:(2)“水气变换"涉及的反应如下:
反应Ⅰ:
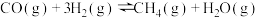

反应Ⅱ:

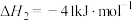
反应Ⅲ:


①

 ,反应Ⅲ在什么温度下能自发进行
,反应Ⅲ在什么温度下能自发进行②下图是计算机模拟出反应Ⅱ的反应历程,吸附在催化剂表面的物种用“*”标注。

在反应过程中,能量变化相同的过程是
③向一定温度下的2L刚性容器中充入1molCO和3mol
 ,5min后体系达到平衡状态,此时容器中含有0.4mol
,5min后体系达到平衡状态,此时容器中含有0.4mol 和0.3mol
和0.3mol ,则5min时,
,则5min时, 的浓度是
的浓度是 的平衡转化率。
的平衡转化率。(3)“酸气脱除”分别除掉的是
 和
和(4)“甲烷化”的一种电化学方法装置如下图所示,理论上每生成0.15mol
 ,阳极室生成
,阳极室生成 的体积是
的体积是
您最近一年使用:0次



