河北省石家庄精英中学2022-2023高三上学期开学考试化学试题
河北
高三
开学考试
2022-10-17
252次
整体难度:
适中
考查范围:
认识化学科学、有机化学基础、化学与STSE、化学反应原理、物质结构与性质、常见无机物及其应用、化学实验基础
河北省石家庄精英中学2022-2023高三上学期开学考试化学试题
河北
高三
开学考试
2022-10-17
252次
整体难度:
适中
考查范围:
认识化学科学、有机化学基础、化学与STSE、化学反应原理、物质结构与性质、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
解题方法
您最近一年使用:0次
2022-08-27更新
|
198次组卷
|
2卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
单选题
|
较易(0.85)
名校
2. 某有机化合物X的结构如图所示。下列说法正确的是
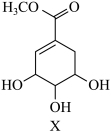

| A.X存在芳香族同分异构体 | B.X分子中有3种官能团 |
| C.1mol X最多能与4mol NaOH反应 | D.X不能与溴水反应 |
您最近一年使用:0次
2022-08-27更新
|
511次组卷
|
5卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
河北省九师联盟2022-2023学年高三上学期开学考试化学试题湖北九师联盟2023届高三上学期开学考试化学试题河北省石家庄精英中学2022-2023高三上学期开学考试化学试题(已下线)化学(全国甲卷理综A卷)-学易金卷:2023年高考第一次模拟考试卷四川省内江市第二中学2023-2024学年高三上学期12月月考理综试题
单选题
|
较易(0.85)
名校
3. 化学与生产、生活密切相关。下列说法正确的是
| A.抗坏血酸(VC)能抗氧化,可做食品添加剂 |
| B.为减少对生态环境的危害,农业生产中应禁止使用农药 |
| C.天然有机物都是绿色健康的,人工合成有机物均有潜在的危害性 |
| D.将阿司匹林连在高分子载体上制成缓释剂,用药安全性提高,可以大量口服使用 |
您最近一年使用:0次
2022-08-27更新
|
194次组卷
|
3卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
单选题
|
适中(0.65)
名校
解题方法
4. 下列各组离子在给定溶液中一定能大量共存的是
A.在 氨水中: 氨水中: 、 、 、 、 、 、 |
B.在 氯化钠溶液中: 氯化钠溶液中: 、 、 、 、 、 、 |
C.在 醋酸钠溶液中: 醋酸钠溶液中: 、 、 、 、 、 、 |
D.25℃时,由水电离出的 的溶液中: 的溶液中: 、 、 、 、 、 、 |
【知识点】 限定条件下的离子共存解读
您最近一年使用:0次
2022-08-27更新
|
326次组卷
|
5卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
单选题
|
容易(0.94)
名校
5. 化学物质与生命过程密切相关。下列说法错误的是
| A.核酸的水解产物为核苷酸 | B.人体中大多数酶的主要成分为蛋白质 |
| C.油脂属于有机高分子化合物 | D.淀粉和纤维素水解的最终产物均为葡萄糖 |
您最近一年使用:0次
2022-08-27更新
|
160次组卷
|
3卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
单选题
|
较易(0.85)
名校
6. 利用下列装置能达到实验目的的是
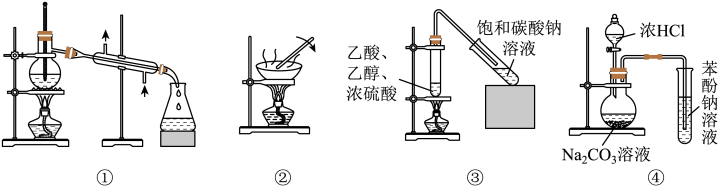

| A.利用装置①分离乙醇和乙酸的混合物 | B.利用装置②由氯化铁溶液制备无水氯化铁 |
| C.利用装置③制备和收集乙酸乙酯 | D.利用装置④验证酸性:盐酸>碳酸>苯酚 |
您最近一年使用:0次
2022-08-27更新
|
337次组卷
|
3卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
7. 下列说法正确的是
| A.原子的第一电离能越大,则该元素的非金属性越强 |
B.基态S原子的核外电子排布式写成 违背了泡利原理 违背了泡利原理 |
| C.同一原子中,1s、2s、3s能级上的电子能量逐渐减小 |
| D.随着核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的 |
【知识点】 能级间能量大小比较解读 基态核外电子排布规律 电离能
您最近一年使用:0次
2022-08-27更新
|
183次组卷
|
3卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
单选题
|
较难(0.4)
名校
解题方法
8. 氨氮废水可用电化学催化氧化法加以处理, 在某电极表面的氧化过程的微观示意图如下(另一电极上通入
在某电极表面的氧化过程的微观示意图如下(另一电极上通入 )。下列说法不正确的是
)。下列说法不正确的是

 在某电极表面的氧化过程的微观示意图如下(另一电极上通入
在某电极表面的氧化过程的微观示意图如下(另一电极上通入 )。下列说法不正确的是
)。下列说法不正确的是
A.该催化氧化法的总反应为 |
B.参与上述氧化过程的10电子微粒有: 、 、 、 、 、 、 、 、 |
| C.过程①~③中有极性键断裂,过程④中存在非极性键形成 |
| D.使用该方法处理氨氮废水时,两个电极材料不可能均为铁 |
【知识点】 原电池
您最近一年使用:0次
2022-08-27更新
|
474次组卷
|
4卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
单选题
|
较难(0.4)
名校
解题方法
9. 常温下,将一定量稀硫酸滴入高铁酸钠 溶液中,溶液中含铁微粒
溶液中,溶液中含铁微粒 、
、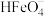 、
、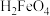 、
、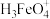 的物质的量分数
的物质的量分数 随pOH的变化如图[
随pOH的变化如图[ ,
, ]。下列说法正确的是
]。下列说法正确的是

 溶液中,溶液中含铁微粒
溶液中,溶液中含铁微粒 、
、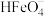 、
、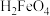 、
、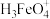 的物质的量分数
的物质的量分数 随pOH的变化如图[
随pOH的变化如图[ ,
, ]。下列说法正确的是
]。下列说法正确的是
A.曲线Ⅰ表示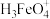 的变化曲线 的变化曲线 |
| B.a、b、c三点水的电离程度相等 |
C.25℃时, 的平衡常数 的平衡常数 |
D.25℃时, 的溶液中存在: 的溶液中存在: |
【知识点】 盐类水解规律
您最近一年使用:0次
2022-08-27更新
|
606次组卷
|
7卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
解题方法
10. 处于相同短周期的主族元素原子W、X、Y、Z构成的一种阴离子如图所示,X的基态原子核外3个能级上有电子,且每个能级上的电子数相等,Y原子的最外层电子数等于内层电子数的3倍,四种原子最外层电子数之和为20。下列说法正确的是


| A.第一电离能:Z>Y>X>W |
| B.X的氢化物的熔沸点一定小于Y的 |
| C.最高价氧化物对应水化物的酸性:W<X |
D.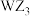 分子中各原子均满足8电子稳定结构 分子中各原子均满足8电子稳定结构 |
【知识点】 元素周期律、元素周期表的推断 电离能变化规律解读
您最近一年使用:0次
2022-08-27更新
|
284次组卷
|
2卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
三、单选题 添加题型下试题
11. 钛酸钙矿物的晶胞结构如图(a)所示,某钙钛矿型太阳能光伏电池的有机半导材料的结构如图(b)所示,其中A为 ,另两种离子为
,另两种离子为 和
和 。下列说法错误的是
。下列说法错误的是

 ,另两种离子为
,另两种离子为 和
和 。下列说法错误的是
。下列说法错误的是
A.钛酸钙晶体中距离 最近的 最近的 有8个 有8个 |
B.图(b)中,X为 |
| C.电负性:O>N>C |
D.钛酸钙晶胞中距离 最近的 最近的 形成了正八面体, 形成了正八面体, 位于其中心 位于其中心 |
【知识点】 元素性质与电负性的关系解读 晶胞
您最近一年使用:0次
2022-08-27更新
|
297次组卷
|
8卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
四、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
解题方法
12. 如图所示是一种可实现氢气循环利用的新型电池的放电工作原理。下列说法正确的是
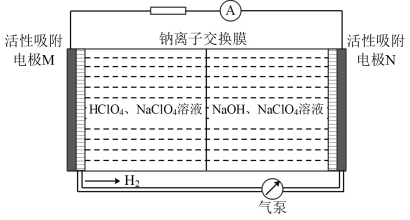

| A.放电时,M电极的电势高于N电极 |
B.充电过程中 由右池通过交换膜向左池移动 由右池通过交换膜向左池移动 |
C.放电时,N极电极反应式为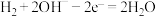 |
| D.若用铅蓄电池作为电源充电,M电极连接铅蓄电池的铅电极 |
您最近一年使用:0次
2022-08-27更新
|
168次组卷
|
2卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
五、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
13. 下列实验操作、现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向铜与浓硫酸反应后的溶液中加入适量水稀释 | 溶液呈蓝色 | 溶液中存在 |
| B | 取铁粉与水蒸气反应后的固体溶于足量盐酸,滴加KSCN溶液 | 溶液不显血红色 | 固体中铁元素均为二价铁 |
| C | 取少量无色溶液于试管中,依次加入氯化钡、硝酸溶液 | 有白色沉淀生成,加入硝酸不溶解 | 溶液中含有 |
| D | 两块相同的未经打磨的铝片,相同温度下分别投入到5.0mL等浓度的 溶液和 溶液和 溶液中 溶液中 | 前者无明显现象,后者铝片溶解 |  能加速破坏铝片表面的氧化膜 能加速破坏铝片表面的氧化膜 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-08-27更新
|
283次组卷
|
4卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
六、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
14. 实验室制备乙酰乙酸乙酯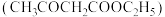 的反应原理为
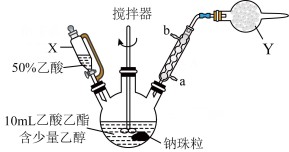
的反应原理为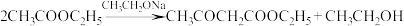 ,制备装置(烧瓶中物质充分反应后再滴加乙酸溶液)如下图所示:
,制备装置(烧瓶中物质充分反应后再滴加乙酸溶液)如下图所示:
已知:①几种物质的部分性质:
②10mL乙酸乙酯粗品中含乙酸乙酯8.8g和少量乙醇;
③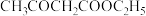 亚甲基上的H有一定的酸性,制备时部分形成乙酰乙酸乙酯的钠盐。
亚甲基上的H有一定的酸性,制备时部分形成乙酰乙酸乙酯的钠盐。
回答下列问题:
(1)仪器X的名称是_______ ,冷凝水从_______ (填“a”或“b”)端流进。
(2)制备反应需要加热才能发生,最适合的加热方式为_______(填字母)。
(3)装置Y盛放碱石灰的作用是_______ 。
(4)反应结束后,滴加50%乙酸至混合液呈弱酸性的原因是_______ 。
(5)提纯产品时需要进行蒸馏,下列装置中温度计位置正确的是_______(填字母)。
(6)最终得到乙酰乙酸乙酯3.43g,则上述实验中乙酰乙酸乙酯的产率为_______ (保留两位有效数字)。
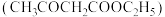 的反应原理为
的反应原理为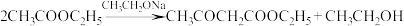 ,制备装置(烧瓶中物质充分反应后再滴加乙酸溶液)如下图所示:
,制备装置(烧瓶中物质充分反应后再滴加乙酸溶液)如下图所示:
已知:①几种物质的部分性质:
| 物质 | 沸点/℃ | 相对分子质量 | 水中溶解性 |
| 乙酸乙酯 | 77.2 | 88 | 微溶 |
| 乙酰乙酸乙酯 | 181(温度超过95℃,易分解) | 130 | 微溶 |
| 乙酸 | 118 | 60 | 易溶 |
③
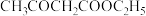 亚甲基上的H有一定的酸性,制备时部分形成乙酰乙酸乙酯的钠盐。
亚甲基上的H有一定的酸性,制备时部分形成乙酰乙酸乙酯的钠盐。回答下列问题:
(1)仪器X的名称是
(2)制备反应需要加热才能发生,最适合的加热方式为_______(填字母)。
| A.酒精灯直接加热 | B.水浴加热 |
| C.垫石棉网用酒精灯加热 | D.油浴加热 |
(4)反应结束后,滴加50%乙酸至混合液呈弱酸性的原因是
(5)提纯产品时需要进行蒸馏,下列装置中温度计位置正确的是_______(填字母)。
A. | B. | C. | D.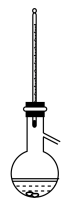 |
您最近一年使用:0次
2022-08-27更新
|
517次组卷
|
3卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
解答题-工业流程题
|
适中(0.65)
名校
解题方法
15. 实验室以含锌废液(主要成分为 ,及少量的
,及少量的 、
、 )为原料制备碱式碳酸锌
)为原料制备碱式碳酸锌 的实验流程如下:
的实验流程如下:

回答下列问题:
(1)已知 中含有1个过氧键(—O—O—),则其中硫元素的化合价为
中含有1个过氧键(—O—O—),则其中硫元素的化合价为_______ ,“氧化除锰”操作中生成 和
和 的离子方程式为
的离子方程式为_______ 。
(2)验证加入“试剂X”之前的溶液中不含 的实验方案是
的实验方案是_______ 。
(3)为提高碱式碳酸锌的产量,试剂X可以选择_______ ;常温下,调节溶液的pH,使溶液中铁元素完全沉淀,则理论上pH的最小值为_______ {当溶液中某离子浓度c小于等于 时,可认为该离子沉淀完全;常温下,
时,可认为该离子沉淀完全;常温下,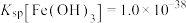 }。
}。
(4)“沉锌”操作中发生反应的离子方程式为_______ 。
(5)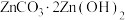 可用于制备
可用于制备 晶体,具体操作为将
晶体,具体操作为将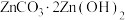 溶于足量稀硫酸,
溶于足量稀硫酸,_______ ,洗涤、低温干燥,即可得到 晶体。
晶体。
 ,及少量的
,及少量的 、
、 )为原料制备碱式碳酸锌
)为原料制备碱式碳酸锌 的实验流程如下:
的实验流程如下:
回答下列问题:
(1)已知
 中含有1个过氧键(—O—O—),则其中硫元素的化合价为
中含有1个过氧键(—O—O—),则其中硫元素的化合价为 和
和 的离子方程式为
的离子方程式为(2)验证加入“试剂X”之前的溶液中不含
 的实验方案是
的实验方案是(3)为提高碱式碳酸锌的产量,试剂X可以选择
 时,可认为该离子沉淀完全;常温下,
时,可认为该离子沉淀完全;常温下,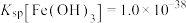 }。
}。(4)“沉锌”操作中发生反应的离子方程式为
(5)
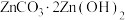 可用于制备
可用于制备 晶体,具体操作为将
晶体,具体操作为将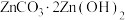 溶于足量稀硫酸,
溶于足量稀硫酸, 晶体。
晶体。
【知识点】 锌的化合物的制备
您最近一年使用:0次
2022-09-22更新
|
367次组卷
|
3卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
解答题-有机推断题
|
适中(0.65)
名校
16. 化合物H是合成一种催眠药物的中间体,合成路线如下图所示:

回答下列问题:
(1)A的名称为_______ ,A→B的反应条件为_______ 。
(2)H的分子式为_______ ,化合物C的结构简式为_______ 。
(3)G→H的反应类型为_______ 。
(4)反应F→G的化学方程式为_______ 。
(5)F的同系物 有多种同分异构体,其中属于芳香族化合物且分子内只有两种不同环境的氢的结构简式为
有多种同分异构体,其中属于芳香族化合物且分子内只有两种不同环境的氢的结构简式为_______ (任写一种)。
(6)设计以乙醇为原料制备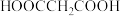 的合成路线流程图:
的合成路线流程图:_______ (无机试剂和有机溶剂任选)。

回答下列问题:
(1)A的名称为
(2)H的分子式为
(3)G→H的反应类型为
(4)反应F→G的化学方程式为
(5)F的同系物
 有多种同分异构体,其中属于芳香族化合物且分子内只有两种不同环境的氢的结构简式为
有多种同分异构体,其中属于芳香族化合物且分子内只有两种不同环境的氢的结构简式为(6)设计以乙醇为原料制备
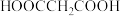 的合成路线流程图:
的合成路线流程图:
您最近一年使用:0次
2022-08-27更新
|
273次组卷
|
4卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
解答题-原理综合题
|
较难(0.4)
名校
解题方法
17. 研究氮及其化合物的应用对治理大气污染、建设生态文明具有重要意义。回答下列问题:
(1)已知 与CO反应生成无污染气体:
与CO反应生成无污染气体: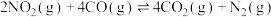

ⅰ.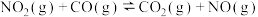
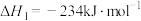
ⅱ.
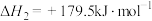
ⅲ.
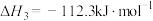
①
_______  ,反应ⅲ在
,反应ⅲ在_______ (填“高温”“低温”或“任何条件”)能自发进行。
②下列可判断反应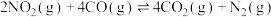 达到平衡的是
达到平衡的是_______ (填字母)。
A.混合气体的平均相对分子质量不变 B.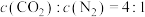
C. 的质量保持不变 D.
的质量保持不变 D.
(2)反应
 的净速率:
的净速率: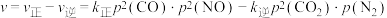 ,其中
,其中 、
、 分别为正、逆反应的速率常数(只与温度有关),p为气体的分压(分压=总压×物质的量分数)。
分别为正、逆反应的速率常数(只与温度有关),p为气体的分压(分压=总压×物质的量分数)。
①升高温度,
_______ (填“增大”“减小”或“不变”)。
②在压强为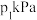 ,温度为T K的体系中,投料比
,温度为T K的体系中,投料比 时,CO的平衡转化率为80%,则当体系中
时,CO的平衡转化率为80%,则当体系中 的体积分数为
的体积分数为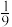 时,
时,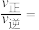
_______ 。
③反应在不同催化剂甲、乙条件下,NO的脱氮率在相同时间内随温度的变化如图1所示。在工业生产中应选用_______ 催化剂(填“甲”或“乙”),理由是_______ 。

(3)工业上,常温下将含 的尾气与
的尾气与 的混合气体通入
的混合气体通入 与
与 的混合溶液中进行无害化处理,原理如图2所示。该吸收过程中,
的混合溶液中进行无害化处理,原理如图2所示。该吸收过程中,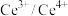 的作用是
的作用是_______ ,其中反应Ⅱ的离子方程式为_______ 。

(1)已知
 与CO反应生成无污染气体:
与CO反应生成无污染气体: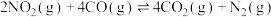

ⅰ.
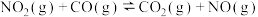
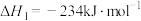
ⅱ.

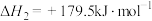
ⅲ.

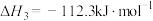
①

 ,反应ⅲ在
,反应ⅲ在②下列可判断反应
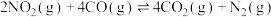 达到平衡的是
达到平衡的是A.混合气体的平均相对分子质量不变 B.
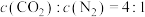
C.
 的质量保持不变 D.
的质量保持不变 D.
(2)反应

 的净速率:
的净速率: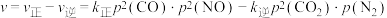 ,其中
,其中 、
、 分别为正、逆反应的速率常数(只与温度有关),p为气体的分压(分压=总压×物质的量分数)。
分别为正、逆反应的速率常数(只与温度有关),p为气体的分压(分压=总压×物质的量分数)。①升高温度,

②在压强为
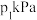 ,温度为T K的体系中,投料比
,温度为T K的体系中,投料比 时,CO的平衡转化率为80%,则当体系中
时,CO的平衡转化率为80%,则当体系中 的体积分数为
的体积分数为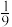 时,
时,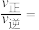
③反应在不同催化剂甲、乙条件下,NO的脱氮率在相同时间内随温度的变化如图1所示。在工业生产中应选用

(3)工业上,常温下将含
 的尾气与
的尾气与 的混合气体通入
的混合气体通入 与
与 的混合溶液中进行无害化处理,原理如图2所示。该吸收过程中,
的混合溶液中进行无害化处理,原理如图2所示。该吸收过程中,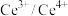 的作用是
的作用是
您最近一年使用:0次
2022-08-29更新
|
571次组卷
|
5卷引用:河北省九师联盟2022-2023学年高三上学期开学考试化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、有机化学基础、化学与STSE、化学反应原理、物质结构与性质、常见无机物及其应用、化学实验基础
试卷题型(共 17题)
题型
数量
单选题
11
多选题
2
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 物理变化与化学变化 | |
| 2 | 0.85 | 常见官能团名称、组成及结构 含碳碳双键物质的性质的推断 含酯基有机物水解消耗NaOH的量的计算 多官能团有机物的结构与性质 | |
| 3 | 0.85 | 化学科学对人类文明发展的意义 食品添加剂 药物的合理使用 水污染 | |
| 4 | 0.65 | 限定条件下的离子共存 | |
| 5 | 0.94 | 油脂 淀粉、纤维素的水解 酶 核酸 | |
| 6 | 0.85 | 盐类水解的应用 有机物蒸馏 苯酚的弱酸性 乙酸乙酯制备实验的装置及操作 | |
| 7 | 0.85 | 能级间能量大小比较 基态核外电子排布规律 电离能 | |
| 8 | 0.4 | 原电池 | |
| 9 | 0.4 | 盐类水解规律 | |
| 11 | 0.65 | 元素性质与电负性的关系 晶胞 | |
| 13 | 0.65 | 浓硫酸的强氧化性 硫酸根离子的检验 氧化铝 铁盐的检验 | |
| 二、多选题 | |||
| 10 | 0.65 | 元素周期律、元素周期表的推断 电离能变化规律 | |
| 12 | 0.65 | 原电池原理理解 原电池电极反应式书写 二次电池 铅蓄电池 | |
| 三、解答题 | |||
| 14 | 0.65 | 常见有机物的制备 | 实验探究题 |
| 15 | 0.65 | 锌的化合物的制备 | 工业流程题 |
| 16 | 0.65 | 根据要求书写同分异构体 羧酸酯化反应 有机推断综合考查 | 有机推断题 |
| 17 | 0.4 | 化学反应原理综合考查 盖斯定律及其有关计算 化学平衡的有关计算 化学平衡图像分析 | 原理综合题 |

 治疗胃酸过多症
治疗胃酸过多症

