环境保护是当今社会的热门问题,而氮的氧化物是大气污染的主要物质,研究氮的氧化物的反应对于减少污染有重要意义。请根据所学化学知识回答下列问题:
(1)汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成N2,可有效降低汽车尾气污染。已知:
N2(g)+O2(g) 2NO(g) △H=+180.5 kJ·mol-1
2NO(g) △H=+180.5 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221.0 kJ·mol-1
2CO(g) △H=-221.0 kJ·mol-1
则尾气转化反应2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=___________ kJ·mol-1
(2)向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
①下列事实能说明反应达平衡状态的是___________ (填序号)
A.容器内气体的压强不变
B.容器内气体的密度不变
C.容器内气体的平均相对分子质量不变
②计算此温度下,该反应的平衡常数K=___________ L·mol-1。
③保持温度和容积不变,向平衡体系中再充入NO和N2,使二者浓度均增加至原来的两倍,此时平衡移动___________ (填“向正反应方向”“向逆反应方向”或“不”)。
④实验测得,v正=k正・c2(NO)・c2(CO),v逆=k逆•c2(N2)·c (CO2)、(k正、k逆为速率常数,只与温度有关)。达到平衡后,仅升高温度,k正增大的倍数___________ (填“>”“<”或“=")k逆增大的倍数。
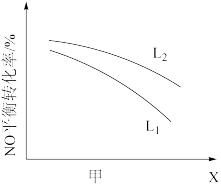
⑤L、X可分别代表压强或温度。图甲表示L一定时,NO(g)的平衡转化率随X的变化关系,则X代表___________ 。判断L1、L2的大小关系,并简述理由:___________
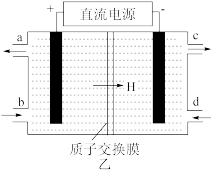
(3)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO 和NO
和NO 。可采用电解法将上述吸收液中的NO
。可采用电解法将上述吸收液中的NO 转化为无毒物质,同时再生Ce4+,其原理如图乙所示。写出阴极的电极反应式
转化为无毒物质,同时再生Ce4+,其原理如图乙所示。写出阴极的电极反应式___________ 。
(1)汽油燃油车上安装三元催化转化器,可以使CO和NO两种尾气反应生成N2,可有效降低汽车尾气污染。已知:
N2(g)+O2(g)
 2NO(g) △H=+180.5 kJ·mol-1
2NO(g) △H=+180.5 kJ·mol-1C(s)+O2(g)
 CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-12C(s)+O2(g)
 2CO(g) △H=-221.0 kJ·mol-1
2CO(g) △H=-221.0 kJ·mol-1则尾气转化反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=(2)向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(NO)/(10-3 mol·L-1) | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
| c(CO)/(10-3 mol·L-1) | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
①下列事实能说明反应达平衡状态的是
A.容器内气体的压强不变
B.容器内气体的密度不变
C.容器内气体的平均相对分子质量不变
②计算此温度下,该反应的平衡常数K=
③保持温度和容积不变,向平衡体系中再充入NO和N2,使二者浓度均增加至原来的两倍,此时平衡移动
④实验测得,v正=k正・c2(NO)・c2(CO),v逆=k逆•c2(N2)·c (CO2)、(k正、k逆为速率常数,只与温度有关)。达到平衡后,仅升高温度,k正增大的倍数
⑤L、X可分别代表压强或温度。图甲表示L一定时,NO(g)的平衡转化率随X的变化关系,则X代表


(3)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO
 和NO
和NO 。可采用电解法将上述吸收液中的NO
。可采用电解法将上述吸收液中的NO 转化为无毒物质,同时再生Ce4+,其原理如图乙所示。写出阴极的电极反应式
转化为无毒物质,同时再生Ce4+,其原理如图乙所示。写出阴极的电极反应式
更新时间:2022-09-09 16:22:00
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的摩尔燃烧焓△H1= - 2220 kJ/mol,正丁烷的摩尔燃烧焓△H2= -2878 kJ/ mol;异丁烷的摩尔燃烧焓△H3= -2869.6 kJ/mol。
①下列有关说法不正确的是_______________ (填标号)。
A 奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B 异丁烷分子中的碳氢键比正丁烷的多
C 正丁烷比异丁烷稳定
②已知1 mol H2燃烧生成液态水放出的热量是285. 8 kJ,现有6 mol由氢气和丙烷组成的混合气体,完全燃烧时放出的热量是3649 kJ,则该混合气体中氢气和丙烷的体积比为____ 。
(2)利用氢气可以制取工业原料乙酸。已知:
Ⅰ.CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH=-870.3 kJ·mol-1
Ⅱ.C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
Ⅲ.H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是______________ 。
②利用上述信息计算反应:2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=_________ kJ·mol-1。
(3)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应 A:4HCl+O2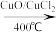 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.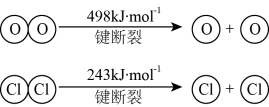
写出此条件下反应A的热化学方程式是_______________________________________ 。
①下列有关说法不正确的是
A 奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B 异丁烷分子中的碳氢键比正丁烷的多
C 正丁烷比异丁烷稳定
②已知1 mol H2燃烧生成液态水放出的热量是285. 8 kJ,现有6 mol由氢气和丙烷组成的混合气体,完全燃烧时放出的热量是3649 kJ,则该混合气体中氢气和丙烷的体积比为
(2)利用氢气可以制取工业原料乙酸。已知:
Ⅰ.CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH=-870.3 kJ·mol-1
Ⅱ.C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
Ⅲ.H2(g)+
 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是
②利用上述信息计算反应:2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=
(3)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应 A:4HCl+O2
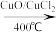 2Cl2+2H2O
2Cl2+2H2O已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

写出此条件下反应A的热化学方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】绿色能源是未来能源发展的方向,积极发展氢能,是实现“碳达峰、碳中和”的重要举措,可以用以下方法制备氢气。
Ⅰ.甲烷和水蒸气催化制氢气。主要反应如下:
i.CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH=+206.2kJ•mol-1
ii.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH=-41.2kJ•mol-1
(1)反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的 ΔH=___________ kJ•mol-1。
(2)在容积不变的绝热密闭容器中发生反应i,下列能说明反应达到平衡状态的是___________ (填标号)。
A.气体混合物的密度不再变化
B.CH4消耗速率和H2的生成速率相等
C.CO的浓度保持不变
D.气体平均相对分子质量不再变化
E.体系的温度不再发生变化
(3)恒定压强为P0MPa时,将n(CH4):n(H2O)=1:3的混合气体投入反应器中发生反应i和ii,平衡时,各组分的物质的量分数与温度的关系如图所示。
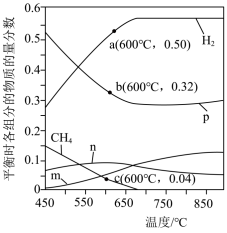
①图中表示CO2的物质的量分数与温度的变化曲线是___________ (填字母)。
②结合图中数据,其他条件不变,若要H2的产量最大,最适宜的反应温度是___________ (填标号)。
A.550~600℃ B.650~700℃ C.750~800℃
在其他条件不变的情况下,向体系中加入CaO可明显提高平衡体系中H2的含量,原因是________ 。
③600℃时,反应ii的平衡常数的计算式为Kp=___________ (Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。
Ⅱ.“氰化提金”产生的废水中含有一定量的 ,为处理含氰废水科研人员进行了大量研究。回答下列问题:
,为处理含氰废水科研人员进行了大量研究。回答下列问题:
(4)25℃,氢氰酸(HCN)、碳酸在水中的电离常数如下表:
①将少量 通入NaCN溶液中,反应的离子方程式是
通入NaCN溶液中,反应的离子方程式是___________ 。
②常温下,在 溶液中加入
溶液中加入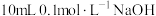 溶液。所得混合溶液中离子浓度由大到小的顺序是
溶液。所得混合溶液中离子浓度由大到小的顺序是___________ 。
Ⅰ.甲烷和水蒸气催化制氢气。主要反应如下:
i.CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH=+206.2kJ•mol-1
ii.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH=-41.2kJ•mol-1
(1)反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的 ΔH=
(2)在容积不变的绝热密闭容器中发生反应i,下列能说明反应达到平衡状态的是
A.气体混合物的密度不再变化
B.CH4消耗速率和H2的生成速率相等
C.CO的浓度保持不变
D.气体平均相对分子质量不再变化
E.体系的温度不再发生变化
(3)恒定压强为P0MPa时,将n(CH4):n(H2O)=1:3的混合气体投入反应器中发生反应i和ii,平衡时,各组分的物质的量分数与温度的关系如图所示。

①图中表示CO2的物质的量分数与温度的变化曲线是
②结合图中数据,其他条件不变,若要H2的产量最大,最适宜的反应温度是
A.550~600℃ B.650~700℃ C.750~800℃
在其他条件不变的情况下,向体系中加入CaO可明显提高平衡体系中H2的含量,原因是
③600℃时,反应ii的平衡常数的计算式为Kp=
Ⅱ.“氰化提金”产生的废水中含有一定量的
 ,为处理含氰废水科研人员进行了大量研究。回答下列问题:
,为处理含氰废水科研人员进行了大量研究。回答下列问题:(4)25℃,氢氰酸(HCN)、碳酸在水中的电离常数如下表:
| 酸 | HCN |  |
 | 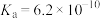 | 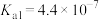 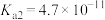 |
 通入NaCN溶液中,反应的离子方程式是
通入NaCN溶液中,反应的离子方程式是②常温下,在
 溶液中加入
溶液中加入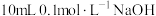 溶液。所得混合溶液中离子浓度由大到小的顺序是
溶液。所得混合溶液中离子浓度由大到小的顺序是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】2020年东京奥运会火炬传递的火炬样式将采用樱花形状。奥运会火炬常用的燃料为丙烷、丁烷等。
已知:丙烷的燃烧热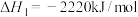 ;正丁烷的燃烧热
;正丁烷的燃烧热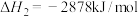 ,异丁烷的燃烧热
,异丁烷的燃烧热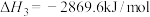 。
。
(1)写出丙烷燃烧热的热化学方程式:_______ 。
(2)下列有关说法不正确的是_______ (填标号)。
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(3)已知A气体的燃烧热为30kJ/mol,B气体的燃烧热为500kJ/mol。现有6mol由A和B组成的混合气体,完全燃烧放出的热量是2000kJ,则该混合气体中气体A和气体B的物质的量之比是_______ 。
(4)Deacon直接氧化法可按下列催化过程进行:
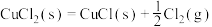
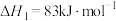
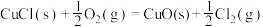


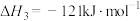
则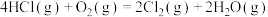 的
的
_______  。
。
(5)恒温恒容条件下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应: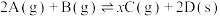 ,2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为
,2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为 。
。
①从开始反应至达到平衡状态,生成C的平均反应速率为_______ 。
②
_______ 。
③下列各项可作为该反应达到平衡状态的标志的是_______ (填字母)。
A.压强不再变化 B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2∶1 D.A的百分含量保持不变
已知:丙烷的燃烧热
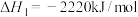 ;正丁烷的燃烧热
;正丁烷的燃烧热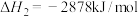 ,异丁烷的燃烧热
,异丁烷的燃烧热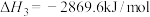 。
。(1)写出丙烷燃烧热的热化学方程式:
(2)下列有关说法不正确的是
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(3)已知A气体的燃烧热为30kJ/mol,B气体的燃烧热为500kJ/mol。现有6mol由A和B组成的混合气体,完全燃烧放出的热量是2000kJ,则该混合气体中气体A和气体B的物质的量之比是
(4)Deacon直接氧化法可按下列催化过程进行:
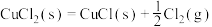
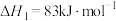
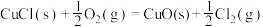


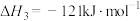
则
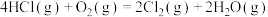 的
的
 。
。(5)恒温恒容条件下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:
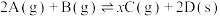 ,2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为
,2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为 。
。①从开始反应至达到平衡状态,生成C的平均反应速率为
②

③下列各项可作为该反应达到平衡状态的标志的是
A.压强不再变化 B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2∶1 D.A的百分含量保持不变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
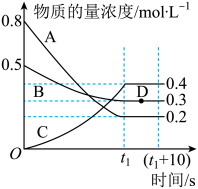
【推荐1】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的情况。
(1)该反应的化学方程式为___________ 。
(2)0~t1s内气体B的平均反应速率为___________ 。
(3)(t1+10)s时,B的物质的量分数为___________ (结果保留一位小数)。
(4)能判断该反应在一定温度下达到化学平衡状态的依据是___________ (填字母)。
a.容器中压强不变 b.混合气体中 不变
不变
c.容器中气体密度不变 d.
(5)容器中(t1+10)s时的压强与起始时的压强之比为___________ 。
(1)该反应的化学方程式为
(2)0~t1s内气体B的平均反应速率为
(3)(t1+10)s时,B的物质的量分数为
(4)能判断该反应在一定温度下达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中
 不变
不变c.容器中气体密度不变 d.

(5)容器中(t1+10)s时的压强与起始时的压强之比为
您最近一年使用:0次
【推荐2】碳的化合物的转换在生产、生活中具有重要的应用,如航天员呼吸产生的 用Sabatier反应处理,实现空间站中
用Sabatier反应处理,实现空间站中 的循环利用。
的循环利用。
Sabatier反应: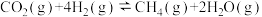 ;
;
水电解反应: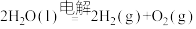 。
。
I.将原料气按 置于密闭容器中发生Sabatier反应,测得
置于密闭容器中发生Sabatier反应,测得 的物质的量分数与温度的关系如下图所示(曲线Ⅱ表示平衡曲线)。
的物质的量分数与温度的关系如下图所示(曲线Ⅱ表示平衡曲线)。
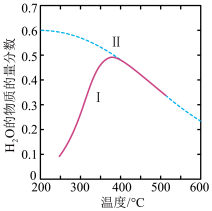
(1)在密闭恒温(高于100℃)恒容装置中进行该反应,下列能说明达到平衡状态的是_____ 。
A.混合气体密度不再改变B.混合气体压强不再改变
C.混合气体平均摩尔质量不再改变D.
(2)380℃以后曲线I与曲线Ⅱ重合并且下降的原因是_________________ 。
(3)200℃达到平衡时体系的总压强为p,该反应平衡常数 的计算表达式为
的计算表达式为_____ 。(不必化简,用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)
物质的量分数)
(4)Sabatier反应在空间站运行时,下列措施能提高 转化率的是
转化率的是_____ (填标号)。
A.适当减压B.合理控制反应器中气体的流速
C.反应器前段加热,后段冷却D.提高原料气中 所占比例
所占比例
Ⅱ.一种新的循环利用方案是用Bosch反应代替Sabatier反应。Bosch反应中 和
和 生成了C和
生成了C和 。
。
(5)①已知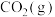 、
、 的生成焓分别为
的生成焓分别为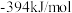 、
、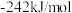 ,Bosch反应的热化学方程式为
,Bosch反应的热化学方程式为_________________ 。(生成焓指一定条件下由对应单质生成1mol化合物时的反应热)
(6)一定条件下,若无催化剂Bosch反应必须在高温下才能启动,而使用催化剂,则在较低温度下就能启动,试分析原因是_________________ 。
(7)Bosch反应的优点是_________________ 。
 用Sabatier反应处理,实现空间站中
用Sabatier反应处理,实现空间站中 的循环利用。
的循环利用。Sabatier反应:
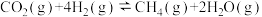 ;
;水电解反应:
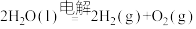 。
。I.将原料气按
 置于密闭容器中发生Sabatier反应,测得
置于密闭容器中发生Sabatier反应,测得 的物质的量分数与温度的关系如下图所示(曲线Ⅱ表示平衡曲线)。
的物质的量分数与温度的关系如下图所示(曲线Ⅱ表示平衡曲线)。
(1)在密闭恒温(高于100℃)恒容装置中进行该反应,下列能说明达到平衡状态的是
A.混合气体密度不再改变B.混合气体压强不再改变
C.混合气体平均摩尔质量不再改变D.

(2)380℃以后曲线I与曲线Ⅱ重合并且下降的原因是
(3)200℃达到平衡时体系的总压强为p,该反应平衡常数
 的计算表达式为
的计算表达式为 总压
总压 物质的量分数)
物质的量分数)(4)Sabatier反应在空间站运行时,下列措施能提高
 转化率的是
转化率的是A.适当减压B.合理控制反应器中气体的流速
C.反应器前段加热,后段冷却D.提高原料气中
 所占比例
所占比例Ⅱ.一种新的循环利用方案是用Bosch反应代替Sabatier反应。Bosch反应中
 和
和 生成了C和
生成了C和 。
。(5)①已知
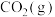 、
、 的生成焓分别为
的生成焓分别为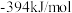 、
、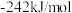 ,Bosch反应的热化学方程式为
,Bosch反应的热化学方程式为(6)一定条件下,若无催化剂Bosch反应必须在高温下才能启动,而使用催化剂,则在较低温度下就能启动,试分析原因是
(7)Bosch反应的优点是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】煤的间接液化是煤的综合利用的一种重要方法。首先是煤燃烧生成 ,再在钼系催化剂的催化作用下与
,再在钼系催化剂的催化作用下与 反应,最终生成
反应,最终生成 过程中主要发生如下反应:
过程中主要发生如下反应:
反应Ⅰ: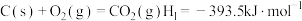
反应Ⅱ: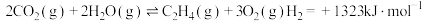
反应Ⅲ: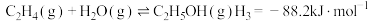
1.已知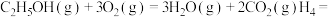
___________ 。
2.反应Ⅰ中属于共价化合物的电子式:___________ 。
为更好地研究煤的液化过程,某学习小组对反应Ⅱ进行了系统的研究。在一个 的恒容容器中加入
的恒容容器中加入 气体及
气体及 水蒸气,在
水蒸气,在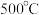 及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
3.下列不能说明该反应已达到平衡状态的有___________(填标号)。
4.如图为四种组分的平衡时物质的量分数随温度的变化曲线。图中曲线 表示的物质是
表示的物质是___________ ,原因是___________ 。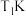 时,某同学在该容器中加入
时,某同学在该容器中加入 和
和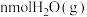 ,同时加入了
,同时加入了 和
和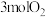 ,达到平衡后各组分体积分数仍与图中所示相同,则
,达到平衡后各组分体积分数仍与图中所示相同,则
___________ (用含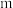 的代数式表示)。
的代数式表示)。
 ,再在钼系催化剂的催化作用下与
,再在钼系催化剂的催化作用下与 反应,最终生成
反应,最终生成 过程中主要发生如下反应:
过程中主要发生如下反应:反应Ⅰ:
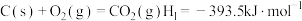
反应Ⅱ:
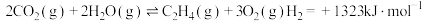
反应Ⅲ:
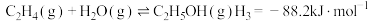
1.已知
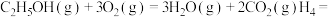
2.反应Ⅰ中属于共价化合物的电子式:
为更好地研究煤的液化过程,某学习小组对反应Ⅱ进行了系统的研究。在一个
 的恒容容器中加入
的恒容容器中加入 气体及
气体及 水蒸气,在
水蒸气,在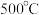 及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
及钼系催化剂(固体)存在条件下只发生反应Ⅱ。3.下列不能说明该反应已达到平衡状态的有___________(填标号)。
A. 的体积分数不再改变 的体积分数不再改变 | B.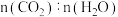 不再改变 不再改变 |
| C.容器的总压不再改变 | D.容器中气体的密度不再改变 |
 表示的物质是
表示的物质是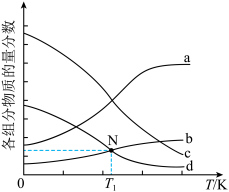
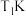 时,某同学在该容器中加入
时,某同学在该容器中加入 和
和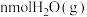 ,同时加入了
,同时加入了 和
和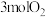 ,达到平衡后各组分体积分数仍与图中所示相同,则
,达到平衡后各组分体积分数仍与图中所示相同,则
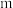 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】合成氨是人类科学技术发展史上的一项重大突破。
(1)关于合成氨工艺的理解,下列正确的是___________。
(2)氨气分解反应的热化学方程式如下: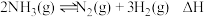
若 键、
键、 键和
键和 键的键能分别为
键的键能分别为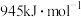 、
、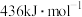 和
和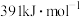 ,则上述反应的
,则上述反应的
___________  。
。
(3)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应活化能最大的是___________ (填催化剂化学式)。
②T温度下,在体积固定的密闭容器中加入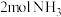 ,此时压强为
,此时压强为 ,用
,用 催化氨气分解:
催化氨气分解: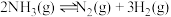 ,若平衡时
,若平衡时 分解率
分解率 为
为 ,则该温度下反应的化学平衡常数
,则该温度下反应的化学平衡常数
___________ 。
[用平衡分压代替平衡浓度,气体分压 气体总压
气体总压 体积分数]
体积分数]
(4)电化学法也可合成氨。如图是用低温固体质子导体作为电解质,用 作阴极催化剂电解
作阴极催化剂电解 和
和 合成
合成 。
。
 电极反应产生
电极反应产生 的电极反应式
的电极反应式___________ 。 可用于除去
可用于除去 ,将一定比例的
,将一定比例的 、
、 和
和 的混合气体匀速通入装有催化剂M的反应器中。反应相同时间
的混合气体匀速通入装有催化剂M的反应器中。反应相同时间 的去除率随反应温度的变化曲线如图:
的去除率随反应温度的变化曲线如图: 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后上升缓慢的主要原因是
的去除率先迅速上升后上升缓慢的主要原因是___________ 。
(1)关于合成氨工艺的理解,下列正确的是___________。
A.合成氨工业常采用的反应温度为 左右,可用勒夏特列原理解释 左右,可用勒夏特列原理解释 |
B.使用初始反应速率更快的催化剂 ,不能提高平衡时 ,不能提高平衡时 的产量 的产量 |
C.合成氨工业采用 ,是因常压下 ,是因常压下 和 和 的转化率不高 的转化率不高 |
| D.将合成后混合气体中的氨液化,可提高合成氨的速率 |
(2)氨气分解反应的热化学方程式如下:
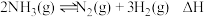
若
 键、
键、 键和
键和 键的键能分别为
键的键能分别为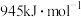 、
、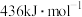 和
和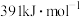 ,则上述反应的
,则上述反应的
 。
。(3)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
| 催化剂 |  |  |  |  |  |  |
初始速率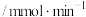 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
②T温度下,在体积固定的密闭容器中加入
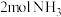 ,此时压强为
,此时压强为 ,用
,用 催化氨气分解:
催化氨气分解: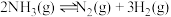 ,若平衡时
,若平衡时 分解率
分解率 为
为 ,则该温度下反应的化学平衡常数
,则该温度下反应的化学平衡常数
[用平衡分压代替平衡浓度,气体分压
 气体总压
气体总压 体积分数]
体积分数](4)电化学法也可合成氨。如图是用低温固体质子导体作为电解质,用
 作阴极催化剂电解
作阴极催化剂电解 和
和 合成
合成 。
。 电极反应产生
电极反应产生 的电极反应式
的电极反应式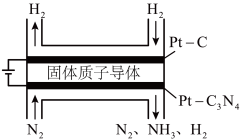
 可用于除去
可用于除去 ,将一定比例的
,将一定比例的 、
、 和
和 的混合气体匀速通入装有催化剂M的反应器中。反应相同时间
的混合气体匀速通入装有催化剂M的反应器中。反应相同时间 的去除率随反应温度的变化曲线如图:
的去除率随反应温度的变化曲线如图: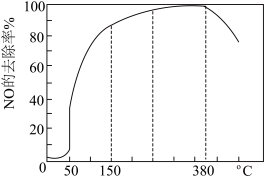
 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后上升缓慢的主要原因是
的去除率先迅速上升后上升缓慢的主要原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:K=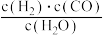 ,它所对应的化学反应为:
,它所对应的化学反应为:________________ 。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.3 kJ/mol
CO2(g)+H2(g) △H=-41.3 kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) 的△H =
CH3OCH3(g)+CO2(g) 的△H =____________ ;二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为________________ 。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g),该反应平衡常数随温度的变化如下表所示:
CO2(g)+H2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是_______ 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为 0.020 mol/L,在该条件下,CO的平衡转化率为:________________ 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如 NO、NO2、N2O4等,对反应N2O4(g) 2NO2(g) △H >0,在温度为 T1、T2时,平衡体系中 NO2的体积分数随压强变化曲线如图甲所示.下列说法正确的是
2NO2(g) △H >0,在温度为 T1、T2时,平衡体系中 NO2的体积分数随压强变化曲线如图甲所示.下列说法正确的是________________ 。
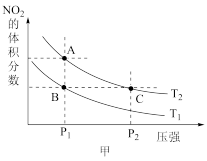
A. A、C 两点的反应速率:A>C
B. A、C 两点气体的颜色:A 深,C浅
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态 B 到状态 A,可以用加热的方法
E. A、C 两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3,25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加 n L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________ mol/L(NH3·H2O的电离平衡常数取Kb=2×10﹣5 mol/L)。
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图乙所示,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触。

①溶液中H+的移动方向由________ 极到________ 极;(用 A、B 表示)
②B电极的电极反应式为____________ 。
(1)已知某反应的平衡表达式为:K=
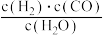 ,它所对应的化学反应为:
,它所对应的化学反应为:(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)
 CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol ③CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41.3 kJ/mol
CO2(g)+H2(g) △H=-41.3 kJ/mol 总反应:3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g) 的△H =
CH3OCH3(g)+CO2(g) 的△H =(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)
 CO2(g)+H2(g),该反应平衡常数随温度的变化如下表所示:
CO2(g)+H2(g),该反应平衡常数随温度的变化如下表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如 NO、NO2、N2O4等,对反应N2O4(g)
 2NO2(g) △H >0,在温度为 T1、T2时,平衡体系中 NO2的体积分数随压强变化曲线如图甲所示.下列说法正确的是
2NO2(g) △H >0,在温度为 T1、T2时,平衡体系中 NO2的体积分数随压强变化曲线如图甲所示.下列说法正确的是
A. A、C 两点的反应速率:A>C
B. A、C 两点气体的颜色:A 深,C浅
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态 B 到状态 A,可以用加热的方法
E. A、C 两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3,25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加 n L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图乙所示,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触。

①溶液中H+的移动方向由
②B电极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g)⇌CO(g)+H2(g) ΔH=+131.3kJ•mol-1。
①该反应在常温下__ 自发进行(填“能”与“不能”);
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是__ (填字母,下同)。
a.容器中的压强不变
b.1molH—H键断裂的同时断裂2molH—O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下三组数据:
①实验1中以v(CO2)表示的反应速率为__ 。(取小数二位,下同)
②该反应为__ (填“吸”或“放”)热反应,实验2条件下平衡常数K=__ 。
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是__ (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3OH)增大的是__ 。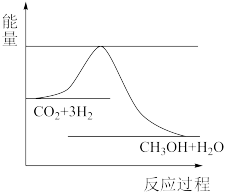
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1molCO2和3molH2
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g)⇌CO(g)+H2(g) ΔH=+131.3kJ•mol-1。
①该反应在常温下
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
a.容器中的压强不变
b.1molH—H键断裂的同时断裂2molH—O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为
②该反应为
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3OH)增大的是

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1molCO2和3molH2
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】2021年3月5日,国务院政府工作报告中指出,扎实做好碳达峰、碳中和各项工作。为了达到碳中和,研发二氧化碳的利用技术成为热点。
(1)利用反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH,可减少CO2排放并合成清洁能源。该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)⇌H2O(g)+CO(g) ΔH1=+41kJ·mol-1
②CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90kJ·mol-1
总反应的ΔH=___________ kJ·mol-1
若反应①为慢反应,下图中能体现上述反应能量变化的是___________ (填标号)。
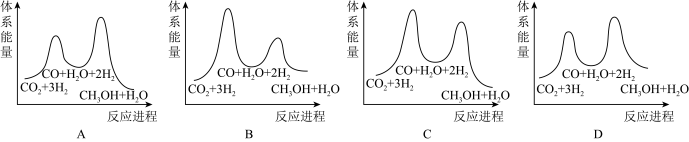
(2)500℃时,在容积为2L的密闭容器中充入3molCO2和8molH2,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得5min时,反应达到平衡,此时n(CO2)=1.0mol。从反应开始到平衡,H2的平均反应速率v(H2)=___________ ;该可逆反应的平衡常数为___________ 。
(3)科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为HCOOH,实现碳中和的目标。原理如图所示:

①P极电极反应式为___________ 。
②已知CO2(g)+H2(g)⇌HCOOH(g)△H=-31.4kJ·mol-1。温度为T1℃时,K=2.实验测得:v正=k正c(CO2)c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k正=___________ k逆;若温度为T2℃时,k正=1.9k逆,则T2___________ T1(填“>”、“<”或“=”)。
(1)利用反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH,可减少CO2排放并合成清洁能源。该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)⇌H2O(g)+CO(g) ΔH1=+41kJ·mol-1
②CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90kJ·mol-1
总反应的ΔH=
若反应①为慢反应,下图中能体现上述反应能量变化的是

(2)500℃时,在容积为2L的密闭容器中充入3molCO2和8molH2,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得5min时,反应达到平衡,此时n(CO2)=1.0mol。从反应开始到平衡,H2的平均反应速率v(H2)=
(3)科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2转化为HCOOH,实现碳中和的目标。原理如图所示:

①P极电极反应式为
②已知CO2(g)+H2(g)⇌HCOOH(g)△H=-31.4kJ·mol-1。温度为T1℃时,K=2.实验测得:v正=k正c(CO2)c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k正=
您最近一年使用:0次
【推荐2】硼氢化钠(NaBH4)广泛用于化工生产,常温下能与水反应,易溶于异丙胺(沸点为33 ℃)。工业上可用硼镁矿(主要成分为Mg2B2O5·H2O,含少量杂质Fe3O4)制取NaBH4,其工艺流程如下:

回答下列问题:
(1)NaBH4中氢元素的化合价为_________ 。
(2)碱溶时Mg2B2O5发生反应的化学方程式是_________ 。
(3)滤渣的主要成分是_________ 。
(4)高温合成中,加料之前需将反应器加热至100 ℃以上,并通入氩气。通入氩气的目的是_________ 。
(5)操作2的名称为_________ ,流程中可循环利用的物质是_________ 。
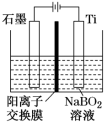
(6)在碱性条件下,用惰性电极电解NaBO2溶液也可制得NaBH4,装置如图所示,电解总反应的离子方程式为_________ 。

回答下列问题:
(1)NaBH4中氢元素的化合价为
(2)碱溶时Mg2B2O5发生反应的化学方程式是
(3)滤渣的主要成分是
(4)高温合成中,加料之前需将反应器加热至100 ℃以上,并通入氩气。通入氩气的目的是
(5)操作2的名称为
(6)在碱性条件下,用惰性电极电解NaBO2溶液也可制得NaBH4,装置如图所示,电解总反应的离子方程式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】高锰酸钾(KMnO4)在工业中广泛用作为氧化剂,工业上常用软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。制备高锰酸钾分两个阶段进行。
阶段一:制备锰酸钾(K2MnO4),工艺流程流程如下:
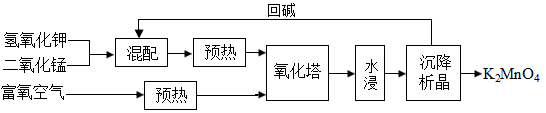
(1)原料加入氧化塔前必须粉碎、预热,目的是_______ 。
(2)在氧化塔,反应分两步进行:
第一步反应生成K3MnO4,反应方程式为_______ 。
第二步反应方程式为4K3MnO4+O2+2H2O 4K2MnO4+4KOH
4K2MnO4+4KOH
阶段二:制备高锰酸钾(KMnO4)
工业中,用锰酸钾制备高锰酸钾有两种方法。
(3)方法一:电解法
工业上采用惰性电极电解锰酸钾溶液,电解反应的化学方程式为2K2MnO4+2H2O 2KMnO4+H2↑+2KOH,阴极上电极反应为
2KMnO4+H2↑+2KOH,阴极上电极反应为_______ 。
(4)方法二:歧化法
相关资料:锰酸钾在强碱性溶液中稳定,在酸性、中性和弱碱性环境下, 会发生歧化反应。20℃时下列各物质溶解度如下表。
会发生歧化反应。20℃时下列各物质溶解度如下表。
工业中常用CO2歧化法制备高锰酸钾,工艺流程如下:
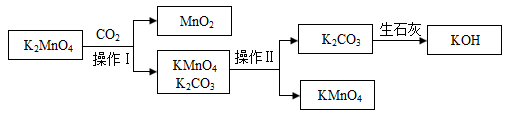
①在该制备过程可循环使用的物质有_______ 、_______ (写化学式)
②操作Ⅱ是将混合液_______ 、_______ 、过滤。
③在酸性条件下,锰酸钾发生歧化反应,工业中用歧化法制高锰酸钾时,用CO2进行酸化,而不用硫酸或盐酸酸化的原因是_______ 。
(5)高锰酸钾是实验室重要试剂,可用于硫酸亚铁样品纯度的测定。取1.000克硫酸亚铁样品溶于蒸馏水,用容量瓶配成100毫升溶液,取出其中20.00mL溶液注入锥形瓶中,加入适量的稀硫酸酸化,用0.0100mol/L的KMnO4标准液进行滴定,当溶液变为微红色且半分钟不褪色时,消耗KMnO4标准液20.00mL,则样品中硫酸亚铁的纯度为_______ 。
阶段一:制备锰酸钾(K2MnO4),工艺流程流程如下:

(1)原料加入氧化塔前必须粉碎、预热,目的是
(2)在氧化塔,反应分两步进行:
第一步反应生成K3MnO4,反应方程式为
第二步反应方程式为4K3MnO4+O2+2H2O
 4K2MnO4+4KOH
4K2MnO4+4KOH阶段二:制备高锰酸钾(KMnO4)
工业中,用锰酸钾制备高锰酸钾有两种方法。
(3)方法一:电解法
工业上采用惰性电极电解锰酸钾溶液,电解反应的化学方程式为2K2MnO4+2H2O
 2KMnO4+H2↑+2KOH,阴极上电极反应为
2KMnO4+H2↑+2KOH,阴极上电极反应为(4)方法二:歧化法
相关资料:锰酸钾在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,
 会发生歧化反应。20℃时下列各物质溶解度如下表。
会发生歧化反应。20℃时下列各物质溶解度如下表。| 物质 | KMnO4 | K2CO3 | K2SO4 |
| 溶解度 | 6.38 | 111 | 11.1 |
工业中常用CO2歧化法制备高锰酸钾,工艺流程如下:

①在该制备过程可循环使用的物质有
②操作Ⅱ是将混合液
③在酸性条件下,锰酸钾发生歧化反应,工业中用歧化法制高锰酸钾时,用CO2进行酸化,而不用硫酸或盐酸酸化的原因是
(5)高锰酸钾是实验室重要试剂,可用于硫酸亚铁样品纯度的测定。取1.000克硫酸亚铁样品溶于蒸馏水,用容量瓶配成100毫升溶液,取出其中20.00mL溶液注入锥形瓶中,加入适量的稀硫酸酸化,用0.0100mol/L的KMnO4标准液进行滴定,当溶液变为微红色且半分钟不褪色时,消耗KMnO4标准液20.00mL,则样品中硫酸亚铁的纯度为
您最近一年使用:0次



