氮的氧化物、硫的氧化物是主要的大气污染物,对这些有害气体的治理及合理利用显得尤为重要。回答下列问题:
I.某MOFs多孔材料孔径大小和形状恰好将N2O4 “固定”,能高效选择性吸附NO2。
废气中的NO2被吸附后,将材料泡入水中并通入氧气能全部转化为HNO3。原理示意图如下:
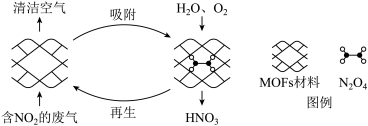
已知: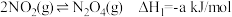

(1)请从温度和压强两个角度分析利于NO2吸附的条件_______ 。
(2)①当10 g材料吸附NO2到质量不再发生变化时,下列_______ 也能说明吸附反应已达到极限。
A.颜色不再发生变化 B.n(NO2):n(N2O4)=2:1
C.2v正(NO2)=v逆(N2O4) D.混合气体的平均分子质量不再发生变化
②当吸附反应达到极限时,测得材料内温度为40℃,压强为10.0 MPa,混合气体平均相对分子质量为69,吸附反应的Kp=_______ 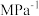 。
。
(3)由N2O4转化生成HNO3的热化学反应方程式_______ 。
Ⅱ.ClO2可对烟气中NO、SO2进行协同脱除。
(4)利用 ClO2气体脱硫脱硝的过程中涉及的部分反应及速率常数如下:
a.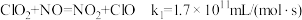
b.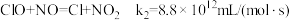
c.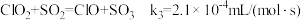
d.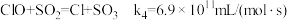
①反应d的历程如下图所示。该历程中最大活化能E正=_______ kJ/mol。
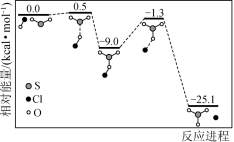
②保持其他条件不变,随着 的增加,SO2脱除效率的逐渐增加的原因是
的增加,SO2脱除效率的逐渐增加的原因是_______ 。
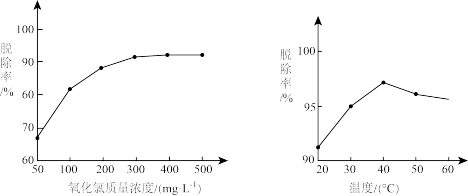
(5)利用 ClO2溶液脱硫脱硝的过程中,ClO2质量浓度和溶液温度对NO脱除率的影响如下图所示,则最佳的质量浓度和溶液温度是_______ 。
I.某MOFs多孔材料孔径大小和形状恰好将N2O4 “固定”,能高效选择性吸附NO2。
废气中的NO2被吸附后,将材料泡入水中并通入氧气能全部转化为HNO3。原理示意图如下:

已知:
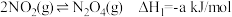

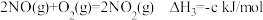
(1)请从温度和压强两个角度分析利于NO2吸附的条件
(2)①当10 g材料吸附NO2到质量不再发生变化时,下列
A.颜色不再发生变化 B.n(NO2):n(N2O4)=2:1
C.2v正(NO2)=v逆(N2O4) D.混合气体的平均分子质量不再发生变化
②当吸附反应达到极限时,测得材料内温度为40℃,压强为10.0 MPa,混合气体平均相对分子质量为69,吸附反应的Kp=
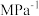 。
。(3)由N2O4转化生成HNO3的热化学反应方程式
Ⅱ.ClO2可对烟气中NO、SO2进行协同脱除。
(4)利用 ClO2气体脱硫脱硝的过程中涉及的部分反应及速率常数如下:
a.
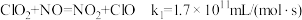
b.
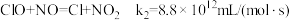
c.
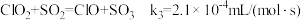
d.
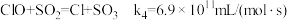
①反应d的历程如下图所示。该历程中最大活化能E正=

②保持其他条件不变,随着
 的增加,SO2脱除效率的逐渐增加的原因是
的增加,SO2脱除效率的逐渐增加的原因是(5)利用 ClO2溶液脱硫脱硝的过程中,ClO2质量浓度和溶液温度对NO脱除率的影响如下图所示,则最佳的质量浓度和溶液温度是

更新时间:2022-12-14 13:11:47
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题
(1)已知:①2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH1=+234.1 kJ·mol-1
②C(s)+O2(g=CO2(g) ΔH2=-393.5 kJ·mol-1
则Fe和O2反应生成Fe2O3的热化学反应方程式为_______ 。
(2)①为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg 。25℃时,溶液的pH与AG的换算公式为AG=
。25℃时,溶液的pH与AG的换算公式为AG=_______ ,若溶液呈中性,则AG=_______ 。
②25℃时,将体积Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合;若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4_______ (填“可”或“否”)。
(3)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如表。
请完成下列填空:
①滴定达到终点的标志是_______ 。
②根据上述数据,可计算出该盐酸的浓度约为_______ (保留两位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______ (填字母序号)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)已知:①2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH1=+234.1 kJ·mol-1
②C(s)+O2(g=CO2(g) ΔH2=-393.5 kJ·mol-1
则Fe和O2反应生成Fe2O3的热化学反应方程式为
(2)①为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg
 。25℃时,溶液的pH与AG的换算公式为AG=
。25℃时,溶液的pH与AG的换算公式为AG=②25℃时,将体积Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合;若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4
(3)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如表。
| 实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.65 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.93 | 20.00 |
①滴定达到终点的标志是
②根据上述数据,可计算出该盐酸的浓度约为
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】雾霾天气多次肆虐京、津、冀等地区,其中汽车尾气和燃煤是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
①200 ℃(平衡常数K=10)时,向10L的密闭容器中充入2mol CO2和1.5mol N2,经过10min测得该容器内有1mol CO2剩余,10min内用N2表示的平均反应速率为______________ ,10min时,氮气的体积分数为____________ ,10min时反应是否达到平衡状态?其理由是_______________ 。
②若该反应在恒温恒容的密闭体系中进行,下列表达能表明反应已经达到化学平衡状态的是(填代号)____ 。
a.混合气体的密度不随时间的变化而变化
b.混合气体的平均相对分子质量不随时间的变化而变化
c.相同时间内生成相同物质的量的NO和CO
d.容器内气体的压强不随时间的变化而变化
e.c(N2)不再变化的状态
f.v(CO)=v(CO2)的状态
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题,煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2(g)和H2O(l)的热化学方程式:__________ 。
(3)甲烷燃料电池可以提升能量利用率。利用甲烷燃料电池电解200mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
①电解后溶液的pH=_____________ (忽略氯气与氢氧化钠溶液反应) 。
②电解后溶液中由水电离出来的c(H+)=__________ 。
(4)2017年5月18日中国首次海域可燃冰试采成功 ,“可燃冰”是一种晶体,晶体中平均每46个H2O分子构建成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子.若晶体中每8个笼有6个容纳了CH4分子;另外2个笼被游离的H2O分子填充,则“可燃冰”平均组成可表示为_____________ ,可燃冰的发现为我国在新世纪使用高效新能源开辟了广阔的前景,你认为能开发利用的新能源还有___________ (至少填写两种)。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)
 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0①200 ℃(平衡常数K=10)时,向10L的密闭容器中充入2mol CO2和1.5mol N2,经过10min测得该容器内有1mol CO2剩余,10min内用N2表示的平均反应速率为
②若该反应在恒温恒容的密闭体系中进行,下列表达能表明反应已经达到化学平衡状态的是(填代号)
a.混合气体的密度不随时间的变化而变化
b.混合气体的平均相对分子质量不随时间的变化而变化
c.相同时间内生成相同物质的量的NO和CO
d.容器内气体的压强不随时间的变化而变化
e.c(N2)不再变化的状态
f.v(CO)=v(CO2)的状态
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题,煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g)
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/molH2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2(g)和H2O(l)的热化学方程式:
(3)甲烷燃料电池可以提升能量利用率。利用甲烷燃料电池电解200mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
①电解后溶液的pH=
②电解后溶液中由水电离出来的c(H+)=
(4)2017年5月18日中国首次海域可燃冰试采成功 ,“可燃冰”是一种晶体,晶体中平均每46个H2O分子构建成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子.若晶体中每8个笼有6个容纳了CH4分子;另外2个笼被游离的H2O分子填充,则“可燃冰”平均组成可表示为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】已知:① (g,环丙烷)
(g,环丙烷)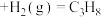 (g,丙烷)
(g,丙烷) kJ·mol
kJ·mol 。
。
②丙烷(g)、环丙烷(g)的燃烧热 分别为-2220 kJ·mol
分别为-2220 kJ·mol 、-2092 kJ·mol
、-2092 kJ·mol 。
。
③ 、
、 的键能分别为498 kJ·mol
的键能分别为498 kJ·mol 、463 kJ·mol
、463 kJ·mol 。
。
回答下列问题:
(1)写出表示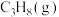 燃烧热的热化学方程式:
燃烧热的热化学方程式:_______ 。
(2)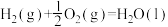

_______ kJ·mol 。
。
(3)热值指单位质量可燃物完全燃烧时放出的热量(单位:kJ·g )。环丙烷、丙烷、氢气三种气体完全燃烧生成液态水、二氧化碳,其热值最大的是
)。环丙烷、丙烷、氢气三种气体完全燃烧生成液态水、二氧化碳,其热值最大的是_______ (填名称)。
(4)上述反应①的能量变化如图所示。
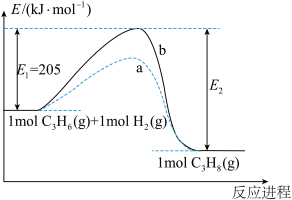
曲线a或b代表镍催化剂对反应的影响,其中表示加入镍催化剂的曲线是_______ (填“a”或“b”)。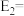
_______ 。
(5)一定量的丙烷和环丙烷的混合气体完全燃烧生成液态水和二氧化碳时放出的热量为Q kJ,将产物经浓硫酸干燥,再通过足量的过氧化钠粉末,固体净增8.4 g。由此可知,Q的范围为_______ 。
 (g,环丙烷)
(g,环丙烷)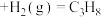 (g,丙烷)
(g,丙烷) kJ·mol
kJ·mol 。
。②丙烷(g)、环丙烷(g)的燃烧热
 分别为-2220 kJ·mol
分别为-2220 kJ·mol 、-2092 kJ·mol
、-2092 kJ·mol 。
。③
 、
、 的键能分别为498 kJ·mol
的键能分别为498 kJ·mol 、463 kJ·mol
、463 kJ·mol 。
。回答下列问题:
(1)写出表示
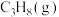 燃烧热的热化学方程式:
燃烧热的热化学方程式:(2)
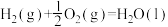

 。
。(3)热值指单位质量可燃物完全燃烧时放出的热量(单位:kJ·g
 )。环丙烷、丙烷、氢气三种气体完全燃烧生成液态水、二氧化碳,其热值最大的是
)。环丙烷、丙烷、氢气三种气体完全燃烧生成液态水、二氧化碳,其热值最大的是(4)上述反应①的能量变化如图所示。

曲线a或b代表镍催化剂对反应的影响,其中表示加入镍催化剂的曲线是
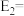
(5)一定量的丙烷和环丙烷的混合气体完全燃烧生成液态水和二氧化碳时放出的热量为Q kJ,将产物经浓硫酸干燥,再通过足量的过氧化钠粉末,固体净增8.4 g。由此可知,Q的范围为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】I. 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。

(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
用H2表示前2 h平均反应速率v(H2) =__________ mol·(L·h)-1。
(2)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp=________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:

①该反应的ΔH______ 0 (填“>”、“=”或“<”)。
②曲线c表示的物质为____________________ 。
II. 砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。某小组欲探究可逆反应AsO33-+I2+2OH- ⇌ AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。

(1)图II中AsO43-的逆反应速率:a____ b( 填“>”、“<”或“=” )。
(2)写出图II中c点对应图I装置的正极反应式__________________________ 。
(3)能判断该反应达到平衡状态的是________ 。
a.2v(I-)正=v(AsO33-)逆b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化

(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
| 时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| P后/P前 | 0.9 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
(2)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp=
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
①该反应的ΔH
②曲线c表示的物质为
II. 砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。某小组欲探究可逆反应AsO33-+I2+2OH- ⇌ AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。

(1)图II中AsO43-的逆反应速率:a
(2)写出图II中c点对应图I装置的正极反应式
(3)能判断该反应达到平衡状态的是
a.2v(I-)正=v(AsO33-)逆b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】工业尾气的转化和综合利用既有利于节约资源,又有利于保护环境。
(1)已知: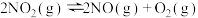
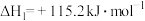 ;
;

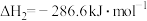 。
。
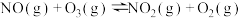
 。则
。则
___________  。
。
恒容密闭体系中NO氧化率随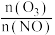 值的变化以及随温度的变化曲线如图所示。NO氧化率随
值的变化以及随温度的变化曲线如图所示。NO氧化率随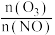 值增大而增大的主要原因是
值增大而增大的主要原因是___________ 。

(2)汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应生成无毒的 和
和 ,化学兴趣研究小组在三个容积均为V L的恒容密闭容器中,分别充入2 mol NO和2 mol CO,发生反应。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系的总压强随时间变化情况如图所示:
,化学兴趣研究小组在三个容积均为V L的恒容密闭容器中,分别充入2 mol NO和2 mol CO,发生反应。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系的总压强随时间变化情况如图所示:

①在 条件下,若
条件下,若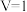 ,求前5min平均反应速率
,求前5min平均反应速率
___________  。
。
②已知:温度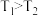 ,则
,则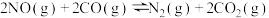
 ,则
,则
___________ 0.(填“>”“<”);在 条件下,Ⅲ与Ⅱ从条件上相比,Ⅲ可能
条件下,Ⅲ与Ⅱ从条件上相比,Ⅲ可能___________ 。
③在 条件下,下列说明该反应已经到达平衡状态的是
条件下,下列说明该反应已经到达平衡状态的是___________ (填字母)。
A.NO和CO的物质的量分数不变
B.混合气体的密度保持不变
C.容器中混合气体的平均摩尔质量不变
D.容器中压强不再变化
(1)已知:
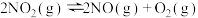
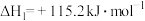 ;
;
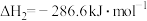 。
。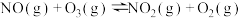
 。则
。则
 。
。恒容密闭体系中NO氧化率随
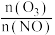 值的变化以及随温度的变化曲线如图所示。NO氧化率随
值的变化以及随温度的变化曲线如图所示。NO氧化率随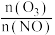 值增大而增大的主要原因是
值增大而增大的主要原因是
(2)汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应生成无毒的
 和
和 ,化学兴趣研究小组在三个容积均为V L的恒容密闭容器中,分别充入2 mol NO和2 mol CO,发生反应。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系的总压强随时间变化情况如图所示:
,化学兴趣研究小组在三个容积均为V L的恒容密闭容器中,分别充入2 mol NO和2 mol CO,发生反应。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系的总压强随时间变化情况如图所示:
①在
 条件下,若
条件下,若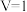 ,求前5min平均反应速率
,求前5min平均反应速率
 。
。②已知:温度
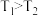 ,则
,则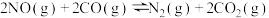
 ,则
,则
 条件下,Ⅲ与Ⅱ从条件上相比,Ⅲ可能
条件下,Ⅲ与Ⅱ从条件上相比,Ⅲ可能③在
 条件下,下列说明该反应已经到达平衡状态的是
条件下,下列说明该反应已经到达平衡状态的是A.NO和CO的物质的量分数不变
B.混合气体的密度保持不变
C.容器中混合气体的平均摩尔质量不变
D.容器中压强不再变化
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.某温度下,向一刚性密闭容器中充入X、Y、Z三种气体,气体物质的量随时间变化的曲线如图所示。回答下列问题:

(1)反应的化学方程式为___________ 。
(2)下列叙述中能说明反应达到平衡状态的是___________ (填标号)。
a.Y的体积分数在混合气体中保持不变 b.X、Y的反应速率比为1:1
C.容器内气体压强保持不变 d.生成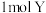 的同时消耗
的同时消耗
Ⅱ.某研究性学习小组利用 与酸性
与酸性 溶液的反应,探究“外界条件对化学反应速率的影响”,实验记录如下表所示:
溶液的反应,探究“外界条件对化学反应速率的影响”,实验记录如下表所示:
查阅资料: 溶液中滴加过量的
溶液中滴加过量的 ,振荡后溶液由紫色变为无色,反应的离子方程式为:
,振荡后溶液由紫色变为无色,反应的离子方程式为: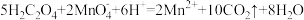 。
。
回答下列问题:
(3)
___________ ,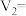
___________ ;
(4)若探究温度对化学反应速率的影响,可选择实验___________ (填组别)。
(5)计算A组实验的平均反应速率v(KMnO4)=___________ 。
(6)甲同学依据经验绘制出A组实验中V(CO2)随时间t的变化如图1所示,乙同学查阅资料发现实验过程中V(CO2)随时间t的变化趋势如图2所示。

小组同学针对这一现象,设计实验进一步探究影响因素,具体情况见下表。
①补全方案1中的实验操作:___________ 。
②方案2中的假设为___________ 。

(1)反应的化学方程式为
(2)下列叙述中能说明反应达到平衡状态的是
a.Y的体积分数在混合气体中保持不变 b.X、Y的反应速率比为1:1
C.容器内气体压强保持不变 d.生成
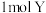 的同时消耗
的同时消耗
Ⅱ.某研究性学习小组利用
 与酸性
与酸性 溶液的反应,探究“外界条件对化学反应速率的影响”,实验记录如下表所示:
溶液的反应,探究“外界条件对化学反应速率的影响”,实验记录如下表所示:| 实验级别 | 实验温度/K | 参加反应的物质 | 溶液褪色所需时间/s | ||||
 溶液(含硫酸) 溶液(含硫酸) |  溶液 溶液 |  | |||||
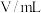 | 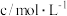 | 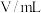 | 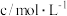 | 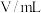 | |||
| A | 293 | 3 | 0.2 | 7 | 1 | 0 | 60 |
| B |  | 3 | 0.2 | 5 | 1 |  | 80 |
| C | 313 | 3 | 0.2 |  | 1 | 2 | t1 |
 溶液中滴加过量的
溶液中滴加过量的 ,振荡后溶液由紫色变为无色,反应的离子方程式为:
,振荡后溶液由紫色变为无色,反应的离子方程式为: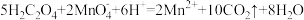 。
。回答下列问题:
(3)

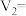
(4)若探究温度对化学反应速率的影响,可选择实验
(5)计算A组实验的平均反应速率v(KMnO4)=
(6)甲同学依据经验绘制出A组实验中V(CO2)随时间t的变化如图1所示,乙同学查阅资料发现实验过程中V(CO2)随时间t的变化趋势如图2所示。

小组同学针对这一现象,设计实验进一步探究影响因素,具体情况见下表。
| 方案 | 假设 | 实验操作 |
| 1 | 该反应放热,使溶液温度升高,化学反应速率提高 | 向烧杯中加入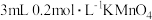 溶液和 溶液和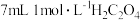 溶液,___________ 溶液,___________ |
| 2 | ___________ | 取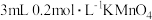 溶液加入烧杯中,向其中加入少量硫酸锰固体,再加入 溶液加入烧杯中,向其中加入少量硫酸锰固体,再加入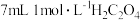 溶液 溶液 |
②方案2中的假设为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】过去五年,环保部向水污染、大气污染宣战,生态环境保护取得明显成效。
I.污水中硝酸盐浓度过高,会诱发一些水体产生亚硝胺类的致癌物质。
(1)在缺氧条件下,脱氮菌(反硝化菌)以甲醇作碳源,将NO3-还原成N2的过程如下:
反硝化作用过程:NO
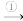 NO
NO
 NO
NO N2O
N2O N2
N2
阶段①会生成CO2,请写出此反应的离子方程式:_______ ;阶段③生成的N2O是一种强温室气体,但却可用作火箭燃料的氧化剂,其优点是_______ 。
(2)Murphy等人通过调节溶液pH为10.25,利用铝粉将NO 转变成N2,实现化学脱氮。
转变成N2,实现化学脱氮。
要转化0.01molNO ,需
,需_______ gAl。
II.CO2和CH4均为温室气体,如何减少它们的排放、充分利用能源是当今社会的重要课题。
(3)二氧化碳经催化氢化可转化成绿色能源乙醇。已知:
①2H2(g)+O2(g)=2H2O(g)△H= -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ·mol-1
③H2O(l)=H2O(g)△H=+44.0kJ·mol-1
则二氧化碳与氢气转化成乙醇和液态水的热化学方程式为:_______ 。
(4)CO2和CH4在催化剂作用下可转化为合成气(CO和H2):CO2(g)+CH4(g) 2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
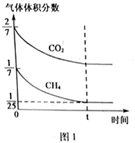
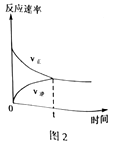
①T℃时,反应的平衡常数K=_______ 。向平衡体系中再加入CO2、CH4、H2和CO各0.5mol,平衡将_______ 移动(填“向左”、“向右”或“不”)。
②写出一种既能加快化学反应速率又能提高CH4转化率的措施_______ 。
I.污水中硝酸盐浓度过高,会诱发一些水体产生亚硝胺类的致癌物质。
(1)在缺氧条件下,脱氮菌(反硝化菌)以甲醇作碳源,将NO3-还原成N2的过程如下:
反硝化作用过程:NO

 NO
NO
 NO
NO N2O
N2O N2
N2阶段①会生成CO2,请写出此反应的离子方程式:
(2)Murphy等人通过调节溶液pH为10.25,利用铝粉将NO
 转变成N2,实现化学脱氮。
转变成N2,实现化学脱氮。要转化0.01molNO
 ,需
,需II.CO2和CH4均为温室气体,如何减少它们的排放、充分利用能源是当今社会的重要课题。
(3)二氧化碳经催化氢化可转化成绿色能源乙醇。已知:
①2H2(g)+O2(g)=2H2O(g)△H= -483.6 kJ·mol-1
②CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1366.8kJ·mol-1
③H2O(l)=H2O(g)△H=+44.0kJ·mol-1
则二氧化碳与氢气转化成乙醇和液态水的热化学方程式为:
(4)CO2和CH4在催化剂作用下可转化为合成气(CO和H2):CO2(g)+CH4(g)
 2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:
2CO(g)+2H2(g) △H=+247.3kJ·mol-1。向容积为1L的密闭容器中通入反应物和生成物共5.25mol,在T℃时发生反应,气体体积分数及化学反应速率与反应时间的关系如下图所示:

①T℃时,反应的平衡常数K=
②写出一种既能加快化学反应速率又能提高CH4转化率的措施
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】硫化氢俗称“臭蛋气”,是一种无色具有臭鸡蛋气味的剧毒气体,由含硫物质分解而来,属于常见的酸性有害气体中的一种。研究硫化氢的利用及污染的防治很有意义。
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1=-1123.6kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH2=-296kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
写出H2S分解为单质硫(用S表示)和H2的热化学方程式:___ 。
(2)H2S在一定条件下发生如下形式的分解:2H2S(g) S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。

①温度升高时,混合气体的平均摩尔质量减小的原因是___ 。
②P点时容器内气体压强与起始时气体压强之比为___ 。
③1050℃时,此反应的平衡常数___ (填序号)。
a.等于3.125×10-4 b.大于3.125×10-4
c.小于3.125×10-4 d.无法判断
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示:

①电极a上发生反应的电极反应式为___ 。
②当有1molH+经质子膜进入正极区时,反应消耗H2S的体积为___ L(标准状况下)。
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1=-1123.6kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH2=-296kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
写出H2S分解为单质硫(用S表示)和H2的热化学方程式:
(2)H2S在一定条件下发生如下形式的分解:2H2S(g)
 S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
①温度升高时,混合气体的平均摩尔质量减小的原因是
②P点时容器内气体压强与起始时气体压强之比为
③1050℃时,此反应的平衡常数
a.等于3.125×10-4 b.大于3.125×10-4
c.小于3.125×10-4 d.无法判断
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示:

①电极a上发生反应的电极反应式为
②当有1molH+经质子膜进入正极区时,反应消耗H2S的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
(1)①写出工业合成氨的化学方程式_________ 。
②由上表数据可知该反应为放热反应,理由是_________ 。
③理论上,为了增大平衡时H2的转化率,可采取的措施是_________ 。(填序号)
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g) CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的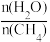 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
①图中,两条曲线表示压强的关系是:P1_____ P2(填“>”、“=”或“<”)。
②该反应为________ 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CH4(g)+H2O(g) CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
①平衡时CO的转化率为_________ 。
②该温度下反应的平衡常数K值为_________ 。
| 温度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式
②由上表数据可知该反应为放热反应,理由是
③理论上,为了增大平衡时H2的转化率,可采取的措施是
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)
 CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的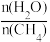 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
①图中,两条曲线表示压强的关系是:P1
②该反应为
(3)原料气H2还可通过反应CH4(g)+H2O(g)
 CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1①平衡时CO的转化率为
②该温度下反应的平衡常数K值为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】纳米 不同于常规
不同于常规 ,由于其晶粒尺寸小,比表面积大,具有优异的物理和化学性质,可用作催化剂脱除废气中的
,由于其晶粒尺寸小,比表面积大,具有优异的物理和化学性质,可用作催化剂脱除废气中的 (胂)(已知:在缺氧条件下,胂受热分解成单质砷)。
(胂)(已知:在缺氧条件下,胂受热分解成单质砷)。
(1)纳米 催化剂的制备:先向
催化剂的制备:先向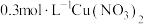 溶液中加入过量氨水,充分搅拌,生成铜氨络合物,再在一定温度下,加入
溶液中加入过量氨水,充分搅拌,生成铜氨络合物,再在一定温度下,加入 的乙醇溶液生成纳米
的乙醇溶液生成纳米 .
.
已知:i.
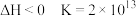 .
.
ⅱ.其他条件相同时,溶液中离子浓度大小影响晶粒生成速率与晶粒生长速率,从而决定了晶粒半径大小.
①反应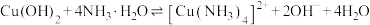 中,
中, 的配位原子为
的配位原子为__________ ,反应的平衡常数
__________ ;
②向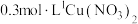 溶液中先加入过量氨水的目的是
溶液中先加入过量氨水的目的是__________ ;
③其他条件不变,产物品粒半径与反应温度的关系如图所示, 时生成
时生成 晶粒的半径较大,可能的原因是
晶粒的半径较大,可能的原因是____________________ ;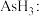
① 主要被废气中的
主要被废气中的 氧化成
氧化成 固体除去,温度低于
固体除去,温度低于 时,氧化生成的固体中砷元素质量分数会升高,原因是
时,氧化生成的固体中砷元素质量分数会升高,原因是____________________ ; 再生:“再生”时需除去纳米
再生:“再生”时需除去纳米 催化剂上的
催化剂上的 和少量
和少量 ,可采用在氮气氛围中加热分解的方法.已知:
,可采用在氮气氛围中加热分解的方法.已知: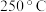 时催化剂上的
时催化剂上的 完全升华;
完全升华; 时催化剂上的
时催化剂上的 完全分解为
完全分解为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为__________ 。
 不同于常规
不同于常规 ,由于其晶粒尺寸小,比表面积大,具有优异的物理和化学性质,可用作催化剂脱除废气中的
,由于其晶粒尺寸小,比表面积大,具有优异的物理和化学性质,可用作催化剂脱除废气中的 (胂)(已知:在缺氧条件下,胂受热分解成单质砷)。
(胂)(已知:在缺氧条件下,胂受热分解成单质砷)。(1)纳米
 催化剂的制备:先向
催化剂的制备:先向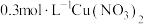 溶液中加入过量氨水,充分搅拌,生成铜氨络合物,再在一定温度下,加入
溶液中加入过量氨水,充分搅拌,生成铜氨络合物,再在一定温度下,加入 的乙醇溶液生成纳米
的乙醇溶液生成纳米 .
.已知:i.

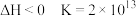 .
.ⅱ.其他条件相同时,溶液中离子浓度大小影响晶粒生成速率与晶粒生长速率,从而决定了晶粒半径大小.
①反应
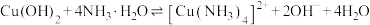 中,
中, 的配位原子为
的配位原子为
②向
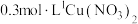 溶液中先加入过量氨水的目的是
溶液中先加入过量氨水的目的是③其他条件不变,产物品粒半径与反应温度的关系如图所示,
 时生成
时生成 晶粒的半径较大,可能的原因是
晶粒的半径较大,可能的原因是
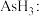
①
 主要被废气中的
主要被废气中的 氧化成
氧化成 固体除去,温度低于
固体除去,温度低于 时,氧化生成的固体中砷元素质量分数会升高,原因是
时,氧化生成的固体中砷元素质量分数会升高,原因是②已知 的结构可表示为
的结构可表示为 ,则
,则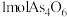 中
中 键物质的量为
键物质的量为 。
。
 再生:“再生”时需除去纳米
再生:“再生”时需除去纳米 催化剂上的
催化剂上的 和少量
和少量 ,可采用在氮气氛围中加热分解的方法.已知:
,可采用在氮气氛围中加热分解的方法.已知: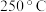 时催化剂上的
时催化剂上的 完全升华;
完全升华; 时催化剂上的
时催化剂上的 完全分解为
完全分解为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】请运用化学反应原理的相关知识回答下列问题:
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为_________________ 。该反应的△S ________ 0(选填“>”、“<”或“=”),该反应在_______ 条件下能自发进行(选填“高温”、“低温”或“任意温度”)。
(2)CO是有毒的还原性气体,工业上有重要的应用。 CO是高炉炼铁的还原剂,其主要反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
①已知: Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1 C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1则a =____________ 。
②工业上高炉炼铁反应的平衡常数表达式K =______ ,温度升高后,K值_______ (选填“增大”、“不变”或“减小”)。
③在T ℃时,该反应的平衡常数K = 64,在恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
下列说法正确的是____________ (填字母)
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率为60%,大于乙
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.由于容器的体积未知,所以无法计算该条件下甲容器中CO的平衡转化率
(3)请解释打开饮料“雪碧”的瓶盖,会有大量气泡冒出的原因:_____________ .
(4)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。正极加入的物质是______ ;负极的电极反应是_______________ 。
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为
(2)CO是有毒的还原性气体,工业上有重要的应用。 CO是高炉炼铁的还原剂,其主要反应为:Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1①已知: Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1 C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1则a =
②工业上高炉炼铁反应的平衡常数表达式K =
③在T ℃时,该反应的平衡常数K = 64,在恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
下列说法正确的是
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率为60%,大于乙
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.由于容器的体积未知,所以无法计算该条件下甲容器中CO的平衡转化率
(3)请解释打开饮料“雪碧”的瓶盖,会有大量气泡冒出的原因:
(4)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。正极加入的物质是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”。一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
I:CO(g)+2H2(g) CH3OH(g)∆H1=-90.7kJ·mol-1
CH3OH(g)∆H1=-90.7kJ·mol-1
II:2CH3OH(g) CH3OCH3(g)+H2O(g)∆H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g)∆H2=-23.5kJ·mol-1
III:CO(g)+H2O(g) CO2(g)+H2(g)ΔH3=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH3=-41.2kJ·mol-1
(1)一种新合成二甲醚的方法为一定条件下:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),该反应的∆H=
CH3OCH3(g)+3H2O(g),该反应的∆H=___________ kJ·mol-1;判断该反应在一定温度下、体积恒定的密闭容器中,下列不能作为达到化学平衡状态的依据是___________ 。
A.平均摩尔质量保持不变B.容器的密度不变
C.容器内压强保持不变D.单位时间内消耗2molCO2,同时消耗1mol二甲醚
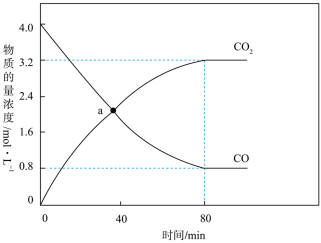
(2)若反应CO(g)+H2O(g) CO2(g)+H2(g)的正、逆反应速率分别可表示为v正=k正c(CO)·c(H2O);v逆=k逆c(CO2)·c(H2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1L的恒容密闭容器中加入4molH2O(g)和4molCO(g)发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图所示。a点时,v逆:v正=
CO2(g)+H2(g)的正、逆反应速率分别可表示为v正=k正c(CO)·c(H2O);v逆=k逆c(CO2)·c(H2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1L的恒容密闭容器中加入4molH2O(g)和4molCO(g)发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图所示。a点时,v逆:v正=___________ 。
(3)可采用CO和二甲醚催化合成乙醇。
反应I:CH3OCH3(g)+CO(g) CH3COOCH3(g)ΔH1
CH3COOCH3(g)ΔH1
反应II:CH3COOCH3(g)+2H2(g) CH3OH(g)+C2H5OH(g)ΔH2
CH3OH(g)+C2H5OH(g)ΔH2
①压强为pkpa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图甲所示,则∆H1___________ (填“>”或“<”)0。
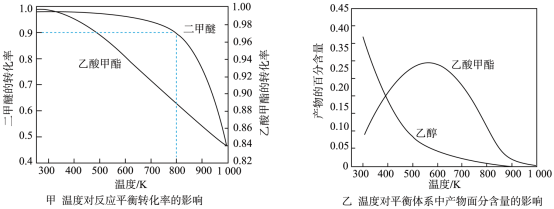
②温度对平衡体系中乙酸甲酯的含量和乙醇的影响如图乙所示,在300~600K范围内,乙酸甲酯的含量逐渐增大,而乙醇的百分含量逐渐减小的原因是:___________ 。
③若压强为pkpa、温度为800K时,向2L恒容密闭容器中充入1molCH3OCH3和1molCO发生反应I,2min时达到平衡,该条件下反应I的平衡常数K=___________ L/mol。
(4)25℃时,以二甲醚燃料电池(电解质溶液为稀硫酸)为电源,电解600mL一定浓度的NaCl溶液。电解一段时间后,NaCl溶液的pH变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗二甲醚的物质的量为___________ mol。若向U形管内电解后的溶液中通入CO2气体,使所得溶液c(HCO )∶c(CO
)∶c(CO )=2∶1,则此时溶液中的c(H+)=
)=2∶1,则此时溶液中的c(H+)=___________ mol·L-1(室温下,H2CO3的Ka1=4×10-7,Ka2=5×10-11)。
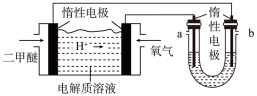
I:CO(g)+2H2(g)
 CH3OH(g)∆H1=-90.7kJ·mol-1
CH3OH(g)∆H1=-90.7kJ·mol-1II:2CH3OH(g)
 CH3OCH3(g)+H2O(g)∆H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g)∆H2=-23.5kJ·mol-1III:CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH3=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH3=-41.2kJ·mol-1(1)一种新合成二甲醚的方法为一定条件下:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g),该反应的∆H=
CH3OCH3(g)+3H2O(g),该反应的∆H=A.平均摩尔质量保持不变B.容器的密度不变
C.容器内压强保持不变D.单位时间内消耗2molCO2,同时消耗1mol二甲醚
(2)若反应CO(g)+H2O(g)
 CO2(g)+H2(g)的正、逆反应速率分别可表示为v正=k正c(CO)·c(H2O);v逆=k逆c(CO2)·c(H2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1L的恒容密闭容器中加入4molH2O(g)和4molCO(g)发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图所示。a点时,v逆:v正=
CO2(g)+H2(g)的正、逆反应速率分别可表示为v正=k正c(CO)·c(H2O);v逆=k逆c(CO2)·c(H2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1L的恒容密闭容器中加入4molH2O(g)和4molCO(g)发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图所示。a点时,v逆:v正=
(3)可采用CO和二甲醚催化合成乙醇。
反应I:CH3OCH3(g)+CO(g)
 CH3COOCH3(g)ΔH1
CH3COOCH3(g)ΔH1反应II:CH3COOCH3(g)+2H2(g)
 CH3OH(g)+C2H5OH(g)ΔH2
CH3OH(g)+C2H5OH(g)ΔH2①压强为pkpa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图甲所示,则∆H1

②温度对平衡体系中乙酸甲酯的含量和乙醇的影响如图乙所示,在300~600K范围内,乙酸甲酯的含量逐渐增大,而乙醇的百分含量逐渐减小的原因是:
③若压强为pkpa、温度为800K时,向2L恒容密闭容器中充入1molCH3OCH3和1molCO发生反应I,2min时达到平衡,该条件下反应I的平衡常数K=
(4)25℃时,以二甲醚燃料电池(电解质溶液为稀硫酸)为电源,电解600mL一定浓度的NaCl溶液。电解一段时间后,NaCl溶液的pH变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗二甲醚的物质的量为
 )∶c(CO
)∶c(CO )=2∶1,则此时溶液中的c(H+)=
)=2∶1,则此时溶液中的c(H+)=
您最近一年使用:0次



