近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与储存,过程如下:
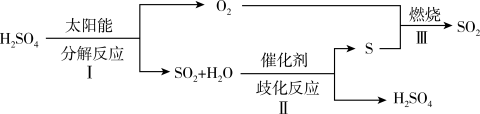
(1)反应I由两步反应完成:a. H2SO4(l) SO3(g)+H2O(g) △H1 = +177 kJ/mol
SO3(g)+H2O(g) △H1 = +177 kJ/mol
b. 2SO3(g) 2SO2(g) +O2(g) △H2 = +197 kJ/mol
2SO2(g) +O2(g) △H2 = +197 kJ/mol
①请写出反应I的热化学反应方程式:_________________________________ 。
②硫酸工业中可通过反应b的逆反应合成SO3,下表列出了不同温度、压强下SO2的平衡转化率:
在实际生产中,选定温度为400~500 ℃的原因是_________________ ;选定压强为常压的原因是_____________________ 。
(2) 可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:
可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:
i.SO2+4I-+4H+= S↓+2I2+2H2O ii.
某实验小组为探究i、ii反应速率与SO2歧化反应速率的关系,进行如下实验:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①请补全反应ii:___________________________________ 。
②比较A、B、C,可得出的结论是:______________________ 。
③D是A的对比实验,则a=__________ 。
④实验表明,SO2的歧化反应速率D>A,则反应速率:i____ ii(填“>”、“=”或“<”)。

(1)反应I由两步反应完成:a. H2SO4(l)
 SO3(g)+H2O(g) △H1 = +177 kJ/mol
SO3(g)+H2O(g) △H1 = +177 kJ/molb. 2SO3(g)
 2SO2(g) +O2(g) △H2 = +197 kJ/mol
2SO2(g) +O2(g) △H2 = +197 kJ/mol①请写出反应I的热化学反应方程式:
②硫酸工业中可通过反应b的逆反应合成SO3,下表列出了不同温度、压强下SO2的平衡转化率:
温度/℃ | SO2的平衡转化率/% | ||||
0.1 MPa | 0.5 MPa | 1 MPa | 5 MPa | 10 MPa | |
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
在实际生产中,选定温度为400~500 ℃的原因是
(2)
 可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:
可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:i.SO2+4I-+4H+= S↓+2I2+2H2O ii.
某实验小组为探究i、ii反应速率与SO2歧化反应速率的关系,进行如下实验:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
A | B | C | D | |
试剂组成 | 0.4 mol/L KI | 0.4 mol/L KI 0.2 mol/L H2SO4 | 0.2 mol/L H2SO4 | 0.2 mol/L KI a mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色成黄色,出现浑浊较A快 |
①请补全反应ii:
②比较A、B、C,可得出的结论是:
③D是A的对比实验,则a=
④实验表明,SO2的歧化反应速率D>A,则反应速率:i
更新时间:2022-11-19 23:38:10
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】用 可以消除氮氧化物的污染,发生的反应为
可以消除氮氧化物的污染,发生的反应为 。将
。将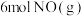 和
和 通入
通入 恒容密闭容器中,在一定温度下发生上述反应,各组分的物质的量浓度随时间的变化曲线如图所示。
恒容密闭容器中,在一定温度下发生上述反应,各组分的物质的量浓度随时间的变化曲线如图所示。

(1)
_______ 。
(2)曲线②表示的是_______ (填“NO”“ ”“
”“ ”或“
”或“ ”)的浓度随时间的变化。
”)的浓度随时间的变化。
(3)图中达到平衡的点是_______ (填“A”“B”“C”或“D”)。
(4)A点时,NO的转化率为_______ (转化率是指已被转化的反应物的物质的量与其初始的物质的量之比)。
(5)10min末,其他条件不变,采用下列措施一定能加快上述反应速率的是_______(填字母)。
(6)起始的压强与平衡时的压强之比为_______ (用分数表示),平衡时,混合气体的平均摩尔质量是_______ (保留两位小数)。
 可以消除氮氧化物的污染,发生的反应为
可以消除氮氧化物的污染,发生的反应为 。将
。将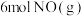 和
和 通入
通入 恒容密闭容器中,在一定温度下发生上述反应,各组分的物质的量浓度随时间的变化曲线如图所示。
恒容密闭容器中,在一定温度下发生上述反应,各组分的物质的量浓度随时间的变化曲线如图所示。
(1)

(2)曲线②表示的是
 ”“
”“ ”或“
”或“ ”)的浓度随时间的变化。
”)的浓度随时间的变化。(3)图中达到平衡的点是
(4)A点时,NO的转化率为
(5)10min末,其他条件不变,采用下列措施一定能加快上述反应速率的是_______(填字母)。
| A.升高体系的温度 | B.充入一定量的 |
| C.将容器体积变为5L | D.充入一定量氦气 |
您最近一年使用:0次
【推荐2】甲醛(HCHO)俗称蚁醛,在化工、医药、农药等方面有广泛的应用。
I·甲醛的制备
工业上利用甲醇脱氢法制备甲醛,已知:CH3OH(g) HCHO(g)+H2(g) △H
HCHO(g)+H2(g) △H
(1)该反应的能量变化如图甲所示,△H=___ kJ•mol-1。

(2)为提高CH3OH转化率,采取的措施有___ 、___ ;在温恒容条件下,该反应达到平衡状态的标志有___ (填标号)。
a.混合气体的密度保持不变
b.混合气体的总压强保持不变
c.v(CH3OH)消耗=v(H2)生成
d.甲醛的浓度保持不变
(3)选用Ag/SiO2—ZnO作催化剂,在400~750℃区间进行活性评价,图乙给出了甲醇转化率与甲醛选择性(选择性越大,表示生成该物质越多)随反应温度的变化曲线。制备甲醛的最佳反应温度为___ (填标号),理由是___ 。
a.400℃b.650℃c.700℃d.750℃

(4)T℃时,在2L恒容密闭容器中充入1mol甲醇,发生反应:
①CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
②CH3OH(g) CO(g)+2H2(g)
CO(g)+2H2(g)
平衡时甲醇为0.2mol,甲醛为0.7mol。则反应i的平衡常数K=___ 。
II.甲醛的用途
(5)将甲醛水溶液与硫酸镍(NiSO4)溶液混合,可用于化学镀镍。反应过程中有CO2产生,则该反应的离子方程式为___ :若收集到112mLCO2(标准状况),理论上转移电子___ mol。
I·甲醛的制备
工业上利用甲醇脱氢法制备甲醛,已知:CH3OH(g)
 HCHO(g)+H2(g) △H
HCHO(g)+H2(g) △H(1)该反应的能量变化如图甲所示,△H=

(2)为提高CH3OH转化率,采取的措施有
a.混合气体的密度保持不变
b.混合气体的总压强保持不变
c.v(CH3OH)消耗=v(H2)生成
d.甲醛的浓度保持不变
(3)选用Ag/SiO2—ZnO作催化剂,在400~750℃区间进行活性评价,图乙给出了甲醇转化率与甲醛选择性(选择性越大,表示生成该物质越多)随反应温度的变化曲线。制备甲醛的最佳反应温度为
a.400℃b.650℃c.700℃d.750℃

(4)T℃时,在2L恒容密闭容器中充入1mol甲醇,发生反应:
①CH3OH(g)
 HCHO(g)+H2(g)
HCHO(g)+H2(g)②CH3OH(g)
 CO(g)+2H2(g)
CO(g)+2H2(g)平衡时甲醇为0.2mol,甲醛为0.7mol。则反应i的平衡常数K=
II.甲醛的用途
(5)将甲醛水溶液与硫酸镍(NiSO4)溶液混合,可用于化学镀镍。反应过程中有CO2产生,则该反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________ 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
①上表判断NaHSO3溶液显______ 性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
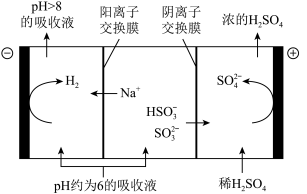
①HSO3-在阳极放电的电极反应式是_______________ 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO₃²﹣):n(HSO₃﹣) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:

①HSO3-在阳极放电的电极反应式是
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
您最近一年使用:0次
【推荐1】氢燃料电池汽车是未来汽车发展的重要方向之一。二甲醚重整制氢技术是一种理想制氢方案。
(1)1mol二甲醚CH3OCH3(g)与水蒸气发生可逆反应,生成CO2(g)和H2(g)的化学方程式为________________ 。
(2)根据下列两个热化学方程式,计算上述反应的反应热∆H=__________ kJ·mol-1。
反应I:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) ∆H1=+37 kJ·mol-1
反应Ⅱ:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ∆H2=+49 kJ·mol-1
升高温度,反应速率_______ (填“变大”、“变小”或“不变”);根据以上反应判断,可采取_____________ (合理措施)来提高二甲醚的转化率(写一条)。
(3)在一个恒压 (起始体积为3 L)的密闭容器中充入2 mol CH3OH(g)和1 mol H2O(g),仅研究反应Ⅱ。CH3OH的平衡含量随温度、压强的变化如图所示。_______ P2(填“>”、“<”);B、C两点平衡常数KB_______ KC(填“>”、“<”或“=”);A点体积变为______ L,此时平衡常数KA的计算表达式为____________ (列式即可)。
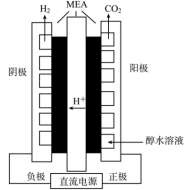
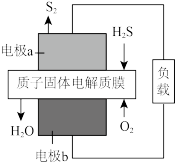
(4)我国科学家开发了一种运用质子交换膜的电解甲醇制氢装置(见图),甲醇的电解电压相对于水可降低近2/3,降低了制氢的能耗。写出阳极电极反应式______________ 。
(1)1mol二甲醚CH3OCH3(g)与水蒸气发生可逆反应,生成CO2(g)和H2(g)的化学方程式为
(2)根据下列两个热化学方程式,计算上述反应的反应热∆H=
反应I:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) ∆H1=+37 kJ·mol-1
反应Ⅱ:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ∆H2=+49 kJ·mol-1
升高温度,反应速率
(3)在一个

(4)我国科学家开发了一种运用质子交换膜的电解甲醇制氢装置(见图),甲醇的电解电压相对于水可降低近2/3,降低了制氢的能耗。写出阳极电极反应式
您最近一年使用:0次
【推荐2】请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇。已知: 800℃时
反应①:2H2(g)+CO(g) CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol
反应②:H2(g)+CO2(g) H2O(g)+CO(g) △H=+41.2kJ/mol
H2O(g)+CO(g) △H=+41.2kJ/mol
(1)写出用CO2与H2反应制备甲醇的热化学方程式___________________________________ 。
(2)对于反应①,在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1所示。据此判断
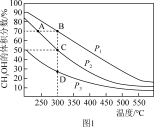
①压强P1_____ P2(填“>”“<”或“=”,下同)
②平衡常数K(状态C)_____ K(状态D)
③反应速率:V逆(状态A)_____ V逆(状态B)
(3)对于反应②,在体积一定的密闭容器中加入一定量的H2和CO。进行反应。下列说法正确的是______ 。
A.若该反应在恒容,绝热的容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量,△H的值不发生变化
D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比[n(H2)/n(CO2)]=X,当X=2或1/2时,H2O的体积分数不变。
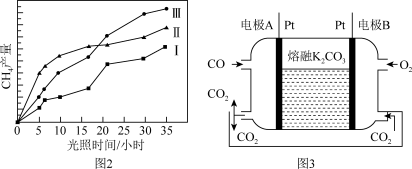
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如下图2所示,在0-15h内,对反应催化效果最好的催化剂是____________ (填序号)。
(5)一种新利CO燃料电池工作原理如上图3所示,该电池负极电极反应式为______________ ,电极A处产生的CO2有部分参与循环利用,其利用率为______________________ 。
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇。已知: 800℃时
反应①:2H2(g)+CO(g)
 CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol反应②:H2(g)+CO2(g)
 H2O(g)+CO(g) △H=+41.2kJ/mol
H2O(g)+CO(g) △H=+41.2kJ/mol(1)写出用CO2与H2反应制备甲醇的热化学方程式
(2)对于反应①,在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1所示。据此判断

①压强P1
②平衡常数K(状态C)
③反应速率:V逆(状态A)
(3)对于反应②,在体积一定的密闭容器中加入一定量的H2和CO。进行反应。下列说法正确的是
A.若该反应在恒容,绝热的容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量,△H的值不发生变化
D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比[n(H2)/n(CO2)]=X,当X=2或1/2时,H2O的体积分数不变。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如下图2所示,在0-15h内,对反应催化效果最好的催化剂是

(5)一种新利CO燃料电池工作原理如上图3所示,该电池负极电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)已知:①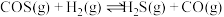

②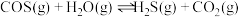
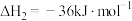
③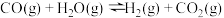

则
___________ 。
(2)用 和
和 生产
生产 的反应为:
的反应为: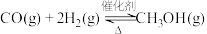
 。在10L的恒容密闭容器中按物质的量之比
。在10L的恒容密闭容器中按物质的量之比 充入
充入 和
和 ,测得
,测得 的转化率随温度的变化及不同压强下
的转化率随温度的变化及不同压强下 的转化率变化如图所示,
的转化率变化如图所示, 和200℃时
和200℃时 随时间变化结果如表所示。
随时间变化结果如表所示。

 和200℃时
和200℃时 随时间变化
随时间变化
①
___________ 0(填“<”“=”或“>”)。
②在 和200℃时,反应0~4min内,用
和200℃时,反应0~4min内,用 表示的平均反应速率
表示的平均反应速率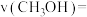
___________ ,200℃时该反应的平衡常数K=___________ 。
③200℃时,将容器的容积压缩到原来的 ,在其他条件不变的情况下,对平衡体系产生的影响是
,在其他条件不变的情况下,对平衡体系产生的影响是___________ (填字母)。
A. 减少
减少
B.正反应速率加快,逆反应速率减慢
C. 的物质的量增加
的物质的量增加
D.重新平衡时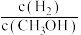 减小
减小
(3) 燃料电池的原理如图所示,负极的电极反应式为
燃料电池的原理如图所示,负极的电极反应式为___________ 。
(4)写出用惰性电极电解 溶液的离子方程式:
溶液的离子方程式:___________ 。
(1)已知:①
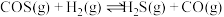

②
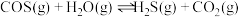
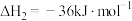
③
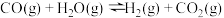

则

(2)用
 和
和 生产
生产 的反应为:
的反应为: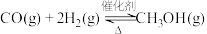
 。在10L的恒容密闭容器中按物质的量之比
。在10L的恒容密闭容器中按物质的量之比 充入
充入 和
和 ,测得
,测得 的转化率随温度的变化及不同压强下
的转化率随温度的变化及不同压强下 的转化率变化如图所示,
的转化率变化如图所示, 和200℃时
和200℃时 随时间变化结果如表所示。
随时间变化结果如表所示。
 和200℃时
和200℃时 随时间变化
随时间变化 | 0 | 2 | 4 | 6 |
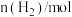 | 8 | 5 | 4 | 4 |

②在
 和200℃时,反应0~4min内,用
和200℃时,反应0~4min内,用 表示的平均反应速率
表示的平均反应速率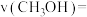
③200℃时,将容器的容积压缩到原来的
 ,在其他条件不变的情况下,对平衡体系产生的影响是
,在其他条件不变的情况下,对平衡体系产生的影响是A.
 减少
减少B.正反应速率加快,逆反应速率减慢
C.
 的物质的量增加
的物质的量增加D.重新平衡时
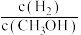 减小
减小(3)
 燃料电池的原理如图所示,负极的电极反应式为
燃料电池的原理如图所示,负极的电极反应式为
(4)写出用惰性电极电解
 溶液的离子方程式:
溶液的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铋(Bi)的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含FeS2、CuO、SiO2等杂质)制备NaBiO3的工艺流程如下:
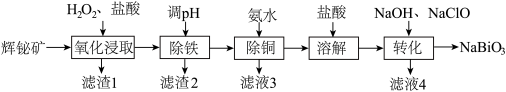
已知: i. Bi3+易水解。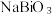 难溶于冷水。
难溶于冷水。
ⅱii.“氧化浸取”时,铋元素转化为Bi3+,硫元素转化为硫单质。
回答下列问题:
(1)为提高“浸取”速率,采取的措施有:升高温度、___________ (写出一条)。辉铋矿浸取率随温度的变化曲线如图,高于40℃时浸取率快速下降,其可能的原因是___________ 。(答两条原因)

(2)“氧化浸取”时,H2O2和FeS2发生反应的物质的量之比为___________ 。
(3)“除铜”时发生反应: 。当NH3分子与Cu2+形成配离子后,N-H键之间的夹角将
。当NH3分子与Cu2+形成配离子后,N-H键之间的夹角将___________ (填“变大”、“变小”或“不变”)。
(4)“转化”时,生成NaBiO3的离子方程式为___________ 。
(5)已知酸性环境下,NaBiO3可以将Mn2+氧化成 (
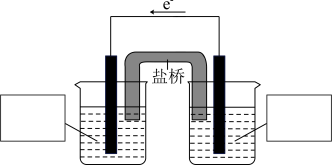
( 被还原成Bi3+)。请设计一个原电池装置来证明这一点,在下图中的两个方框内标出两烧杯溶液中溶质的化学式,并写出正极的电极反应式:
被还原成Bi3+)。请设计一个原电池装置来证明这一点,在下图中的两个方框内标出两烧杯溶液中溶质的化学式,并写出正极的电极反应式:___________ 。(左侧烧杯中已经加入了硫酸)

已知: i. Bi3+易水解。
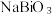 难溶于冷水。
难溶于冷水。ⅱii.“氧化浸取”时,铋元素转化为Bi3+,硫元素转化为硫单质。
回答下列问题:
(1)为提高“浸取”速率,采取的措施有:升高温度、

(2)“氧化浸取”时,H2O2和FeS2发生反应的物质的量之比为
(3)“除铜”时发生反应:
 。当NH3分子与Cu2+形成配离子后,N-H键之间的夹角将
。当NH3分子与Cu2+形成配离子后,N-H键之间的夹角将(4)“转化”时,生成NaBiO3的离子方程式为
(5)已知酸性环境下,NaBiO3可以将Mn2+氧化成
 (
( 被还原成Bi3+)。请设计一个原电池装置来证明这一点,在下图中的两个方框内标出两烧杯溶液中溶质的化学式,并写出正极的电极反应式:
被还原成Bi3+)。请设计一个原电池装置来证明这一点,在下图中的两个方框内标出两烧杯溶液中溶质的化学式,并写出正极的电极反应式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
(1)实验1:取一支试管,向其中加入5mL 0.1mol/L的 溶液,另取一支试管加入5mL 0.1mol/L
溶液,另取一支试管加入5mL 0.1mol/L  溶液,将上述两支试管的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,反应的离子方程式为
溶液,将上述两支试管的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,反应的离子方程式为___________ 。记录“+”完全看不见的时间为 。
。
(2)实验2:取一支试管,向其中加入5mL 0.5mol/L的 溶液,另取一支试管加入5mL 0.1mol/L
溶液,另取一支试管加入5mL 0.1mol/L  溶液,将上述两支试管的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,记录“+”完全看不见的时间为
溶液,将上述两支试管的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,记录“+”完全看不见的时间为 。
。 ,则表明,增大反应物的浓度,反应速率
,则表明,增大反应物的浓度,反应速率___________ 。
(3)实验3:取一支试管,向其中加入5mL 0.1mol/L的 溶液,另取一支试管加入5mL 0.1mol/L
溶液,另取一支试管加入5mL 0.1mol/L  溶液,将上述两支试管同时放入盛冰水的烧杯中5分钟,然后将两支试管中的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,记录“+”完全看不见的时间为
溶液,将上述两支试管同时放入盛冰水的烧杯中5分钟,然后将两支试管中的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,记录“+”完全看不见的时间为 。
。
实验4:取一支试管,向其中加入5mL 0.1mol/L的 溶液,另取一支试管加入5mL 0.1mol/L
溶液,另取一支试管加入5mL 0.1mol/L  溶液,将上述两支试管同时放入盛50℃的热水的烧杯中5分钟,然后将两支试管中的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,记录“+”完全看不见的时间为
溶液,将上述两支试管同时放入盛50℃的热水的烧杯中5分钟,然后将两支试管中的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,记录“+”完全看不见的时间为 。
。
由实验(3)和实验(4)测得
___________  (填“大于”“等于”或“小于”),则表明,升高温度,反应速率
(填“大于”“等于”或“小于”),则表明,升高温度,反应速率___________ 。
(4)锥形瓶内装入10mL左右10%的 ,观察溶液中有少量气泡产生;向其中加入少量
,观察溶液中有少量气泡产生;向其中加入少量 ,则迅速产生大量气泡,气体使带火星的木条复燃。该实验表明,使用催化剂,反应速率
,则迅速产生大量气泡,气体使带火星的木条复燃。该实验表明,使用催化剂,反应速率___________ ,反应的化学方程式为___________ 。
(5)如果将 溶液和
溶液和 混合,硫元素被氧化成最高化合价,则反应的离子方程式为
混合,硫元素被氧化成最高化合价,则反应的离子方程式为___________ 。
(1)实验1:取一支试管,向其中加入5mL 0.1mol/L的
 溶液,另取一支试管加入5mL 0.1mol/L
溶液,另取一支试管加入5mL 0.1mol/L  溶液,将上述两支试管的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,反应的离子方程式为
溶液,将上述两支试管的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,反应的离子方程式为 。
。(2)实验2:取一支试管,向其中加入5mL 0.5mol/L的
 溶液,另取一支试管加入5mL 0.1mol/L
溶液,另取一支试管加入5mL 0.1mol/L  溶液,将上述两支试管的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,记录“+”完全看不见的时间为
溶液,将上述两支试管的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,记录“+”完全看不见的时间为 。
。 ,则表明,增大反应物的浓度,反应速率
,则表明,增大反应物的浓度,反应速率(3)实验3:取一支试管,向其中加入5mL 0.1mol/L的
 溶液,另取一支试管加入5mL 0.1mol/L
溶液,另取一支试管加入5mL 0.1mol/L  溶液,将上述两支试管同时放入盛冰水的烧杯中5分钟,然后将两支试管中的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,记录“+”完全看不见的时间为
溶液,将上述两支试管同时放入盛冰水的烧杯中5分钟,然后将两支试管中的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,记录“+”完全看不见的时间为 。
。实验4:取一支试管,向其中加入5mL 0.1mol/L的
 溶液,另取一支试管加入5mL 0.1mol/L
溶液,另取一支试管加入5mL 0.1mol/L  溶液,将上述两支试管同时放入盛50℃的热水的烧杯中5分钟,然后将两支试管中的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,记录“+”完全看不见的时间为
溶液,将上述两支试管同时放入盛50℃的热水的烧杯中5分钟,然后将两支试管中的溶液同时倒入一个小烧杯中(小烧杯底部外面贴上一个写有“+”的标记),开始记录反应的时间,溶液开始出现乳白色浑浊,随着时间的延长,产生淡黄色沉淀的浑浊,记录“+”完全看不见的时间为 。
。由实验(3)和实验(4)测得

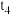 (填“大于”“等于”或“小于”),则表明,升高温度,反应速率
(填“大于”“等于”或“小于”),则表明,升高温度,反应速率(4)锥形瓶内装入10mL左右10%的
 ,观察溶液中有少量气泡产生;向其中加入少量
,观察溶液中有少量气泡产生;向其中加入少量 ,则迅速产生大量气泡,气体使带火星的木条复燃。该实验表明,使用催化剂,反应速率
,则迅速产生大量气泡,气体使带火星的木条复燃。该实验表明,使用催化剂,反应速率(5)如果将
 溶液和
溶液和 混合,硫元素被氧化成最高化合价,则反应的离子方程式为
混合,硫元素被氧化成最高化合价,则反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】落实“双碳”目标,发展绿色能源,首先是对氢能源的开发利用。利用甲烷制氢是当前研究的热点。涉及的反应如下:
反应Ⅰ: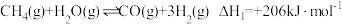
反应Ⅱ: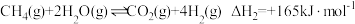
反应Ⅲ:
回答下列问题:
(1)反应Ⅰ的活化能为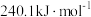 ,反应Ⅰ逆反应的活化能为
,反应Ⅰ逆反应的活化能为_______  。研究发现,以单一负载型
。研究发现,以单一负载型 催化反应Ⅰ时,反应Ⅰ的逆反应在催化剂表面存在两种活性中心,分别以“*”和“#”表示,在活性位“*”上发生
催化反应Ⅰ时,反应Ⅰ的逆反应在催化剂表面存在两种活性中心,分别以“*”和“#”表示,在活性位“*”上发生 吸附,在活性位“#”上被吸附的
吸附,在活性位“#”上被吸附的 发生分解反应生成表面碳,表面碳再与
发生分解反应生成表面碳,表面碳再与 结合生成
结合生成 ,其催化反应机理的反应式如下:
,其催化反应机理的反应式如下:
ⅰ.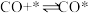 快速平衡
快速平衡
ⅱ.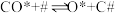 慢反应
慢反应
ⅲ.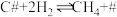 快反应
快反应
ⅳ._______ 快反应
反应ⅳ的反应式为_______ ;反应Ⅰ逆反应的决速步骤是_______ (填反应序号)。
(2) 时,在某密闭容器中通入一定量的
时,在某密闭容器中通入一定量的 和
和 ,加入金属镍做催化剂,在一定温度下发生上述反应。
,加入金属镍做催化剂,在一定温度下发生上述反应。
①为提高 的平衡转化率,除改变温度外,还可以采取的措施是
的平衡转化率,除改变温度外,还可以采取的措施是_______ 。
②恒温恒容条件下,起始时 和
和 的浓度分别为
的浓度分别为 和
和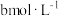 ,达平衡时
,达平衡时 和
和 的浓度分别为
的浓度分别为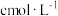 和
和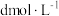 。达平衡时,
。达平衡时, 的浓度是
的浓度是_______  ,反应Ⅰ的平衡常数K是
,反应Ⅰ的平衡常数K是_______ 。(用含a、b、c、d的代数式表示)
③在该温度下,反应Ⅲ的标准平衡常数
_______ 。[已知:分压=总压×该组分物质的量分数,对于反应 ,
,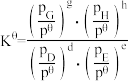 ,其中
,其中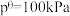 ,
,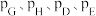 为各组分的平衡分压]
为各组分的平衡分压]
(3)在某一给定进料比的情况下,温度、压强对平衡体系中 物质的量分数的影响如下图:
物质的量分数的影响如下图:
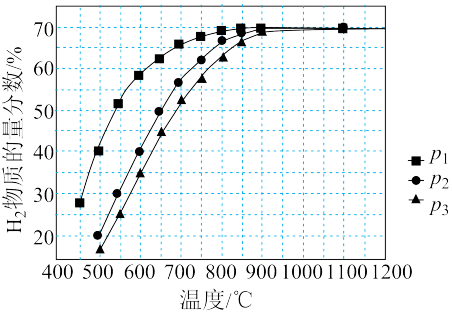
压强由大到小的顺序为_______ ,体系温度未达到 时,
时, 物质的量分数几乎为0的原因是
物质的量分数几乎为0的原因是_______ 。
反应Ⅰ:
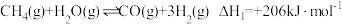
反应Ⅱ:
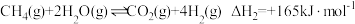
反应Ⅲ:

回答下列问题:
(1)反应Ⅰ的活化能为
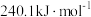 ,反应Ⅰ逆反应的活化能为
,反应Ⅰ逆反应的活化能为 。研究发现,以单一负载型
。研究发现,以单一负载型 催化反应Ⅰ时,反应Ⅰ的逆反应在催化剂表面存在两种活性中心,分别以“*”和“#”表示,在活性位“*”上发生
催化反应Ⅰ时,反应Ⅰ的逆反应在催化剂表面存在两种活性中心,分别以“*”和“#”表示,在活性位“*”上发生 吸附,在活性位“#”上被吸附的
吸附,在活性位“#”上被吸附的 发生分解反应生成表面碳,表面碳再与
发生分解反应生成表面碳,表面碳再与 结合生成
结合生成 ,其催化反应机理的反应式如下:
,其催化反应机理的反应式如下:ⅰ.
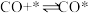 快速平衡
快速平衡ⅱ.
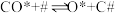 慢反应
慢反应ⅲ.
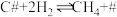 快反应
快反应ⅳ._______ 快反应
反应ⅳ的反应式为
(2)
 时,在某密闭容器中通入一定量的
时,在某密闭容器中通入一定量的 和
和 ,加入金属镍做催化剂,在一定温度下发生上述反应。
,加入金属镍做催化剂,在一定温度下发生上述反应。①为提高
 的平衡转化率,除改变温度外,还可以采取的措施是
的平衡转化率,除改变温度外,还可以采取的措施是②恒温恒容条件下,起始时
 和
和 的浓度分别为
的浓度分别为 和
和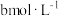 ,达平衡时
,达平衡时 和
和 的浓度分别为
的浓度分别为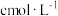 和
和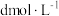 。达平衡时,
。达平衡时, 的浓度是
的浓度是 ,反应Ⅰ的平衡常数K是
,反应Ⅰ的平衡常数K是③在该温度下,反应Ⅲ的标准平衡常数

 ,
,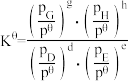 ,其中
,其中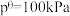 ,
,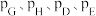 为各组分的平衡分压]
为各组分的平衡分压](3)在某一给定进料比的情况下,温度、压强对平衡体系中
 物质的量分数的影响如下图:
物质的量分数的影响如下图:
压强由大到小的顺序为
 时,
时, 物质的量分数几乎为0的原因是
物质的量分数几乎为0的原因是
您最近一年使用:0次



