解题方法
1 . 自热化学链重整制氢 工艺的原理如图所示:
工艺的原理如图所示:
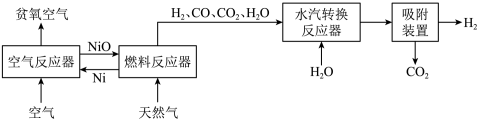
回答下列问题:
(1)25℃、101 时,5.9g
时,5.9g 与足量
与足量 反应生成
反应生成 放出47.2
放出47.2 的热量,则在“空气反应器”中发生反应的热化学方程式为
的热量,则在“空气反应器”中发生反应的热化学方程式为_______ 。
(2)“燃料反应器”中发生的部分反应有:
(Ⅰ)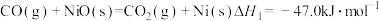
(Ⅱ)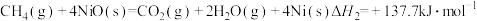
(Ⅲ)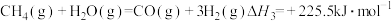
则反应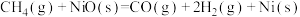 的
的
_______  。
。
(3)“水汽转换反应器”中发生的反应为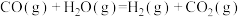 (平衡常数
(平衡常数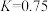 ),将天然气看作是纯净的
),将天然气看作是纯净的 (假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻
(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻 、
、 、
、 、
、 浓度之比为
浓度之比为 此时
此时
_______ 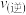 (填“>”、“=”或“<”),理由是
(填“>”、“=”或“<”),理由是_______ 。
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等, 工艺重整是一种联合重整,涉及反应的热化学方程式如下:
工艺重整是一种联合重整,涉及反应的热化学方程式如下:
水蒸气重整反应: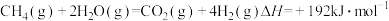
部分氧化重整反应: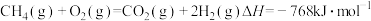
采用水蒸气重整的优点是_______ ;若上述两个反应在保持自热条件下(假设无热量损失),理论上1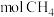 至多可获得
至多可获得 的物质的量为
的物质的量为_______ (结果保留1位小数)。
 工艺的原理如图所示:
工艺的原理如图所示:
回答下列问题:
(1)25℃、101
 时,5.9g
时,5.9g 与足量
与足量 反应生成
反应生成 放出47.2
放出47.2 的热量,则在“空气反应器”中发生反应的热化学方程式为
的热量,则在“空气反应器”中发生反应的热化学方程式为(2)“燃料反应器”中发生的部分反应有:
(Ⅰ)
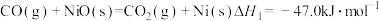
(Ⅱ)
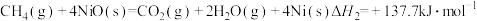
(Ⅲ)
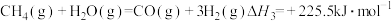
则反应
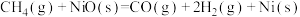 的
的
 。
。(3)“水汽转换反应器”中发生的反应为
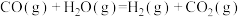 (平衡常数
(平衡常数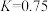 ),将天然气看作是纯净的
),将天然气看作是纯净的 (假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻
(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻 、
、 、
、 、
、 浓度之比为
浓度之比为 此时
此时
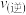 (填“>”、“=”或“<”),理由是
(填“>”、“=”或“<”),理由是(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等,
 工艺重整是一种联合重整,涉及反应的热化学方程式如下:
工艺重整是一种联合重整,涉及反应的热化学方程式如下:水蒸气重整反应:
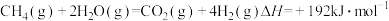
部分氧化重整反应:
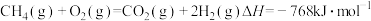
采用水蒸气重整的优点是
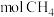 至多可获得
至多可获得 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
2 . 汽车尾气中含有上百种不同的化合物,其中的污染物有固体悬浮微粒、一氧化碳、二氧化碳、碳氢化合物、氮氧化合物等。汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应:N2(g) + O2(g) ⇌ 2NO(g),是导致汽车尾气中含有 NO 的原因之一。
(1)已知H2或 CO 可以催化还原 NO 以达到消除污染的目的。
N2(g) + O2(g) = 2NO(g) ΔH = + 180.5 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) ΔH = - 571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成 N2(g)和H2O(l)的热化学方程式是________ , 判断该反应自发进行的条件:_____ (填“高温自发”或“低温自发”)。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应 2NO(g) + 2CO(g) 2CO2(g) + N2(g) 中 NO 的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中 NO 的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
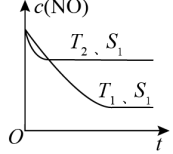
①则该反应 ΔH_____ 0(填“>”或“<”)。
②若催化剂的表面积 S1 > S2,在该图中画出 c(NO)在 T1、S2条件下达到平衡过程中的变化曲线_____________ 。
(3)某研究小组往一恒温恒压容器充入 9 mol N2和 23 mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在 T2、60 MPa 下达到平衡。
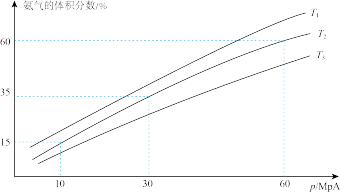
此时N2的平衡分压为_____ MPa。(分压 = 总压 × 物质的量分数)。计算出此时的平衡常数 Kp =_____ (用平衡分压代替平衡浓度计算,结果保留 2 位有效数字)。
(1)已知H2或 CO 可以催化还原 NO 以达到消除污染的目的。
N2(g) + O2(g) = 2NO(g) ΔH = + 180.5 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) ΔH = - 571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成 N2(g)和H2O(l)的热化学方程式是
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图表示在其他条件不变时,反应 2NO(g) + 2CO(g)
 2CO2(g) + N2(g) 中 NO 的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中 NO 的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①则该反应 ΔH
②若催化剂的表面积 S1 > S2,在该图中画出 c(NO)在 T1、S2条件下达到平衡过程中的变化曲线
(3)某研究小组往一恒温恒压容器充入 9 mol N2和 23 mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在 T2、60 MPa 下达到平衡。

此时N2的平衡分压为
您最近一年使用:0次
名校
3 . 氨的合成原理为:N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。回答下列问题:
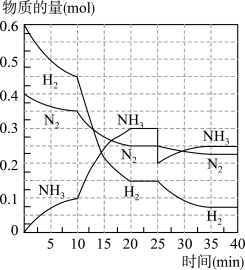
(1)10min内以NH3表示的平均反应速率为_________
(2)在10~20min内,NH3浓度变化的原因可能是_____________
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡:平衡常数K1=__________ (带数据的表达式),第2次平衡时NH3的体积分数为_____________ 。
(4)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fc2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)⇌2NH3+1.5O2(g)∆H=akJ·mol-1,进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
①此合成反应的a______ 0,△S_______ 0;(填“>”、“<”或一”)
②已知N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1,2 H2(g)+ O2(g)=2H2O(l) ∆H=-571.kJ·mol-1 则常温下氮气与水反应生成氨气与氧气的热化学方程式为_____________________________

(1)10min内以NH3表示的平均反应速率为
(2)在10~20min内,NH3浓度变化的原因可能是
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡:平衡常数K1=
(4)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fc2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)⇌2NH3+1.5O2(g)∆H=akJ·mol-1,进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a
②已知N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1,2 H2(g)+ O2(g)=2H2O(l) ∆H=-571.kJ·mol-1 则常温下氮气与水反应生成氨气与氧气的热化学方程式为
您最近一年使用:0次
2019-10-28更新
|
188次组卷
|
2卷引用:湖北省随州一中2019-2020学年高二上学期期中考试化学试题
名校
解题方法
4 . CO2的转化一直是全球研究的热点,其中将CO2和H2合成甲醇及二甲醚具备相对成熟的技术。工业生产中,有以下相关反应(热效应都是在25 ℃,1.01105Pa下测定):
①CO2(g) + 3H2(g) ⇌CH3OH(l) + H2O(l) ΔH =-49.01 kJ·mol-1
②2CH3OH(l)⇌CH3OCH3(g) + H2O(l) ΔH =-24.52 kJ·mol-1
③CO(g) + H2O(l)⇌CO2(g) + H2(g) ΔH = -41.17 kJ·mol-1
(1)工业上用CO2和H2合成二甲醚的热化学方程式为_______ 。
(2)反应①的平衡常数表达式K=_______ 。
(3)在一常温恒容的密闭容器中,放入一定量的甲醇发生如②式化学反应并建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据的是_______ (填字母)。
A.容器内气体相对分子质量保持不变 B. 容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍 D.甲醇和二甲醚物质的量相等
(4)在三个体积相同的密闭容器中加入相同物质的量的CO和H2O,在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如图:
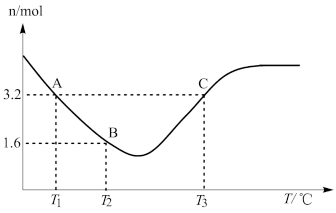
I.A、C两点的速率大小v(A)_______ (填“大于”“小于”“等于”或“无 法判断”)v(C)。
II.请解释曲线中CO的物质的量先减小后增大的原因_______ 。
①CO2(g) + 3H2(g) ⇌CH3OH(l) + H2O(l) ΔH =-49.01 kJ·mol-1
②2CH3OH(l)⇌CH3OCH3(g) + H2O(l) ΔH =-24.52 kJ·mol-1
③CO(g) + H2O(l)⇌CO2(g) + H2(g) ΔH = -41.17 kJ·mol-1
(1)工业上用CO2和H2合成二甲醚的热化学方程式为
(2)反应①的平衡常数表达式K=
(3)在一常温恒容的密闭容器中,放入一定量的甲醇发生如②式化学反应并建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据的是
A.容器内气体相对分子质量保持不变 B. 容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍 D.甲醇和二甲醚物质的量相等
(4)在三个体积相同的密闭容器中加入相同物质的量的CO和H2O,在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如图:

I.A、C两点的速率大小v(A)
II.请解释曲线中CO的物质的量先减小后增大的原因
您最近一年使用:0次
5 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=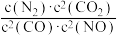 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:_______ ;下列措施能够增大此反应中NO的转化率的是(填字母代号)_______ 。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
①T1℃,0~5min内,以CO2表示的该反应速率v(CO2)=_______ ,该条件下的平衡常数K=_______ 。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______ 移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=_______ 。
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=
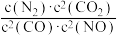 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
②第15 min后,温度调整到T2,数据变化如上表所示,则T1
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应
您最近一年使用:0次
2018-09-10更新
|
353次组卷
|
6卷引用:湖北省随州市第二高级中学2018-2019学年高二9月起点考试(B+C班)化学试题
名校
解题方法
6 . 亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为__________ 。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g) 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
则n=_________ ;k=___________ 。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
则该温度下,ΔH3=______ kJ/mol;K3=______ (用K1和K2表示)。
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=______ (填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)的变化如图曲线b所示,则改变的条件是_____________ ;K3=___________ L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________ (填“增大”、“减小”或“不变”)。
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为
(2)一定条件下,在密闭容器中发生反应:2NOCl(g)
 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:| 序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
| ① | 0.30 | 3.60×10-9 |
| ② | 0.60 | 1.44×10-8 |
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
| 序号 | 热化学方程式 | 平衡常数 |
| ① | 2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g) ΔH1=a kJ/mol NaNO3(s)+NOCl(g) ΔH1=a kJ/mol | K1 |
| ② | 4NO2(g)+2NaCl(s) 2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ/mol 2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ/mol | K2 |
| ③ | 2NO(g)+Cl2(g) 2NOCl(g) ΔH3 2NOCl(g) ΔH3 | K3 |
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=

您最近一年使用:0次
2018-05-26更新
|
334次组卷
|
2卷引用:湖北省随州市第二高级中学2018-2019学年高二9月起点考试(B+C班)化学试题
名校
解题方法
7 . S2Cl2和SCl2均为重要的化工原料。
已知:I.S2(l) + Cl2(g) S2Cl2(g) ΔH1;
S2Cl2(g) ΔH1;
II. S2Cl2 (g) +Cl2 (g) 2SCl2 (g) ΔH2;
2SCl2 (g) ΔH2;
III.相关化学键的键能如下表所示:
请回答下列问题:
(1) SCl2的结构式为______________________ 。
(2)若反应II正反应的活化能E=dkJ·mol-1,则逆反应的活化能E2=_______ kJ·mol-1(用含a、b、c、d的代数式表示)。
(3)—定压强下,向10 L密闭容器中充入1molS2Cl2和1mol Cl2,发生反应II。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示:
①A、B、C、D四点对应状态下,达到平衡状态的有____________ (填字母),理由为__________ 。
②ΔH2_______________ 0(填“>” “<” 或“=”)。
(4)已知:ΔH1<0。向恒容绝热的容器中加入一定量的S2(l)和Cl2(g),发生反应I,5 min时达到平衡。则3 min时容器内气体压强__________ (填“>” “<” 或“=”)5 min时的压强。
(5)—定温度下,在恒容密闭容器中发生反应I和反应II,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率_________ (填“增大”“减小”或“不变”),理由为_________________ 。
已知:I.S2(l) + Cl2(g)
 S2Cl2(g) ΔH1;
S2Cl2(g) ΔH1;II. S2Cl2 (g) +Cl2 (g)
 2SCl2 (g) ΔH2;
2SCl2 (g) ΔH2;III.相关化学键的键能如下表所示:
| 化学键 | S—S | S—Cl | Cl—Cl |
| 键能/kJ • mol-1 | a | b | c |
请回答下列问题:
(1) SCl2的结构式为
(2)若反应II正反应的活化能E=dkJ·mol-1,则逆反应的活化能E2=
(3)—定压强下,向10 L密闭容器中充入1molS2Cl2和1mol Cl2,发生反应II。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示:
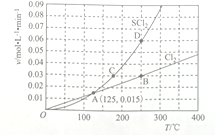
①A、B、C、D四点对应状态下,达到平衡状态的有
②ΔH2
(4)已知:ΔH1<0。向恒容绝热的容器中加入一定量的S2(l)和Cl2(g),发生反应I,5 min时达到平衡。则3 min时容器内气体压强
(5)—定温度下,在恒容密闭容器中发生反应I和反应II,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率
您最近一年使用:0次
2017-10-15更新
|
387次组卷
|
2卷引用:【全国百强校】湖北省随州市第一中学2018-2019学年高二上学期期中考试化学试题
名校
8 . 氮氧化物和碳氧化合物的综合治理是当前的重要课题之一。
已知:ⅰ.NO(g)+CO2(g) NO2(g)+CO(g) △H1=+234kJ·mol-1
NO2(g)+CO(g) △H1=+234kJ·mol-1
ⅱ.2NO(g)+2CO(g) N2(g)+2CO2(g) △H2=-745kJ·mol-1
N2(g)+2CO2(g) △H2=-745kJ·mol-1
(1)NO2(g)与CO(g)反应生成两种无毒气体的热化学方程式为______________ 。
(2)反应ⅰ的正反应的活化能E_____ △H1(填“>”、“<”或“=”)。
(3)一定压强下,密闭容器中发生反应ⅰ和反应ⅱ。达到平衡后,保持其他条件不变,升高温度,CO(g)的体积分数________ (填“增大”、“减少”或“无法确定”),原因为_____________________ 。
(4)向起始温度为t℃、容积为10L的恒容绝热的密闭容器中充入2molNO(g)和1molCO2(g),发生反应ⅰ。5min时达到平衡。则:
①下列事实能说明该反应达到平衡状态的是________ (填选项字母)
A.混合气体温度不变 B.混合气体的压强不变
C. NO2和CO的浓度之比为1: 1 D.混合气体的平均相对分子质量不变
②t℃时,向另一容积为10 L的恒温恒容的密闭容器中充入2 mol NO(g)和1 mol CO2(g),发生反应i。达到平衡的时间______ 5 min(填“>”、“<”或“=”)。
(5)在某密闭容器中充有10 mol CO(g)和20 mol NO(g),发生反应ii,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
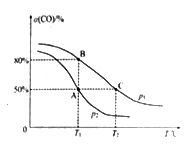
①A、B、C 三点的平衡常数KA、KB、KC的大小关系为________ ;p1和p2的大小关系为__________ 。
②A点时.测得容器的体积为10 L,则T1℃时,该反应平衡常数K的值为____________ 。
已知:ⅰ.NO(g)+CO2(g)
 NO2(g)+CO(g) △H1=+234kJ·mol-1
NO2(g)+CO(g) △H1=+234kJ·mol-1ⅱ.2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H2=-745kJ·mol-1
N2(g)+2CO2(g) △H2=-745kJ·mol-1(1)NO2(g)与CO(g)反应生成两种无毒气体的热化学方程式为
(2)反应ⅰ的正反应的活化能E
(3)一定压强下,密闭容器中发生反应ⅰ和反应ⅱ。达到平衡后,保持其他条件不变,升高温度,CO(g)的体积分数
(4)向起始温度为t℃、容积为10L的恒容绝热的密闭容器中充入2molNO(g)和1molCO2(g),发生反应ⅰ。5min时达到平衡。则:
①下列事实能说明该反应达到平衡状态的是
A.混合气体温度不变 B.混合气体的压强不变
C. NO2和CO的浓度之比为1: 1 D.混合气体的平均相对分子质量不变
②t℃时,向另一容积为10 L的恒温恒容的密闭容器中充入2 mol NO(g)和1 mol CO2(g),发生反应i。达到平衡的时间
(5)在某密闭容器中充有10 mol CO(g)和20 mol NO(g),发生反应ii,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①A、B、C 三点的平衡常数KA、KB、KC的大小关系为
②A点时.测得容器的体积为10 L,则T1℃时,该反应平衡常数K的值为
您最近一年使用:0次
2017-05-29更新
|
305次组卷
|
3卷引用:湖北省随州二中2019-2020学年高二上学期9月份月考化学试题



