1 . 环氧乙烷( ,简称
,简称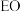 )是有机合成常用的试剂。
)是有机合成常用的试剂。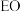 常温下易燃易爆,其爆炸极限为
常温下易燃易爆,其爆炸极限为 。工业上常用乙烯、氧气、氮气混合气投料的乙烯氧化法制备
。工业上常用乙烯、氧气、氮气混合气投料的乙烯氧化法制备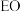 。涉及反应有:
。涉及反应有:

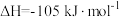
副反应:

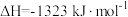
(1)主反应的活化能
 (正)
(正) (逆)(填“>”、“<”或“=”)。
(逆)(填“>”、“<”或“=”)。(2)已知
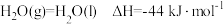 ,则
,则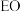 的燃烧热为
的燃烧热为
 。
。(3)在温度为T,压强为
 的环境下,欲提高乙烯的平衡转化率,理论上需
的环境下,欲提高乙烯的平衡转化率,理论上需(4)以Ag为催化剂的反应机理如下:
反应I:
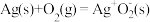 慢
慢反应Ⅱ:
 快
快反应Ⅲ:
 快
快①一定能够提高主反应反应速率的措施有
A.移出
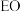 B.增大
B.增大 浓度 C.降低温度 D.增大
浓度 C.降低温度 D.增大 浓度
浓度②加入
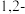 二氯乙烷会发生反应
二氯乙烷会发生反应 。一定条件下,反应经过一定时间后,
。一定条件下,反应经过一定时间后,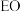 产率及选择性[
产率及选择性[ ]与
]与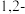 二氯乙烷浓度关系如图。
二氯乙烷浓度关系如图。
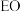 产率先增加后降低的原因可能是
产率先增加后降低的原因可能是(5)一定温度下,假定体系内只发生主反应,设
 的平衡分压为p,
的平衡分压为p, 的平衡转化率为x,用含p和x的代数式表示主反应的
的平衡转化率为x,用含p和x的代数式表示主反应的
您最近一年使用:0次
2024-04-29更新
|
53次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
解题方法
2 . “碳达峰·碳中和”是我国社会发展重大战略之一,以 、
、 为原料合成甲醇是实现“双碳”经济的有效途径之一,回答下列问题:
为原料合成甲醇是实现“双碳”经济的有效途径之一,回答下列问题:
已知:①
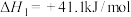
②
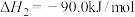
(1)以 、
、 为原料合成甲醇:
为原料合成甲醇: 。该反应的
。该反应的
___________  ,
,
_____ 0(填“>”“<”“=”),该反应在,该反应在______ 自发进行(填“高温”“低温”“任意温度”)。
(2) ℃时,向容积为2L的密闭容器中充入6mol
℃时,向容积为2L的密闭容器中充入6mol 和8mol
和8mol ,并加入催化剂合成甲醇:
,并加入催化剂合成甲醇: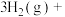
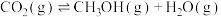 ,容器中
,容器中 的物质的量随时间变化如图中实线所示,图中虚线表示仅改变某一反应条件时,
的物质的量随时间变化如图中实线所示,图中虚线表示仅改变某一反应条件时, 的物质的量随时间的变化。
的物质的量随时间的变化。
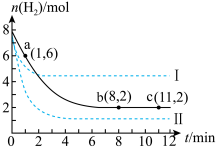
①该反应在0~8min内, 的平均反应速率是
的平均反应速率是___________ 。
②T℃时,该反应的化学平衡常数K=___________ 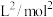 。
。
③曲线Ⅰ、Ⅱ改变的条件分别可能是___________ 、___________ 。
(3)在一定温度下的恒容密闭容器中,能说明 达到平衡状态的是
达到平衡状态的是___________ (填字母)。
a.容器中混合气体的密度不再改变 b.容器中的压强不再改变
c. 和
和 的浓度之比为3∶1 d.
的浓度之比为3∶1 d.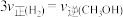
e.断裂3mol H−H键同时断裂3mol H−O键
 、
、 为原料合成甲醇是实现“双碳”经济的有效途径之一,回答下列问题:
为原料合成甲醇是实现“双碳”经济的有效途径之一,回答下列问题:已知:①

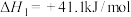
②

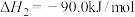
(1)以
 、
、 为原料合成甲醇:
为原料合成甲醇: 。该反应的
。该反应的
 ,
,
(2)
 ℃时,向容积为2L的密闭容器中充入6mol
℃时,向容积为2L的密闭容器中充入6mol 和8mol
和8mol ,并加入催化剂合成甲醇:
,并加入催化剂合成甲醇: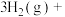
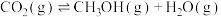 ,容器中
,容器中 的物质的量随时间变化如图中实线所示,图中虚线表示仅改变某一反应条件时,
的物质的量随时间变化如图中实线所示,图中虚线表示仅改变某一反应条件时, 的物质的量随时间的变化。
的物质的量随时间的变化。
①该反应在0~8min内,
 的平均反应速率是
的平均反应速率是②T℃时,该反应的化学平衡常数K=
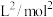 。
。③曲线Ⅰ、Ⅱ改变的条件分别可能是
(3)在一定温度下的恒容密闭容器中,能说明
 达到平衡状态的是
达到平衡状态的是a.容器中混合气体的密度不再改变 b.容器中的压强不再改变
c.
 和
和 的浓度之比为3∶1 d.
的浓度之比为3∶1 d.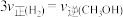
e.断裂3mol H−H键同时断裂3mol H−O键
您最近一年使用:0次
解题方法
3 . 以钛铁矿(主要成分 ,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为: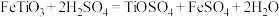 。
。
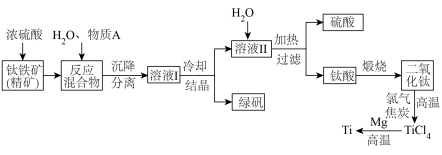
回答下列问题:
(1)钛铁矿和浓硫酸反应属于___________ (选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止 被氧化,物质A是
被氧化,物质A是___________ ,上述制备 的过程中,所得到的副产物和可回收利用的物质分别是
的过程中,所得到的副产物和可回收利用的物质分别是___________ 、___________ 。
(3)反应 在Ar气氛中进行的理由是
在Ar气氛中进行的理由是___________ 。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
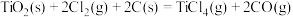
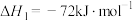

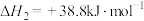

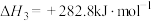
反应 的
的
___________ 。
 ,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为: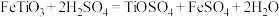 。
。
回答下列问题:
(1)钛铁矿和浓硫酸反应属于
(2)上述生产流程中加入物质A的目的是防止
 被氧化,物质A是
被氧化,物质A是 的过程中,所得到的副产物和可回收利用的物质分别是
的过程中,所得到的副产物和可回收利用的物质分别是(3)反应
 在Ar气氛中进行的理由是
在Ar气氛中进行的理由是(4)由二氧化钛制取四氯化钛所涉及的反应有:
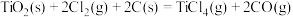
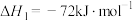

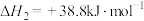

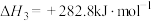
反应
 的
的
您最近一年使用:0次
2023-11-26更新
|
46次组卷
|
2卷引用:湖北省黄州中学(黄冈市外国语学校)2023-2024学年高二上学期9月月考化学试题
名校
解题方法
4 . 甲烷和乙烯是重要的气体燃料和化工原料。回答下列问题:
(1)甲烷化反应即为氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。
已知涉及的反应如下:
反应Ⅰ: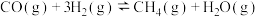
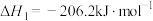
反应Ⅱ:

反应Ⅲ:
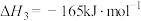
则
___________  。
。
(2)研究表明 和
和 在催化剂存在下可发生反应制得合成气
在催化剂存在下可发生反应制得合成气
 。在其他条件相同,不同催化剂(A、B)作用下,使原料
。在其他条件相同,不同催化剂(A、B)作用下,使原料 和
和 反应相同的时间,CO(g)的产率随反应温度的变化如图所示:
反应相同的时间,CO(g)的产率随反应温度的变化如图所示:
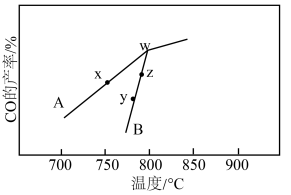
①在催化剂A.B作用下,它们正、逆反应活化能差值分别用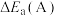 和
和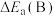 表示,则
表示,则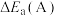
___________ 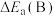 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②y点对应的逆反应速率v(逆)___________ z点对应的正反应速率v(正)(填“>”“<”或“=”)。
(3)西北工业大学的张健教授、德累斯顿工业大学的冯新亮院士等人报道了一种电催化半氢化策略,在室温条件下,水溶液介质中可选择性地将 还原为
还原为 ,其原理示意图如下:
,其原理示意图如下:

①阴极的电极反应式为___________ 。
②同温同压下,相同时间内,若进口处气体物质的量为amol,出口处气体的总体积为进口处的x倍,则 转化率为
转化率为___________ 。
(4)利用多晶铜高效催化电解 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。
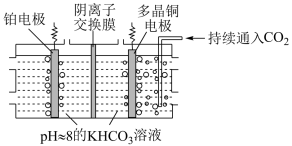
①电解过程中 向
向___________ (填“铂”或“多晶铜”)电极方向移动。
②多晶铜电极上的电极反应式为___________ 。
③理论上当生产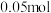 乙烯时,铂电极产生的气体在标况下体积为
乙烯时,铂电极产生的气体在标况下体积为___________ (不考虑气体的溶解)。
(1)甲烷化反应即为氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。
已知涉及的反应如下:
反应Ⅰ:
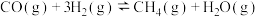
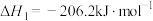
反应Ⅱ:


反应Ⅲ:

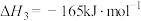
则

 。
。(2)研究表明
 和
和 在催化剂存在下可发生反应制得合成气
在催化剂存在下可发生反应制得合成气
 。在其他条件相同,不同催化剂(A、B)作用下,使原料
。在其他条件相同,不同催化剂(A、B)作用下,使原料 和
和 反应相同的时间,CO(g)的产率随反应温度的变化如图所示:
反应相同的时间,CO(g)的产率随反应温度的变化如图所示:
①在催化剂A.B作用下,它们正、逆反应活化能差值分别用
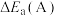 和
和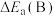 表示,则
表示,则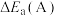
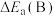 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②y点对应的逆反应速率v(逆)
(3)西北工业大学的张健教授、德累斯顿工业大学的冯新亮院士等人报道了一种电催化半氢化策略,在室温条件下,水溶液介质中可选择性地将
 还原为
还原为 ,其原理示意图如下:
,其原理示意图如下:
①阴极的电极反应式为
②同温同压下,相同时间内,若进口处气体物质的量为amol,出口处气体的总体积为进口处的x倍,则
 转化率为
转化率为(4)利用多晶铜高效催化电解
 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。
①电解过程中
 向
向②多晶铜电极上的电极反应式为
③理论上当生产
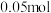 乙烯时,铂电极产生的气体在标况下体积为
乙烯时,铂电极产生的气体在标况下体积为
您最近一年使用:0次
2023-11-11更新
|
117次组卷
|
2卷引用:湖北省黄冈市蕲春县实验高级中学2024届高三一轮复习10月月考化学试题
5 . 能源是国民经济发展的重要基础。请根据所学知识回答下列问题:
Ⅰ.在标准状况下,1.68L家用燃料(仅由C、H两种元素组成的某气体)质量为1.2g,在25℃和101kPa下完全燃烧生成 和
和 时,放出66.77kJ的热量。
时,放出66.77kJ的热量。
(1)该气体的分子式为___________ 。该气体的燃烧热
___________ 。(保留一位小数)
Ⅱ.火箭发射时可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。
和水蒸气。
已知:
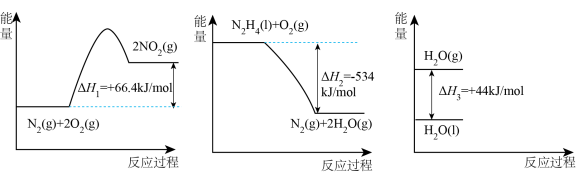
(2)请写出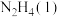 与
与 反应的热化学方程式
反应的热化学方程式___________ 。
(3)32g液态肼与足量 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是___________ kJ。
(4)上述反应用于火箭推进器的原因:①能快速产生大量气体;②___________ 。
Ⅲ.氢能是一种极具发展潜力的清洁能源。 可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
已知:在25℃、101kPa下,
①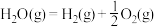
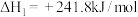
②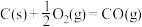
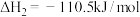
③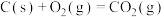

(5)25℃、101kPa下,CO与水蒸气反应转化为 和
和 的热化学方程式为
的热化学方程式为___________ 。
Ⅰ.在标准状况下,1.68L家用燃料(仅由C、H两种元素组成的某气体)质量为1.2g,在25℃和101kPa下完全燃烧生成
 和
和 时,放出66.77kJ的热量。
时,放出66.77kJ的热量。(1)该气体的分子式为

Ⅱ.火箭发射时可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。
和水蒸气。已知:

(2)请写出
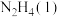 与
与 反应的热化学方程式
反应的热化学方程式(3)32g液态肼与足量
 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是(4)上述反应用于火箭推进器的原因:①能快速产生大量气体;②
Ⅲ.氢能是一种极具发展潜力的清洁能源。
 可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一已知:在25℃、101kPa下,
①
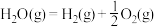
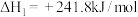
②
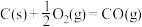
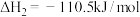
③
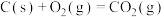

(5)25℃、101kPa下,CO与水蒸气反应转化为
 和
和 的热化学方程式为
的热化学方程式为
您最近一年使用:0次
名校
解题方法
6 . “绿水青山就是金山银山”,研究并消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知: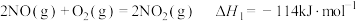
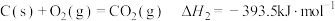
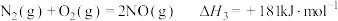
若某反应的平衡常数表达式为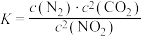 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式_______ 。
(2) 时,存在如下平衡:
时,存在如下平衡: 。该反应正逆反应速率与
。该反应正逆反应速率与 、
、 的浓度关系为:
的浓度关系为: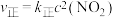 ,
,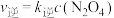 (
( 、
、 是速率常数),且
是速率常数),且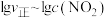 与
与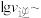
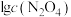 的关系如图所示。
的关系如图所示。
① 时,该反应的平衡常数
时,该反应的平衡常数
_______ 。
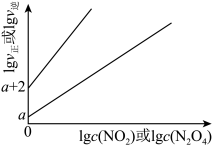
② 时,往刚性容器中充入一定量
时,往刚性容器中充入一定量 ,平衡后测得
,平衡后测得 为
为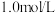 ,则平衡时
,则平衡时 的物质的量分数为
的物质的量分数为_______ (以分数表示)。
(3)用活性炭还原法处理氮氧化物的有关反应为: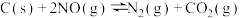 。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在
。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在 时刻改变某一条件,其反应过程如图所示。
时刻改变某一条件,其反应过程如图所示。
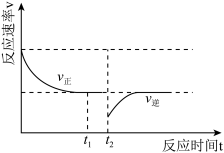
①则 时刻改变的条件为
时刻改变的条件为_______ 。
② 时刻的
时刻的
_______  时刻的
时刻的 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)在恒容密闭容器中发生反应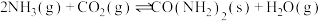
 。下列说法正确的是_______。
。下列说法正确的是_______。
(1)已知:
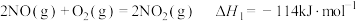
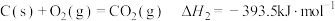
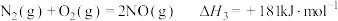
若某反应的平衡常数表达式为
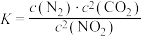 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)
 时,存在如下平衡:
时,存在如下平衡: 。该反应正逆反应速率与
。该反应正逆反应速率与 、
、 的浓度关系为:
的浓度关系为: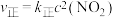 ,
,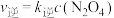 (
( 、
、 是速率常数),且
是速率常数),且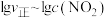 与
与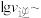
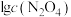 的关系如图所示。
的关系如图所示。
①
 时,该反应的平衡常数
时,该反应的平衡常数
②
 时,往刚性容器中充入一定量
时,往刚性容器中充入一定量 ,平衡后测得
,平衡后测得 为
为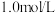 ,则平衡时
,则平衡时 的物质的量分数为
的物质的量分数为(3)用活性炭还原法处理氮氧化物的有关反应为:
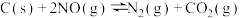 。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在
。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在 时刻改变某一条件,其反应过程如图所示。
时刻改变某一条件,其反应过程如图所示。
①则
 时刻改变的条件为
时刻改变的条件为②
 时刻的
时刻的
 时刻的
时刻的 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)在恒容密闭容器中发生反应
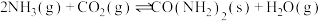
 。下列说法正确的是_______。
。下列说法正确的是_______。A.及时分离出生成的尿素,有利于 的转化率增大 的转化率增大 |
| B.反应达到平衡后,混合气体的密度不再发生改变 |
| C.反应在任何温度下都能自发进行 |
| D.当尿素的质量不变时,说明反应达到平衡 |
您最近一年使用:0次
7 . 我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。甲烷重整是提高甲烷利用率的重要方式。
回答下列问题:
(1)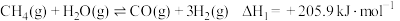 ①
①
 ②
②
写出 与
与 反应生成CO和
反应生成CO和 的热化学方程式:
的热化学方程式:_______ 。
(2)高温下,在1L密闭容器中通入1mol甲烷,发生如下反应: 。反应在初期阶段的速率方程为
。反应在初期阶段的速率方程为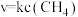 ,其中
,其中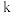 为反应速率常数。
为反应速率常数。
①设反应开始时的反应速率为 ,甲烷的转化率为
,甲烷的转化率为 时的反应速率为
时的反应速率为 ,则
,则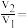
_______ 。
②对于处于初期阶段的该反应,下列说法正确的是_______ (填字母)。
A.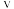 与甲烷浓度成正比
与甲烷浓度成正比
B.压强不变时,反应到达平衡状态
C.乙烷的生成速率逐渐增大
D.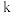 与温度无关
与温度无关
③平衡时,再通入1 mol甲烷,则反应的平衡常数K_______ (填“增大”“减小”或“不变”,下同),甲烷的转化率
_______ 。
(3) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
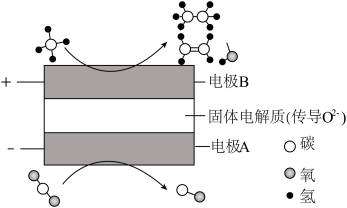
当在某电极上生成的两种有机物物质的量之比为1:1时,该电极上的电极反应式为_______ 。 和
和 的物质的量比为
的物质的量比为_______ 。
(4)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步: 催化裂解生成
催化裂解生成 和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如
和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如 ;第二步:碳(或碳氢物种)和
;第二步:碳(或碳氢物种)和 反应生成
反应生成 和
和 ,如
,如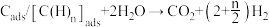 ,反应过程和能量变化残图如下:
,反应过程和能量变化残图如下:
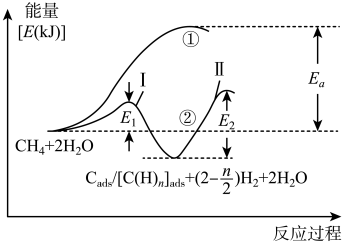
判断_______ (填序号)过程加入催化剂,原因是_______ 。控制整个过程②反应速率的是第Ⅱ步,其原因为_______ 。
回答下列问题:
(1)
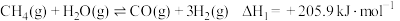 ①
① ②
②写出
 与
与 反应生成CO和
反应生成CO和 的热化学方程式:
的热化学方程式:(2)高温下,在1L密闭容器中通入1mol甲烷,发生如下反应:
 。反应在初期阶段的速率方程为
。反应在初期阶段的速率方程为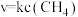 ,其中
,其中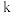 为反应速率常数。
为反应速率常数。①设反应开始时的反应速率为
 ,甲烷的转化率为
,甲烷的转化率为 时的反应速率为
时的反应速率为 ,则
,则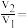
②对于处于初期阶段的该反应,下列说法正确的是
A.
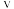 与甲烷浓度成正比
与甲烷浓度成正比B.压强不变时,反应到达平衡状态
C.乙烷的生成速率逐渐增大
D.
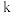 与温度无关
与温度无关③平衡时,再通入1 mol甲烷,则反应的平衡常数K

(3)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
当在某电极上生成的两种有机物物质的量之比为1:1时,该电极上的电极反应式为
 和
和 的物质的量比为
的物质的量比为(4)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:
 催化裂解生成
催化裂解生成 和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如
和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如 ;第二步:碳(或碳氢物种)和
;第二步:碳(或碳氢物种)和 反应生成
反应生成 和
和 ,如
,如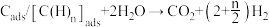 ,反应过程和能量变化残图如下:
,反应过程和能量变化残图如下:
判断
您最近一年使用:0次
2022-12-20更新
|
358次组卷
|
2卷引用:湖北省蕲春县实验高级中学2022届高三第一次模拟训练化学试题
名校
8 .
(1)铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,反应Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g),阻碍循环反应的进行。
3Fe(s)+4CO2(g),阻碍循环反应的进行。
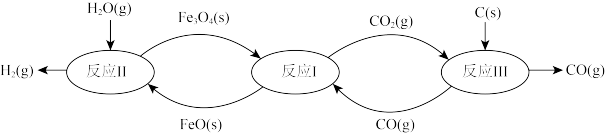
已知:i. Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) △H1=+19.3 kJ·mol-1
3FeO(s)+CO2(g) △H1=+19.3 kJ·mol-1
ii. 3FeO(s)+H2O(g) Fe3O4(s)+H2(g) △H2=-57.2 kJ·mol-1
Fe3O4(s)+H2(g) △H2=-57.2 kJ·mol-1
iii. C(s)+CO2(g) 2CO(g) △H3=+172.4 kJ·mol-1
2CO(g) △H3=+172.4 kJ·mol-1
铁氧化物循环裂解水制氢气总反应的热化学方程式是_______________ 。
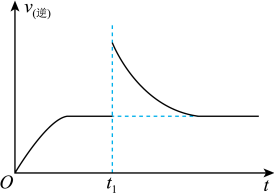
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和炭粉,发生反应Fe2O3(s)+3C(s) 2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是______(填写字母)。
2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是______(填写字母)。
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2与足量的碳,发生反应,平衡时体系中气体体积分数与温度的关系如图所示:
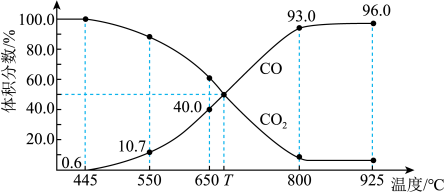
①650℃时,该反应达平衡后吸收的热量是___________________________________________ 。
②T℃时,若向平衡体系中再充入一定量按V(CO2)︰V(CO)=5︰4的混合气体,平衡________________ (填“正向”、“逆向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp计算表达式为________________ 。[气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、 ,其原理如图所示(导电壳内部为纳米零价铁) 在除污过程中,纳米零价铁中的Fe为原电池的负极,写出C2HCl3在其表面转化为乙烷的电极反应式为
,其原理如图所示(导电壳内部为纳米零价铁) 在除污过程中,纳米零价铁中的Fe为原电池的负极,写出C2HCl3在其表面转化为乙烷的电极反应式为______________________ 。

(1)铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,反应Fe3O4(s)+4CO(g)
 3Fe(s)+4CO2(g),阻碍循环反应的进行。
3Fe(s)+4CO2(g),阻碍循环反应的进行。 
已知:i. Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g) △H1=+19.3 kJ·mol-1
3FeO(s)+CO2(g) △H1=+19.3 kJ·mol-1ii. 3FeO(s)+H2O(g)
 Fe3O4(s)+H2(g) △H2=-57.2 kJ·mol-1
Fe3O4(s)+H2(g) △H2=-57.2 kJ·mol-1iii. C(s)+CO2(g)
 2CO(g) △H3=+172.4 kJ·mol-1
2CO(g) △H3=+172.4 kJ·mol-1铁氧化物循环裂解水制氢气总反应的热化学方程式是
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和炭粉,发生反应Fe2O3(s)+3C(s)
 2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是______(填写字母)。
2Fe(s)+3CO(g),反应达到平衡后,在t1时刻,改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是______(填写字母)。
| A.保持温度不变,压缩容器 | B.保持体积不变,升高温度 |
| C.保持体积不变,加少量碳粉 | D.保持体积不变,增大CO浓度 |

①650℃时,该反应达平衡后吸收的热量是
②T℃时,若向平衡体系中再充入一定量按V(CO2)︰V(CO)=5︰4的混合气体,平衡
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp计算表达式为
(4)用原电池原理可以除去酸性废水中的三氯乙烯、
 ,其原理如图所示(导电壳内部为纳米零价铁) 在除污过程中,纳米零价铁中的Fe为原电池的负极,写出C2HCl3在其表面转化为乙烷的电极反应式为
,其原理如图所示(导电壳内部为纳米零价铁) 在除污过程中,纳米零价铁中的Fe为原电池的负极,写出C2HCl3在其表面转化为乙烷的电极反应式为
您最近一年使用:0次
名校
解题方法
9 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和能源问题的方案之一。CO2耦合乙苯(C6H5-C2H5,简称EB)脱氢制备苯乙烯(C6H5-C2H3,简称ST)是综合利用CO2的热点研究领域。制备ST涉及的主要反应如下:
a.EB(g)=ST(g)+H2(g) △H1
b.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2 kJ·mol-1
c.EB(g)+CO2(g)=ST(g)+CO(g)+H2O(g) △H3=+158.8 kJ·mol-1
回答下列问题:
(1)为提高EB平衡转化率,应选择的反应条件为_______(填标号)。
(2)在一定条件下,选择合适的催化剂只进行b反应:CO2(g)+H2(g) CO(g)+H2O(g)。
CO(g)+H2O(g)。
①调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图。
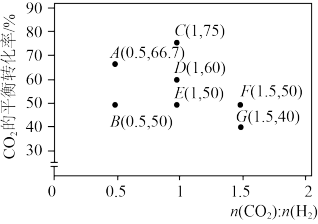
已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是_______ 点,计算E点所示的投料比在从起始到平衡的过程中,当CO2转化率达到20%时, =
=_______ 。
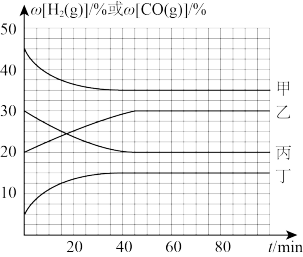
②在容积不变的密闭容器中,分别在温度T1、T2(T2>T1>E点温度)发生上述反应,反应中H2(g)和CO(g)的体积分数(ω)随时间(t)的变化关系如图所示。已知:起始时密闭容器中ω[CO2(g)]和ω[H2(g)]、ω[CO(g)]和ω[H2O(g)]分别相等。则表示T1时ω[CO(g)]的曲线是_______ (填“甲”“乙”“丙”或“丁”);在温度T2、反应时间20min时,反应的正反应速率v正_______ (填“>”“=”或“<”)逆反应速率v逆。
(3)恒压0.1 MPa下,改变原料气配比为下列三种情况:仅EB、n(EB):n(CO2)=1:10、n(EB):n(N2)=1:10进行以上a、b反应,测得EB的平衡转化率与温度的变化关系如图所示。
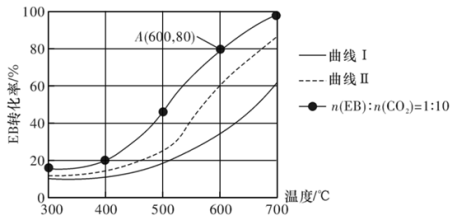
①图中,表示原料气配比n(EB):n(N2)=1:10的曲线是曲线_______ (填“I”或“Ⅱ”)。
②CO2能显著提高EB的平衡转化率,从平衡移动的角度解释CO2的作用:_______ 。
③设Kpr为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1 MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的Kpr为_______ 。
a.EB(g)=ST(g)+H2(g) △H1
b.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2 kJ·mol-1
c.EB(g)+CO2(g)=ST(g)+CO(g)+H2O(g) △H3=+158.8 kJ·mol-1
回答下列问题:
(1)为提高EB平衡转化率,应选择的反应条件为_______(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
 CO(g)+H2O(g)。
CO(g)+H2O(g)。①调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图。

已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是
 =
=②在容积不变的密闭容器中,分别在温度T1、T2(T2>T1>E点温度)发生上述反应,反应中H2(g)和CO(g)的体积分数(ω)随时间(t)的变化关系如图所示。已知:起始时密闭容器中ω[CO2(g)]和ω[H2(g)]、ω[CO(g)]和ω[H2O(g)]分别相等。则表示T1时ω[CO(g)]的曲线是

(3)恒压0.1 MPa下,改变原料气配比为下列三种情况:仅EB、n(EB):n(CO2)=1:10、n(EB):n(N2)=1:10进行以上a、b反应,测得EB的平衡转化率与温度的变化关系如图所示。

①图中,表示原料气配比n(EB):n(N2)=1:10的曲线是曲线
②CO2能显著提高EB的平衡转化率,从平衡移动的角度解释CO2的作用:
③设Kpr为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1 MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的Kpr为
您最近一年使用:0次
2022-05-29更新
|
526次组卷
|
6卷引用:湖北省黄冈中学2022届高三第二次模拟考试化学试题
湖北省黄冈中学2022届高三第二次模拟考试化学试题安徽师范大学附属中学2022届高三适应性考试理综化学试题(已下线)考点25 化学反应速率与平衡图象-备战2023年高考化学一轮复习考点帮(全国通用)湖南省株洲市第四中学2022-2023学年高三上学期第三次月考化学试题(已下线)超重点4 化学反应速率与化学平衡图像的4个重点考查方向(已下线)T18-原理综合题
10 . 近年来,随着化石燃料的大量消耗和CO2等温室气体的大量排放,氨的无碳燃料属性引起重视。低能耗高效率合成氨技术的开发是实现氨燃料化利用的基础,基于Al2O3载氮体的碳基化学链合成氨技术示意图如下。
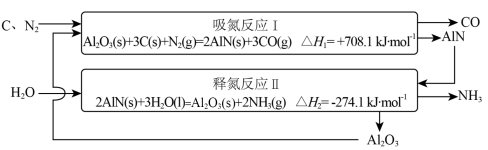
(1)总反应的热化学方程式为_______ ;
(2)有利于提高反应Ⅱ平衡转化率的条件为_______(填标号)。
(3)在温度为T、固定容积为VL、p0=100 kPa条件下进行反应Ⅰ,平衡时氮气转化率为50%,则N2压强为_______ ,分压平衡常数Kp=_______ kPa2。
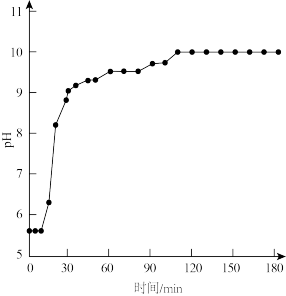
(4)60 C、100 kPa条件下,反应Ⅱ中溶液pH随时间变化如图,120 min~180 min持续收集到氨气,但溶液pH几乎不变的原因是_______ 。
(5)为探究反应Ⅱ中15min时反应速率突然加快的原因,利用计算机模拟反应Ⅱ的反应路径如下。
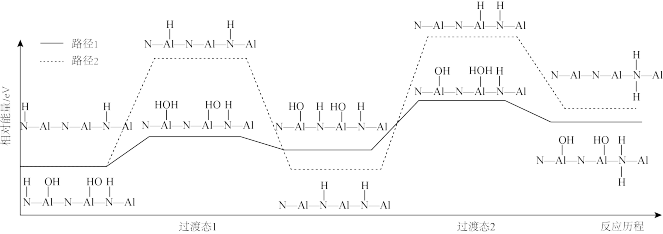
①比较不同路径,路径1能垒较低的原因是_______ 的键能大于_______ 的键能。
②15min时反应速率突然加快的原因是_______ 。
(6)与传统的催化合成氨反应相比,碳基化学链合成氨的优势有_______(填标号)。

(1)总反应的热化学方程式为
(2)有利于提高反应Ⅱ平衡转化率的条件为_______(填标号)。
| A.高温高压 | B.高温低压 | C.低温高压 | D.低温低压 |
(3)在温度为T、固定容积为VL、p0=100 kPa条件下进行反应Ⅰ,平衡时氮气转化率为50%,则N2压强为

(4)60 C、100 kPa条件下,反应Ⅱ中溶液pH随时间变化如图,120 min~180 min持续收集到氨气,但溶液pH几乎不变的原因是
(5)为探究反应Ⅱ中15min时反应速率突然加快的原因,利用计算机模拟反应Ⅱ的反应路径如下。

①比较不同路径,路径1能垒较低的原因是
②15min时反应速率突然加快的原因是
(6)与传统的催化合成氨反应相比,碳基化学链合成氨的优势有_______(填标号)。
| A.能够规避N2和H2在催化剂表面竞争吸附的问题 |
| B.原料成本低,能耗低,产物无需分离,可获得CO副产物 |
| C.规避了催化合成氨的热力学和动力学矛盾,兼顾较高的反应速率和较大的反应限度 |
| D.释氮反应对温度要求不高,相对低的温度能够缓解NH3分解,有利于NH3的收集 |
您最近一年使用:0次



