名校
解题方法
1 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和能源问题的方案之一。CO2耦合乙苯(C6H5-C2H5,简称EB)脱氢制备苯乙烯(C6H5-C2H3,简称ST)是综合利用CO2的热点研究领域。制备ST涉及的主要反应如下:
a.EB(g)=ST(g)+H2(g) △H1
b.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2 kJ·mol-1
c.EB(g)+CO2(g)=ST(g)+CO(g)+H2O(g) △H3=+158.8 kJ·mol-1
回答下列问题:
(1)为提高EB平衡转化率,应选择的反应条件为_______(填标号)。
(2)在一定条件下,选择合适的催化剂只进行b反应:CO2(g)+H2(g) CO(g)+H2O(g)。
CO(g)+H2O(g)。
①调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图。
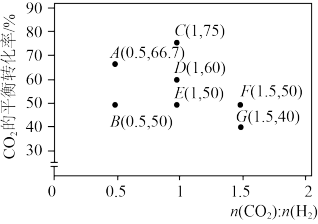
已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是_______ 点,计算E点所示的投料比在从起始到平衡的过程中,当CO2转化率达到20%时, =
=_______ 。
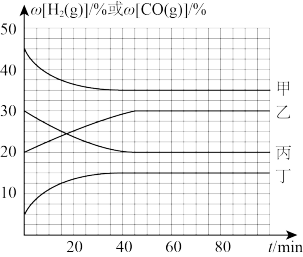
②在容积不变的密闭容器中,分别在温度T1、T2(T2>T1>E点温度)发生上述反应,反应中H2(g)和CO(g)的体积分数(ω)随时间(t)的变化关系如图所示。已知:起始时密闭容器中ω[CO2(g)]和ω[H2(g)]、ω[CO(g)]和ω[H2O(g)]分别相等。则表示T1时ω[CO(g)]的曲线是_______ (填“甲”“乙”“丙”或“丁”);在温度T2、反应时间20min时,反应的正反应速率v正_______ (填“>”“=”或“<”)逆反应速率v逆。
(3)恒压0.1 MPa下,改变原料气配比为下列三种情况:仅EB、n(EB):n(CO2)=1:10、n(EB):n(N2)=1:10进行以上a、b反应,测得EB的平衡转化率与温度的变化关系如图所示。
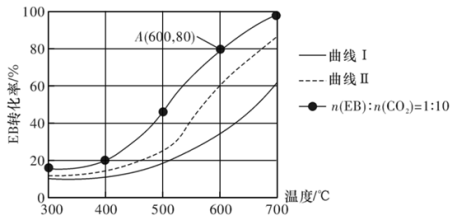
①图中,表示原料气配比n(EB):n(N2)=1:10的曲线是曲线_______ (填“I”或“Ⅱ”)。
②CO2能显著提高EB的平衡转化率,从平衡移动的角度解释CO2的作用:_______ 。
③设Kpr为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1 MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的Kpr为_______ 。
a.EB(g)=ST(g)+H2(g) △H1
b.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2 kJ·mol-1
c.EB(g)+CO2(g)=ST(g)+CO(g)+H2O(g) △H3=+158.8 kJ·mol-1
回答下列问题:
(1)为提高EB平衡转化率,应选择的反应条件为_______(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
 CO(g)+H2O(g)。
CO(g)+H2O(g)。①调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图。

已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是
 =
=②在容积不变的密闭容器中,分别在温度T1、T2(T2>T1>E点温度)发生上述反应,反应中H2(g)和CO(g)的体积分数(ω)随时间(t)的变化关系如图所示。已知:起始时密闭容器中ω[CO2(g)]和ω[H2(g)]、ω[CO(g)]和ω[H2O(g)]分别相等。则表示T1时ω[CO(g)]的曲线是

(3)恒压0.1 MPa下,改变原料气配比为下列三种情况:仅EB、n(EB):n(CO2)=1:10、n(EB):n(N2)=1:10进行以上a、b反应,测得EB的平衡转化率与温度的变化关系如图所示。

①图中,表示原料气配比n(EB):n(N2)=1:10的曲线是曲线
②CO2能显著提高EB的平衡转化率,从平衡移动的角度解释CO2的作用:
③设Kpr为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1 MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的Kpr为
您最近一年使用:0次
2022-05-29更新
|
548次组卷
|
6卷引用:湖北省黄冈中学2022届高三第二次模拟考试化学试题
湖北省黄冈中学2022届高三第二次模拟考试化学试题安徽师范大学附属中学2022届高三适应性考试理综化学试题(已下线)考点25 化学反应速率与平衡图象-备战2023年高考化学一轮复习考点帮(全国通用)湖南省株洲市第四中学2022-2023学年高三上学期第三次月考化学试题(已下线)超重点4 化学反应速率与化学平衡图像的4个重点考查方向(已下线)T18-原理综合题
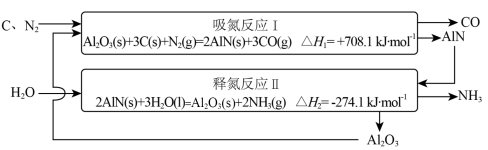
2 . 近年来,随着化石燃料的大量消耗和CO2等温室气体的大量排放,氨的无碳燃料属性引起重视。低能耗高效率合成氨技术的开发是实现氨燃料化利用的基础,基于Al2O3载氮体的碳基化学链合成氨技术示意图如下。_______ ;
(2)有利于提高反应Ⅱ平衡转化率的条件为_______(填标号)。
(3)在温度为T、固定容积为VL、p0=100 kPa条件下进行反应Ⅰ,平衡时氮气转化率为50%,则N2压强为_______ ,分压平衡常数Kp=_______ kPa2。_______ 。
(5)为探究反应Ⅱ中15min时反应速率突然加快的原因,利用计算机模拟反应Ⅱ的反应路径如下。_______ 的键能大于_______ 的键能。
②15min时反应速率突然加快的原因是_______ 。
(6)与传统的催化合成氨反应相比,碳基化学链合成氨的优势有_______(填标号)。
(2)有利于提高反应Ⅱ平衡转化率的条件为_______(填标号)。
| A.高温高压 | B.高温低压 | C.低温高压 | D.低温低压 |
(3)在温度为T、固定容积为VL、p0=100 kPa条件下进行反应Ⅰ,平衡时氮气转化率为50%,则N2压强为
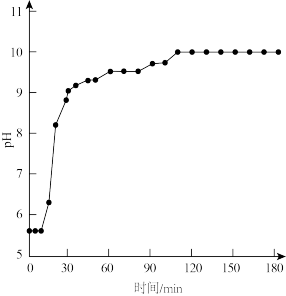
(5)为探究反应Ⅱ中15min时反应速率突然加快的原因,利用计算机模拟反应Ⅱ的反应路径如下。
②15min时反应速率突然加快的原因是
(6)与传统的催化合成氨反应相比,碳基化学链合成氨的优势有_______(填标号)。
| A.能够规避N2和H2在催化剂表面竞争吸附的问题 |
| B.原料成本低,能耗低,产物无需分离,可获得CO副产物 |
| C.规避了催化合成氨的热力学和动力学矛盾,兼顾较高的反应速率和较大的反应限度 |
| D.释氮反应对温度要求不高,相对低的温度能够缓解NH3分解,有利于NH3的收集 |
您最近一年使用:0次
解题方法
3 . 近年来,化学界广泛开展研究二氧化碳与氢气的反应原理。回答下列问题:
(1)已知 CO2与H2反应的两个热化学方程式如下:
Ⅰ.

Ⅱ.

则反应 △H=
△H=_______ kJ/mol。
(2)某装置中充入一定量CO2与H2,在673 K、10.0 kPa条件下发生反应: ,得到部分气体的分压随时间的变化关系如下图所示。
,得到部分气体的分压随时间的变化关系如下图所示。
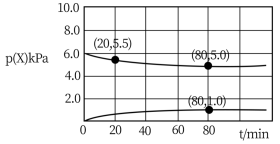
①在20~80 min内反应的平均速率v(H2)=_______  (保留两位有效数字)。
(保留两位有效数字)。
②已知反应在80 min达到平衡状态,则在673 K时,反应 的平衡常数Kp=
的平衡常数Kp=_______ (保留两位有效数字)。
③平衡后,若改变条件,一定能增大H2的反应速率及转化率的是_______ (填代号)
A.保持其它气体的分压不变,增大H2的分压
B.适当升高反应温度
C.选择使用正催化剂
D.保持总压不变,充入一定量的二氧化碳气体
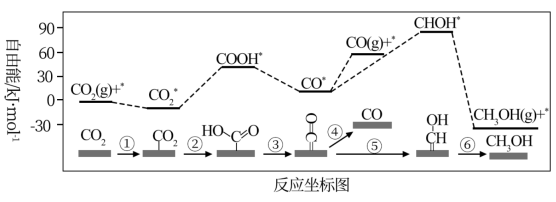
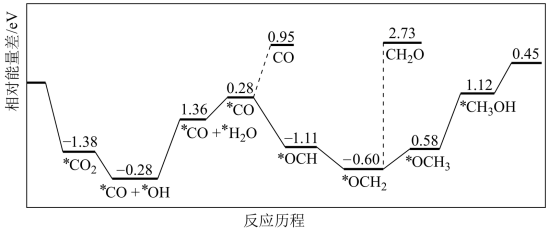
(3)已知催化还原CO2的机理及能量变化关系如下图。为使CO2能较快还原为CH3OH,重点应研究催化加快图中_______ (填写下图中序号“①”“②”“③”…等)的反应速率。
(4)在一装有某催化剂的恒容密闭装置中,充入10 mol CO2和23 mol H2,在一定温度下发生反应: 和
和 ,反应进行到t2时刻,各物质的物质的量不再改变,部分物质的物质的量与时间的关系如下图。
,反应进行到t2时刻,各物质的物质的量不再改变,部分物质的物质的量与时间的关系如下图。
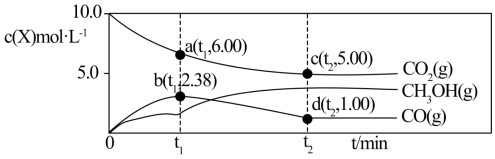
①t1时刻反应 的浓度熵Qc=
的浓度熵Qc=_______ (计算结果保留两位有效数字), 点时
点时
_______ (填“是”或“否”)达到平衡状态。
②简述CO的物质的量浓度为何先增大后减小的原因_______ 。
③t2时刻后,若升高装置温度,则重新达到平衡时,c(CO)_______ ,若将装置的体积缩小一倍,则重新达到平衡时,n(CO)_______ 。
A.增大 B.减小 C.不变 D.无法确定
(1)已知 CO2与H2反应的两个热化学方程式如下:
Ⅰ.


Ⅱ.


则反应
 △H=
△H=(2)某装置中充入一定量CO2与H2,在673 K、10.0 kPa条件下发生反应:
 ,得到部分气体的分压随时间的变化关系如下图所示。
,得到部分气体的分压随时间的变化关系如下图所示。
①在20~80 min内反应的平均速率v(H2)=
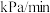 (保留两位有效数字)。
(保留两位有效数字)。②已知反应在80 min达到平衡状态,则在673 K时,反应
 的平衡常数Kp=
的平衡常数Kp=③平衡后,若改变条件,一定能增大H2的反应速率及转化率的是
A.保持其它气体的分压不变,增大H2的分压
B.适当升高反应温度
C.选择使用正催化剂
D.保持总压不变,充入一定量的二氧化碳气体
(3)已知催化还原CO2的机理及能量变化关系如下图。为使CO2能较快还原为CH3OH,重点应研究催化加快图中

(4)在一装有某催化剂的恒容密闭装置中,充入10 mol CO2和23 mol H2,在一定温度下发生反应:
 和
和 ,反应进行到t2时刻,各物质的物质的量不再改变,部分物质的物质的量与时间的关系如下图。
,反应进行到t2时刻,各物质的物质的量不再改变,部分物质的物质的量与时间的关系如下图。
①t1时刻反应
 的浓度熵Qc=
的浓度熵Qc= 点时
点时
②简述CO的物质的量浓度为何先增大后减小的原因
③t2时刻后,若升高装置温度,则重新达到平衡时,c(CO)
A.增大 B.减小 C.不变 D.无法确定
您最近一年使用:0次
解题方法
4 . 肼( )常用于火箭或原电池的燃料。已知:
)常用于火箭或原电池的燃料。已知:
①
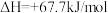
②
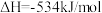
③
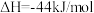
回答下列问题:
(1)反应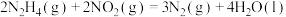

___________ kJ/mol
(2)一定温度下,将 与
与 以体积比1:1置于10L密闭容器中发生上述反应:
以体积比1:1置于10L密闭容器中发生上述反应: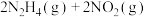
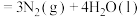 ,下列选项不能说明反应达到平衡状态的是
,下列选项不能说明反应达到平衡状态的是________ (填编号)。
a.混合气体密度保持不变 b.混合气体颜色保持不变
c. 与
与 体积之比保持不变 d.体系压强保持不变
体积之比保持不变 d.体系压强保持不变
(3)在10L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
①前2min内 的平均反应速率为
的平均反应速率为___________ 。该温度下反应的平衡常数K=___________ 。
②反应在6min时改变了条件,改变的条件可能是___________ (填选项字母)。
A.使用催化剂 B.升高温度 C.减小压强 D.增大 的量
的量
 )常用于火箭或原电池的燃料。已知:
)常用于火箭或原电池的燃料。已知:①

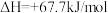
②

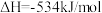
③

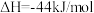
回答下列问题:
(1)反应
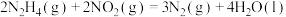

(2)一定温度下,将
 与
与 以体积比1:1置于10L密闭容器中发生上述反应:
以体积比1:1置于10L密闭容器中发生上述反应: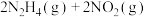
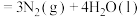 ,下列选项不能说明反应达到平衡状态的是
,下列选项不能说明反应达到平衡状态的是a.混合气体密度保持不变 b.混合气体颜色保持不变
c.
 与
与 体积之比保持不变 d.体系压强保持不变
体积之比保持不变 d.体系压强保持不变(3)在10L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
物质的量(mol) 时间 |  | 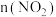 |  |
| 开始 | 0.8 | 1.6 | 0 |
| 2min末 | 0.6 | a | 0.3 |
| 5min末 | 0.4 | 1.2 | 0.6 |
| 6min末 | 0.4 | 1.2 | 0.6 |
| 10min末 | 0.6 | 1.4 | 0.3 |
 的平均反应速率为
的平均反应速率为②反应在6min时改变了条件,改变的条件可能是
A.使用催化剂 B.升高温度 C.减小压强 D.增大
 的量
的量
您最近一年使用:0次
2021-11-17更新
|
166次组卷
|
3卷引用:湖北省蕲春县2021-2022学年高二上学期期中考试化学试题
名校
解题方法
5 . 乙酸制氢具有重要意义,发生的反应如下:
热裂解反应:CH3COOH(g) = 2CO(g)+2H2(g) ΔH=+203.7 kJ·mol-1
脱羧基反应:CH3COOH(g) = CH4(g)+CO2(g) ΔH=-33.5 kJ·mol-1
(1)请写出CO与H2甲烷化的热化学方程式:___________ 。
(2)在密闭容器中,利用乙酸制氢,选择的压强为___________ (填“高压”或“常压”)。其中温度与气体产率的关系如图:
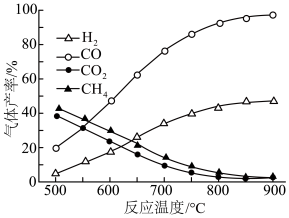
①约650℃之前,脱羧基反应活化能低,速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是___________ ,同时热裂解反应正向进行,而脱羧基反应逆向进行。
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,请分析原因(用化学方程式表示):___________ 。
(3)若利用合适的催化剂控制其他副反应,温度为T℃时达到平衡,总压强为p kPa,热裂解反应消耗乙酸30%,脱羧基反应消耗乙酸50%,H2体积分数为___________ ;脱羧基反应的平衡常数Kp为___________ kPa(Kp为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
热裂解反应:CH3COOH(g) = 2CO(g)+2H2(g) ΔH=+203.7 kJ·mol-1
脱羧基反应:CH3COOH(g) = CH4(g)+CO2(g) ΔH=-33.5 kJ·mol-1
(1)请写出CO与H2甲烷化的热化学方程式:
(2)在密闭容器中,利用乙酸制氢,选择的压强为

①约650℃之前,脱羧基反应活化能低,速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,请分析原因(用化学方程式表示):
(3)若利用合适的催化剂控制其他副反应,温度为T℃时达到平衡,总压强为p kPa,热裂解反应消耗乙酸30%,脱羧基反应消耗乙酸50%,H2体积分数为
您最近一年使用:0次
2021-11-11更新
|
229次组卷
|
2卷引用:湖北省黄州中学2022--2023学年高二上学期10月月考化学试题
6 . 二氧化碳加氢合成甲醇是化学固碳的一种有效途径,不仅可以有效减少空气中的 排放,而且还能制备出甲醇清洁能源。反应如下:
排放,而且还能制备出甲醇清洁能源。反应如下:
Ⅰ.

 和
和 还可发生副反应生成CO,反应如下:
还可发生副反应生成CO,反应如下:
Ⅱ.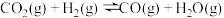

回答下列问题:
(1)已知相关化学键的键能数据如下:
由此计算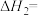
_______  。
。
(2)我国学者结合实验与计算机模拟结果,研究了 与
与 在
在 催化剂表面生成
催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。

①该反应历程中最大的活化能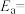
_______ eV。
②后续的反应历程可简化为 (*表示催化剂活性位点),
(*表示催化剂活性位点), ,_______。
,_______。 ,
, 。请补充历程中横线上发生的化学反应方程式
。请补充历程中横线上发生的化学反应方程式_______ 。
(3)当 和
和 的投料比为1∶3在不同的催化剂
的投料比为1∶3在不同的催化剂 条件下反应相同的时间,
条件下反应相同的时间, 选择性和CO选择性随着
选择性和CO选择性随着 转化率的变化如图所示:(已知
转化率的变化如图所示:(已知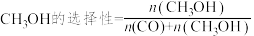 、
、 )
)

①由图可知,催化效果Cat.2_______ (填“优于”或“劣于”)Cat.1。
②若温度升高, 的转化率增大,则
的转化率增大,则 选择性降低的可能原因是
选择性降低的可能原因是_______ 。
(4)若电解质溶液为酸性,甲醇燃料电池的阳极反应式为_______ ,电池工作一段时间后,电解质溶液的pH_______ (填“增大”“不变”或“减小”)。
 排放,而且还能制备出甲醇清洁能源。反应如下:
排放,而且还能制备出甲醇清洁能源。反应如下:Ⅰ.


 和
和 还可发生副反应生成CO,反应如下:
还可发生副反应生成CO,反应如下:Ⅱ.
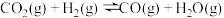

回答下列问题:
(1)已知相关化学键的键能数据如下:
| 化学键 |  |  |  |  |  |
 | 436 | 343 | 1076 | 465 | 413 |
由此计算
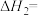
 。
。(2)我国学者结合实验与计算机模拟结果,研究了
 与
与 在
在 催化剂表面生成
催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
①该反应历程中最大的活化能
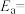
②后续的反应历程可简化为
 (*表示催化剂活性位点),
(*表示催化剂活性位点), ,_______。
,_______。 ,
, 。请补充历程中横线上发生的化学反应方程式
。请补充历程中横线上发生的化学反应方程式(3)当
 和
和 的投料比为1∶3在不同的催化剂
的投料比为1∶3在不同的催化剂 条件下反应相同的时间,
条件下反应相同的时间, 选择性和CO选择性随着
选择性和CO选择性随着 转化率的变化如图所示:(已知
转化率的变化如图所示:(已知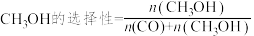 、
、 )
)
①由图可知,催化效果Cat.2
②若温度升高,
 的转化率增大,则
的转化率增大,则 选择性降低的可能原因是
选择性降低的可能原因是(4)若电解质溶液为酸性,甲醇燃料电池的阳极反应式为
您最近一年使用:0次
2021-10-28更新
|
457次组卷
|
4卷引用:湖北省黄冈市蕲春县第四高级中学2021-2022学年上学期高三11月月考化学试题
湖北省黄冈市蕲春县第四高级中学2021-2022学年上学期高三11月月考化学试题湖南省三湘名校教育联盟2021-2022学年高三上学期第一次大联考化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习湖北省名校教研联盟2022届高三上学期10月联考化学试题
名校
解题方法
7 . 目前我国分别在治理大气污染和新能源使用上都取得长足的进步。
(1)在大气污染治理上,目前我国计划在“十二五”期间用甲烷还原氮氧化物(NOx),使其排放量减少10%。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为___________
(2)在新能源使用上,正在研究利用甲烷合成甲醇这个清洁能源。该反应为:CH4(g) + H2O(g) CH3OH(g) + H2(g) △H>0,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:
CH3OH(g) + H2(g) △H>0,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:
①假设100 ℃时若按甲投料反应达到平衡所需的时间为5 min,则用甲烷表示该反应的平均反应速率为___________ 。
②在不改变其他外界条件下α1、α2、α3的相对大小顺序为:___________ 。
③欲提高CH4转化率且不改变该反应的平衡常数的方法是___________ (填字母序号)。
A.c(CH4)增大 B.分离出产品CH3OH
C.升高温度 D.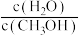 比值增大 E.容器体积缩小一半
比值增大 E.容器体积缩小一半
④下列图象对该反应表达正确的是:___________ 。
(1)在大气污染治理上,目前我国计划在“十二五”期间用甲烷还原氮氧化物(NOx),使其排放量减少10%。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(2)在新能源使用上,正在研究利用甲烷合成甲醇这个清洁能源。该反应为:CH4(g) + H2O(g)
 CH3OH(g) + H2(g) △H>0,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:
CH3OH(g) + H2(g) △H>0,将一定量的CH4和一定量H2O(g)通入10L容器中,若改变起始量,CH4的平衡转化率如图所示:| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(CH4)/ mol | 5 | 4 | 10 |
| n(H2O)/ mol | 10 | 8 | 10 | |
| CH4的平衡转化率 / % | α1=50% | α2 | α3 | |
②在不改变其他外界条件下α1、α2、α3的相对大小顺序为:
③欲提高CH4转化率且不改变该反应的平衡常数的方法是
A.c(CH4)增大 B.分离出产品CH3OH
C.升高温度 D.
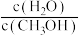 比值增大 E.容器体积缩小一半
比值增大 E.容器体积缩小一半④下列图象对该反应表达正确的是:
A. B.
B.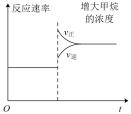 C.
C. D.
D.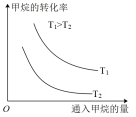
您最近一年使用:0次
2021-10-22更新
|
233次组卷
|
4卷引用:湖北省罗田第一中学2021-2022学年高二10月月考化学试题
8 .  的资源化利用能有效减少
的资源化利用能有效减少 排放,又能缓解能源危机。实现
排放,又能缓解能源危机。实现 资源化再利用的研究工作正在不断进行中。
资源化再利用的研究工作正在不断进行中。
(1) 和
和 ,合成
,合成 ,用非金属催化剂实现
,用非金属催化剂实现 电催化还原制备甲醇的反应历程如图所示:
电催化还原制备甲醇的反应历程如图所示:
上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______(填字母)的能量变化。
(2) 和
和 合成甲酸(
合成甲酸( )其反应为:
)其反应为: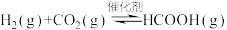 。一定温度下,恒容密闭容器中进行上述反应,测得
。一定温度下,恒容密闭容器中进行上述反应,测得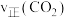 随反应时间(t)的变化如图所示。
随反应时间(t)的变化如图所示。
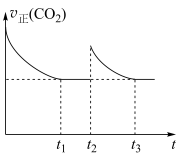
① 时,改变的条件是充入
时,改变的条件是充入
 ,同时
,同时_______ 。
②下列关于 、
、 时刻的说法,正确的是
时刻的说法,正确的是_______ 。
a.平衡常数: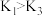
b.混合气的平均分子量: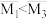
c.混合气中 的体积分数:
的体积分数:
(3) —甲基二乙醇胺(用
—甲基二乙醇胺(用 表示)水溶液具有吸收能力强、对设备腐蚀小、可再生等特点被广泛应用。
表示)水溶液具有吸收能力强、对设备腐蚀小、可再生等特点被广泛应用。 吸收
吸收 的反应可以表示为:
的反应可以表示为: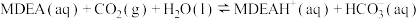

该反应分以下两步进行:
Ⅰ.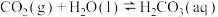
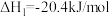 (慢反应)
(慢反应)
Ⅱ.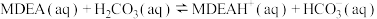
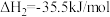 (快反应)
(快反应)
 =
=_______  ,其它条件不变时,加入
,其它条件不变时,加入
_______ (填“能”或“不能”)增大单位时间内 的吸收率。
的吸收率。
(4)已知 中的氮具有一元碱(类似于
中的氮具有一元碱(类似于 )的性质,
)的性质,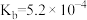 ,已知
,已知 的
的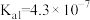 ,
, ,则
,则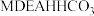 溶液中
溶液中
_______ 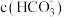 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(5)标准平衡常数 可以表示平衡时各物质的浓度关系:如反应
可以表示平衡时各物质的浓度关系:如反应 的
的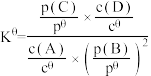 ,其中
,其中 ,
,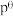 为标准大气压,
为标准大气压,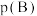 、
、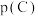 分别为气体的分压,c为物质的量浓度。在
分别为气体的分压,c为物质的量浓度。在 时的刚性密闭容器中,用
时的刚性密闭容器中,用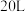
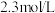 的
的 溶液吸收总压为
溶液吸收总压为 的合成氨原 料气(含体积分数分别为30%的
的合成氨原 料气(含体积分数分别为30%的 、55%的
、55%的 、15%的
、15%的 ),充分吸收后,
),充分吸收后, 浓度降低为
浓度降低为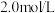 ,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数 =
=_______ 。
 的资源化利用能有效减少
的资源化利用能有效减少 排放,又能缓解能源危机。实现
排放,又能缓解能源危机。实现 资源化再利用的研究工作正在不断进行中。
资源化再利用的研究工作正在不断进行中。(1)
 和
和 ,合成
,合成 ,用非金属催化剂实现
,用非金属催化剂实现 电催化还原制备甲醇的反应历程如图所示:
电催化还原制备甲醇的反应历程如图所示:
上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______(填字母)的能量变化。
A. | B.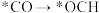 |
C. | D.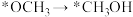 |
 和
和 合成甲酸(
合成甲酸( )其反应为:
)其反应为: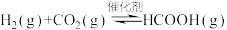 。一定温度下,恒容密闭容器中进行上述反应,测得
。一定温度下,恒容密闭容器中进行上述反应,测得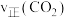 随反应时间(t)的变化如图所示。
随反应时间(t)的变化如图所示。
①
 时,改变的条件是充入
时,改变的条件是充入
 ,同时
,同时②下列关于
 、
、 时刻的说法,正确的是
时刻的说法,正确的是a.平衡常数:
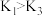
b.混合气的平均分子量:
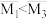
c.混合气中
 的体积分数:
的体积分数:
(3)
 —甲基二乙醇胺(用
—甲基二乙醇胺(用 表示)水溶液具有吸收能力强、对设备腐蚀小、可再生等特点被广泛应用。
表示)水溶液具有吸收能力强、对设备腐蚀小、可再生等特点被广泛应用。 吸收
吸收 的反应可以表示为:
的反应可以表示为: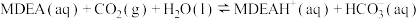

该反应分以下两步进行:
Ⅰ.
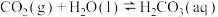
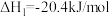 (慢反应)
(慢反应)Ⅱ.
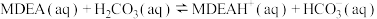
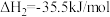 (快反应)
(快反应) =
= ,其它条件不变时,加入
,其它条件不变时,加入
 的吸收率。
的吸收率。(4)已知
 中的氮具有一元碱(类似于
中的氮具有一元碱(类似于 )的性质,
)的性质,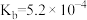 ,已知
,已知 的
的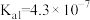 ,
, ,则
,则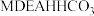 溶液中
溶液中
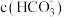 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(5)标准平衡常数
 可以表示平衡时各物质的浓度关系:如反应
可以表示平衡时各物质的浓度关系:如反应 的
的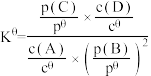 ,其中
,其中 ,
,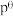 为标准大气压,
为标准大气压,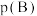 、
、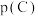 分别为气体的分压,c为物质的量浓度。在
分别为气体的分压,c为物质的量浓度。在 时的刚性密闭容器中,用
时的刚性密闭容器中,用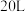
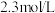 的
的 溶液吸收总压为
溶液吸收总压为 的合成氨原 料气(含体积分数分别为30%的
的合成氨原 料气(含体积分数分别为30%的 、55%的
、55%的 、15%的
、15%的 ),充分吸收后,
),充分吸收后, 浓度降低为
浓度降低为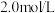 ,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数
,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数 =
=
您最近一年使用:0次
9 . 氢气是重要的能源,氢气的制取及利用一直居于科学研究的前沿。
(1)甲烷化制氢发生的反应为CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H1,已知:甲烷和氢气的燃烧热分别是893kJ/mol和286kJ/mol,H2O(g)=H2O(l) △H=-44kJ/mol。回答下列问题:
①△H1=___ 。
②容器中通入物质的量之比为1:2的甲烷和水蒸气,在一定条件下发生上述反应,平衡时H2的体积分数为φ,则CH4的体积分数=___ ,转化率=___ (用含φ的式子表示)。
(2)N2、H2在Fe催化剂作用下的反应历程与能量的关系如图所示(*表示吸附态,省略了反应过程中部分微粒)。回答下列问题。
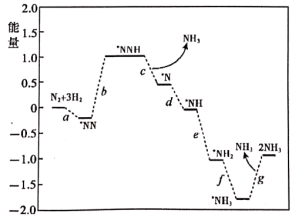
①合成氨反应是___ (填“放热反应”或“吸热反应”)。
②步骤c的化学方程式是____ 。
③已知一个反应的反应历程中,最慢的反应(又称为决速反应)决定了整体的反应速率,则合成氨反应的决速反应是___ (填“a、b、c、d、e、f、g”中的一个)。
④反应过程中,如果仅增多Fe催化剂的量(不改变比表面积),合成氨反应的下列选项有变化的是____ 。
a.活化能 b.反应热 c.化学平衡常数 d.单位时间内NH3的产量
(1)甲烷化制氢发生的反应为CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H1,已知:甲烷和氢气的燃烧热分别是893kJ/mol和286kJ/mol,H2O(g)=H2O(l) △H=-44kJ/mol。回答下列问题:
①△H1=
②容器中通入物质的量之比为1:2的甲烷和水蒸气,在一定条件下发生上述反应,平衡时H2的体积分数为φ,则CH4的体积分数=
(2)N2、H2在Fe催化剂作用下的反应历程与能量的关系如图所示(*表示吸附态,省略了反应过程中部分微粒)。回答下列问题。

①合成氨反应是
②步骤c的化学方程式是
③已知一个反应的反应历程中,最慢的反应(又称为决速反应)决定了整体的反应速率,则合成氨反应的决速反应是
④反应过程中,如果仅增多Fe催化剂的量(不改变比表面积),合成氨反应的下列选项有变化的是
a.活化能 b.反应热 c.化学平衡常数 d.单位时间内NH3的产量
您最近一年使用:0次
名校
10 . 完成下列填空
(1)工业上常以水煤气(CO和H2)为原料合成甲醇。已知: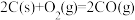
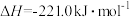 ;
;
 ,则C(s)与H2O(g)制备水煤气的热化学方程式为
,则C(s)与H2O(g)制备水煤气的热化学方程式为___________ 。
(2)一定条件下,在5L密闭容器中充入1 mol CO2和3 mol H2,发生反应:xCO2(g)+3H2(g) CH3OH(g)+H2O(g)。测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。
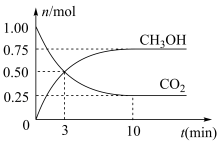
①x=___________ ;0~3min内H2的平均反应速率v(H2)=___________ mol/(L·min),平衡时H2的转化率为___________ 。
②下列措施能提高正反应速率的是___________ (填正确答案的字母)。
A. 降低温度 B. 增加CO2的量 C. 使用催化剂 D. 及时分离出甲醇
(1)工业上常以水煤气(CO和H2)为原料合成甲醇。已知:
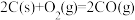
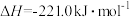 ;
;
 ,则C(s)与H2O(g)制备水煤气的热化学方程式为
,则C(s)与H2O(g)制备水煤气的热化学方程式为(2)一定条件下,在5L密闭容器中充入1 mol CO2和3 mol H2,发生反应:xCO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。
①x=
②下列措施能提高正反应速率的是
A. 降低温度 B. 增加CO2的量 C. 使用催化剂 D. 及时分离出甲醇
您最近一年使用:0次
2021-09-18更新
|
403次组卷
|
2卷引用:湖北省罗田县第一中学2021-2022学年高二上学期9月月考化学试题



