解题方法
1 . 煤和石油等化石燃料燃烧产生的 是大气中氮氧化物的主要来源。选择性催化还原脱硝技术是控制尾部烟气中
是大气中氮氧化物的主要来源。选择性催化还原脱硝技术是控制尾部烟气中 排放的最成熟有效的技术之一
排放的最成熟有效的技术之一
Ⅰ.在相同时间内,三种催化剂下NO的转化率、 浓度随温度变化如图1所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图2所示。
浓度随温度变化如图1所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图2所示。
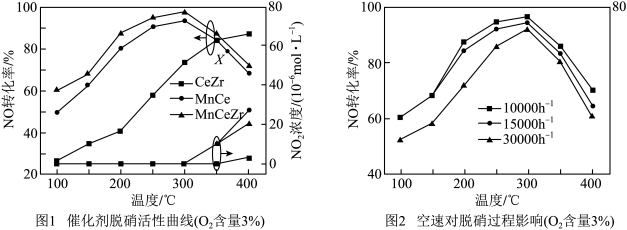
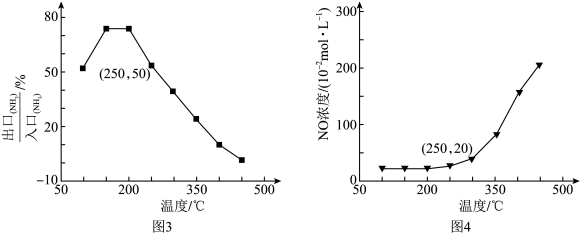
(1)根据图1和图2分析,选取工业脱硝的最佳反应条件为___________ 。350~400℃产生较多 的原因为
的原因为___________ 。
(2)通过改善催化剂的结构特性可以使脱硝效率得到提升。较低温度下,MnCeZr催化剂的脱硝效率远高于CeZr催化剂,说明主要是___________ (填元素符号)的存在改善了催化剂的低温活性。在MnCe催化剂催化下,X点的正反应速率___________ (填“>”“<”或“=”)逆反应速率,说明理由:___________ 。
Ⅱ.氧气的添加可以使较低温度下催化剂的脱硝效率迅速提高,氧气会与未反应的氨气反应。
i.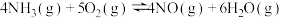

ii.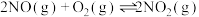
iii.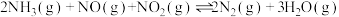
iv.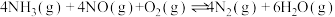
(3) =
=___________ (用 、
、 表示)。
表示)。
(4)已知反应i和反应iv为竞争反应,若只考虑这两个反应,相同时间内 的值随温度变化及出口NO浓度随温度变化分别如图3、图4所示。在容积为2L的恒容密闭容器中,
的值随温度变化及出口NO浓度随温度变化分别如图3、图4所示。在容积为2L的恒容密闭容器中, 、
、 均以4mol投料,250℃时反应已达平衡,则此时反应iv的平衡常数K=
均以4mol投料,250℃时反应已达平衡,则此时反应iv的平衡常数K=___________ (列出计算式)。
 是大气中氮氧化物的主要来源。选择性催化还原脱硝技术是控制尾部烟气中
是大气中氮氧化物的主要来源。选择性催化还原脱硝技术是控制尾部烟气中 排放的最成熟有效的技术之一
排放的最成熟有效的技术之一Ⅰ.在相同时间内,三种催化剂下NO的转化率、
 浓度随温度变化如图1所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图2所示。
浓度随温度变化如图1所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图2所示。
(1)根据图1和图2分析,选取工业脱硝的最佳反应条件为
 的原因为
的原因为(2)通过改善催化剂的结构特性可以使脱硝效率得到提升。较低温度下,MnCeZr催化剂的脱硝效率远高于CeZr催化剂,说明主要是
Ⅱ.氧气的添加可以使较低温度下催化剂的脱硝效率迅速提高,氧气会与未反应的氨气反应。
i.
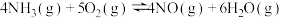

ii.
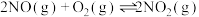
iii.
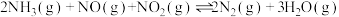
iv.
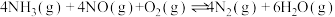
(3)
 =
= 、
、 表示)。
表示)。(4)已知反应i和反应iv为竞争反应,若只考虑这两个反应,相同时间内
 的值随温度变化及出口NO浓度随温度变化分别如图3、图4所示。在容积为2L的恒容密闭容器中,
的值随温度变化及出口NO浓度随温度变化分别如图3、图4所示。在容积为2L的恒容密闭容器中, 、
、 均以4mol投料,250℃时反应已达平衡,则此时反应iv的平衡常数K=
均以4mol投料,250℃时反应已达平衡,则此时反应iv的平衡常数K=
您最近一年使用:0次
2 . 碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H1=-566kJ⋅mol-1
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ⋅mol-1
CO(g)+2H2(g)=CH3OH(g) △H3=-107kJ⋅mol-1
则2CO2(g)+4H2O(g)=2CH3OH(g)+3O2(g) △H=___________ kJ⋅mol-1
(2)T℃时,向容积为2L的恒容密闭容器中通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=50kJ⋅mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
CH3OH(g)+H2O(g) △H=50kJ⋅mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
①在0~5min内容器中v(H2)=___________ 。
②反应过程中,下列各项指标能表明A容器中反应的v正<v逆的是___________ (填标号)。
a、体系内的压强增大
b、气体的平均相对分子质量减小
c、H2O(g)的物质的量增加
d、v正(CO2)=v逆(H2)
(3)T℃时,通入1.0molCO和3.0molH2于恒压容器(带可移动活塞)中,起始容积为2L,发生反应:CO(g)+2H2(g) CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
①该温度下上述反应的平衡常数K=___________ ;平衡时H2的转化率是___________ 。
②若达平衡后,再充入1.0molCO、4.0molH2、1.0molCH3OH,平衡___________ (填“向正反应方向”、“向逆反应方向”或“不”)移动。新平衡时H2的转化率___________ (填“增大”、“不变”或“减小”)
(1)已知:2CO(g)+O2(g)=2CO2(g) △H1=-566kJ⋅mol-1
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ⋅mol-1
CO(g)+2H2(g)=CH3OH(g) △H3=-107kJ⋅mol-1
则2CO2(g)+4H2O(g)=2CH3OH(g)+3O2(g) △H=
(2)T℃时,向容积为2L的恒容密闭容器中通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=50kJ⋅mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
CH3OH(g)+H2O(g) △H=50kJ⋅mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:①在0~5min内容器中v(H2)=
②反应过程中,下列各项指标能表明A容器中反应的v正<v逆的是
a、体系内的压强增大
b、气体的平均相对分子质量减小
c、H2O(g)的物质的量增加
d、v正(CO2)=v逆(H2)
(3)T℃时,通入1.0molCO和3.0molH2于恒压容器(带可移动活塞)中,起始容积为2L,发生反应:CO(g)+2H2(g)
 CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:①该温度下上述反应的平衡常数K=
②若达平衡后,再充入1.0molCO、4.0molH2、1.0molCH3OH,平衡
您最近一年使用:0次
解题方法
3 . 完成下列问题。
(1)研究NO2、SO2、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义
①已知:2SO2 (g)+O2(g) 2SO3 (g) △H = -196.6kJ/mol
2SO3 (g) △H = -196.6kJ/mol
2NO (g)+O2(g) 2NO2 (g) △H = -113.0kJ/mol
2NO2 (g) △H = -113.0kJ/mol
则反应NO2(g)+ SO2 (g) NO(g)+ SO3 (g) 的 △H =
NO(g)+ SO3 (g) 的 △H = _______ 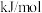
②在一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应。下列不能说明反应达到平衡状态的是_______ (填字母)。
a.混合气体密度保持不变 b.混合气体的颜色保持不变
c.NO2和SO2的体积比保持不变 d.每生成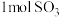 消耗
消耗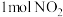
(2)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
CH3OH(g) ΔH,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
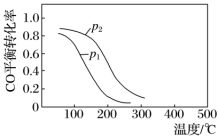
①ΔH_______ (填“>”“<”或“= ”)0。
②写出一条可同时提高反应速率和CO转化率的措施:_______ 。
③下列说法正确的是_______ (填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④ 0~3 min内用CH3OH表示的反应速率v(CH3OH)=_______ 。
⑤ 200 ℃时,该反应的平衡常数K=_______ 。向上述200 ℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则此时该反应的平衡移动方向为_______ (填“正反应方向”“逆反应方向”或“不移动”)。
(1)研究NO2、SO2、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义
①已知:2SO2 (g)+O2(g)
 2SO3 (g) △H = -196.6kJ/mol
2SO3 (g) △H = -196.6kJ/mol2NO (g)+O2(g)
 2NO2 (g) △H = -113.0kJ/mol
2NO2 (g) △H = -113.0kJ/mol则反应NO2(g)+ SO2 (g)
 NO(g)+ SO3 (g) 的 △H =
NO(g)+ SO3 (g) 的 △H = 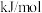
②在一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应。下列不能说明反应达到平衡状态的是
a.混合气体密度保持不变 b.混合气体的颜色保持不变
c.NO2和SO2的体积比保持不变 d.每生成
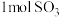 消耗
消耗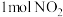
(2)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)
 CH3OH(g) ΔH,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
CH3OH(g) ΔH,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
②写出一条可同时提高反应速率和CO转化率的措施:
③下列说法正确的是
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④ 0~3 min内用CH3OH表示的反应速率v(CH3OH)=
⑤ 200 ℃时,该反应的平衡常数K=
您最近一年使用:0次
名校
4 . 在双碳目标驱动下,大批量氢燃料客车在2022年北京冬奥会上投入使用。氢源的获取和利用成为科学研究热点。回答下列问题:
Ⅰ.氢源的获取:电解液氨制氢
氨分子中具有较高的含氢量,因此是制氢的优选原料。现以液氨为原料,使用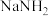 非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有
非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有 、
、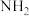 和
和 )
)
(1)产生 的电极反应式为
的电极反应式为______ 。
Ⅱ.氢源的利用: 还原
还原 制甲醇
制甲醇
(2)800℃时, 还原
还原 反应的热化学方程式及其平衡常数如下:
反应的热化学方程式及其平衡常数如下:
反应1:
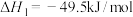

反应2: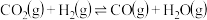

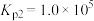
反应3: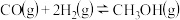
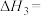
______ 
(3)800℃时,正反应进行的程度“反应2”______ “反应1”(选填“>”或“<”),判断依据是______ 。
(4)反应1在一定条件下建立平衡,关于反应1的相关描述正确的是______。
(5)某温度下,向2L恒容密闭容器中充入0.5mol 和0.9mol
和0.9mol 发生反应1和反应2,经过5min达到平衡状态,反应过程中
发生反应1和反应2,经过5min达到平衡状态,反应过程中 和
和 的物质的量随时间变化情况如下图所示:
的物质的量随时间变化情况如下图所示:
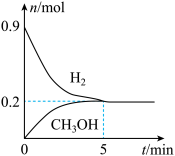
平衡时, 的转化率为
的转化率为______ ,该温度下,反应2的化学平衡常数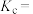
______ 。
(6) 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:______ 。
Ⅰ.氢源的获取:电解液氨制氢
氨分子中具有较高的含氢量,因此是制氢的优选原料。现以液氨为原料,使用
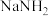 非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有
非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有 、
、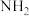 和
和 )
)(1)产生
 的电极反应式为
的电极反应式为Ⅱ.氢源的利用:
 还原
还原 制甲醇
制甲醇(2)800℃时,
 还原
还原 反应的热化学方程式及其平衡常数如下:
反应的热化学方程式及其平衡常数如下:反应1:

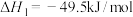

反应2:
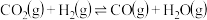

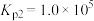
反应3:
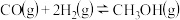
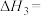

(3)800℃时,正反应进行的程度“反应2”
(4)反应1在一定条件下建立平衡,关于反应1的相关描述正确的是______。
| A.使用高效催化剂可降低反应的活化能,增大活化分子百分数,加快化学反应速率 |
| B.该反应的反应物总能量小于生成物总能量 |
| C.容器内气体的平均相对分子质量不再改变说明反应达到了平衡 |
D.增大压强,反应1的化学平衡常数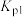 变小 变小 |
 和0.9mol
和0.9mol 发生反应1和反应2,经过5min达到平衡状态,反应过程中
发生反应1和反应2,经过5min达到平衡状态,反应过程中 和
和 的物质的量随时间变化情况如下图所示:
的物质的量随时间变化情况如下图所示:
平衡时,
 的转化率为
的转化率为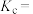
(6)
 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=_______
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为_______
②下列条件能判断该反应达到平衡状态的是_______
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:
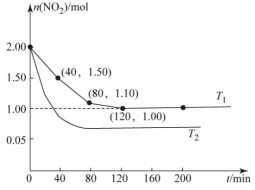
①T1_______ T2(填“>”或“<”)。
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=_______
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_______ 移动(填“正向”“逆向”或“不”)。
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为_______ (室温下,Ksp(CaCO3)=3×10-9,Ksp(CaSO4)=9×10-6)。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为
②下列条件能判断该反应达到平衡状态的是
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO
 =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为
您最近一年使用:0次
2021-06-27更新
|
1003次组卷
|
8卷引用:湖北省天门外国语学校2022-2023学年高二上学期12月月考化学试题
湖北省天门外国语学校2022-2023学年高二上学期12月月考化学试题四川省广安市2019-2020学年高二下学期期末(零诊)化学试题(已下线)理综化学-2021年秋季高三开学摸底考试卷01(课标全国专用)2021年海南高考化学试题变式题11-19(已下线)备战2022年高考化学精准检测卷【全国卷】08广东省湛江市第二十一中学2021—2022学年高三上学期11月月考化学试题四川省资中县球溪高级中学2022-2023学年高三上学期10月月考化学试题四川省内江市威远中学校2022-2023学年高二下学期第二次阶段性考试理综化学试题
名校
解题方法
6 . 二甲醚是一种重要的清洁燃料,也可替代氟氯昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________ 。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)=CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g)=CO2(g)+H2(g);△H=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的△H=________________ ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________________ (填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(3)下列可以说明反应③CO(g)+H2O(g) CO2(g)+H2(g)已经达到平衡状态的是
CO2(g)+H2(g)已经达到平衡状态的是________________ (填字母代号)。
A.单位时间内一个H-H键断裂的同时有两个H-O键断裂
B.H2O与CO2的浓度相等
C.温度和体积一定时,容器内的压强保持不变
D.条件一定时,混合气体的平均相对分子质量不再变化
E.温度和体积一定时,CO的浓度保持不变
(4)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
若加入CH3OH后,经过10min反应达到平衡,此时c(CH3OH)=___________ 。
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)=CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g)=CO2(g)+H2(g);△H=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的△H=
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(3)下列可以说明反应③CO(g)+H2O(g)
 CO2(g)+H2(g)已经达到平衡状态的是
CO2(g)+H2(g)已经达到平衡状态的是A.单位时间内一个H-H键断裂的同时有两个H-O键断裂
B.H2O与CO2的浓度相等
C.温度和体积一定时,容器内的压强保持不变
D.条件一定时,混合气体的平均相对分子质量不再变化
E.温度和体积一定时,CO的浓度保持不变
(4)已知反应②2CH3OH(g)
 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
若加入CH3OH后,经过10min反应达到平衡,此时c(CH3OH)=
您最近一年使用:0次
2020-10-17更新
|
172次组卷
|
3卷引用:湖北省华中师范大学潜江附属中学2021-2022学年高二上学期10月月考化学试题
解题方法
7 . “富煤、贫油、少气”是我国能源发展面临的现状,随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。图1是煤化工产业链之一。
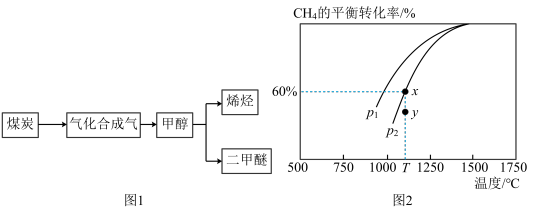
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H2,CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:
Ⅰ.C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
Ⅱ.C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=___ kJ/mol。
(2)在T1℃时,体积为1L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①下列情形能说明上述反应已达到平衡状态的是__ (填字母序号)。
a.体系压强保持不变
b.密闭容器中CO、H2、CH3OH(g)三种气体的物质的量相等
c.体系内的密度保持不变
d.每消耗1molCO的同时生成2molH2
②当起始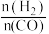 =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=___ ,此温度下的化学平衡常数为___ 。
(3)已知CO2(g)+CH4(g) 2CO(g)+2H2(g),在密闭容器中有浓度均为0.2mol/L的CH4与CO2,在一定条件下反应。测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1
2CO(g)+2H2(g),在密闭容器中有浓度均为0.2mol/L的CH4与CO2,在一定条件下反应。测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1___ p2(填“>”“<”或“=”,下同);当压强p2时,在y点:v(正)___ v(逆)。

“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H2,CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:
Ⅰ.C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
Ⅱ.C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=
(2)在T1℃时,体积为1L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应:CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。①下列情形能说明上述反应已达到平衡状态的是
a.体系压强保持不变
b.密闭容器中CO、H2、CH3OH(g)三种气体的物质的量相等
c.体系内的密度保持不变
d.每消耗1molCO的同时生成2molH2
②当起始
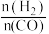 =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=(3)已知CO2(g)+CH4(g)
 2CO(g)+2H2(g),在密闭容器中有浓度均为0.2mol/L的CH4与CO2,在一定条件下反应。测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1
2CO(g)+2H2(g),在密闭容器中有浓度均为0.2mol/L的CH4与CO2,在一定条件下反应。测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强p1
您最近一年使用:0次
2020-08-25更新
|
156次组卷
|
2卷引用:湖北省仙桃、天门、潜江2019-2020学年高二下学期期末考试化学试题
解题方法
8 . 2018年6月27日,国务院发布《打赢蓝天保卫战三年行动计划》,该计划是中国政府部署的一项污染防治行动计划,旨在持续改善空气质量,为群众留住更多蓝天。对废气的进行必要的处理,让空气更加清洁是环境科学的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反应的平衡常数表达式为 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式_________________ 。
(2)用如图所示的电解装置可将雾霾中的NO、SO2分别转化为NH 和SO
和SO
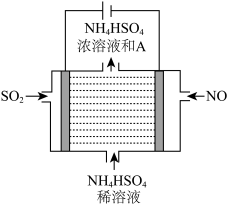
①写出物质A的化学式____________ 。
②NO在电极上发生的反应为_________________ 。
SO2在电极上发生的反应为__________________ 。
(3)工业上常用氨水吸收SO2,可生成NH4HSO3和(NH4)2SO3。
①某同学测得氨水吸收SO2所得溶液中NH4HSO3和(NH4)2SO3的物质的量之比恰好为2:1,写出该吸收过程的总反应方程式______________________________________ 。
②已知常温下H2S的电离常数Ka1=1.3×10-7,Ka2=7.1×10-15,将等物质的量浓度的NaHS与Na2S溶液等体积混合,所得溶液中离子浓度大小顺序为__________________ 。(用物质的量浓度符号由大到小排列)
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反应的平衡常数表达式为
 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)用如图所示的电解装置可将雾霾中的NO、SO2分别转化为NH
 和SO
和SO

①写出物质A的化学式
②NO在电极上发生的反应为
SO2在电极上发生的反应为
(3)工业上常用氨水吸收SO2,可生成NH4HSO3和(NH4)2SO3。
①某同学测得氨水吸收SO2所得溶液中NH4HSO3和(NH4)2SO3的物质的量之比恰好为2:1,写出该吸收过程的总反应方程式
②已知常温下H2S的电离常数Ka1=1.3×10-7,Ka2=7.1×10-15,将等物质的量浓度的NaHS与Na2S溶液等体积混合,所得溶液中离子浓度大小顺序为
您最近一年使用:0次
解题方法
9 . “低碳循环”引起各国的高度重视,而如何降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,引起了全世界的普遍重视。将
,引起了全世界的普遍重视。将 转化为甲醇:CO2(g)+3H2(g)
转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),此研究对
CH3OH(g)+H2O(g),此研究对 的深度开发应用和构建生态文明社会具有重要的意义。
的深度开发应用和构建生态文明社会具有重要的意义。
(1)在一恒温恒容密闭容器中充入1 mol 和3 mol
和3 mol  进行上述反应。测得
进行上述反应。测得 (g)和
(g)和 (g)浓度随时间变化如图所示。
(g)浓度随时间变化如图所示。
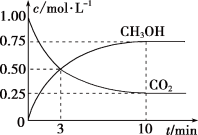
①0—10 min内,氢气的平均反应速率为____________ ,第10min后,保持温度不变,向该密闭容器中再充入2 mol (g)和2mol
(g)和2mol  (g),则平衡
(g),则平衡______________ (填“正向”“逆向”或“不”)移动。
②一定温度下,若此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是_______ 。
a.容器中压强不变 b. 的体积分数不变 c.c(
的体积分数不变 c.c( )=3c(
)=3c( )
)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(2)若已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 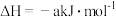
2H2(g)+O2(g)=2H2O(g)

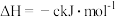
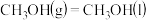
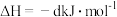
则表示 (l)燃烧热的热化学方程式为
(l)燃烧热的热化学方程式为_______________________________ 。
(3)如图,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解600 mL 一定浓度的NaCl溶液。
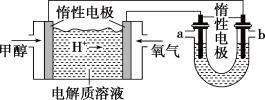
①U形管内发生的化学反应方程式为__________________________________ 。
②在电解一段时间后,NaCl溶液的pH变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为____________ mol。若向U形管内电解后的溶液中通入 气体,使所得溶液c(
气体,使所得溶液c(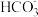 ):c(
):c( )=2:1,则此时溶液中的c(
)=2:1,则此时溶液中的c( )=
)= ________________  。(室温下,H2CO3的
。(室温下,H2CO3的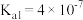 ;
;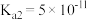 )。
)。
 的含量及有效地开发利用
的含量及有效地开发利用 ,引起了全世界的普遍重视。将
,引起了全世界的普遍重视。将 转化为甲醇:CO2(g)+3H2(g)
转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),此研究对
CH3OH(g)+H2O(g),此研究对 的深度开发应用和构建生态文明社会具有重要的意义。
的深度开发应用和构建生态文明社会具有重要的意义。(1)在一恒温恒容密闭容器中充入1 mol
 和3 mol
和3 mol  进行上述反应。测得
进行上述反应。测得 (g)和
(g)和 (g)浓度随时间变化如图所示。
(g)浓度随时间变化如图所示。
①0—10 min内,氢气的平均反应速率为
 (g)和2mol
(g)和2mol  (g),则平衡
(g),则平衡②一定温度下,若此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是
a.容器中压强不变 b.
 的体积分数不变 c.c(
的体积分数不变 c.c( )=3c(
)=3c( )
)d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(2)若已知:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 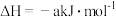
2H2(g)+O2(g)=2H2O(g)


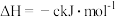
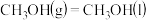
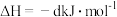
则表示
 (l)燃烧热的热化学方程式为
(l)燃烧热的热化学方程式为(3)如图,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解600 mL 一定浓度的NaCl溶液。

①U形管内发生的化学反应方程式为
②在电解一段时间后,NaCl溶液的pH变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为
 气体,使所得溶液c(
气体,使所得溶液c(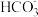 ):c(
):c( )=2:1,则此时溶液中的c(
)=2:1,则此时溶液中的c( )=
)=  。(室温下,H2CO3的
。(室温下,H2CO3的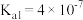 ;
;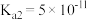 )。
)。
您最近一年使用:0次
10 . 铅及其化合物在工业生产、生活中具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1=akJ·mol-1
②PbS(s)2PbO(s)=3Pb(s)+SO2(g) △H2=b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H3=c kJ·mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s) △H=____________ kJ·mol-1(用含a、b、c的代数式表示)
(2)以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

①“酸溶”时,在Fe2+催化下,Pb和PbO2反应成1 mol PbSO4时转移电子的物质的量为_________ mol。
②已知:PbO溶解在NaOH溶液中,存在化学平衡:PbO(s)+NaOH(aq) NaHPbO2(aq),其溶解度曲线如图1所示:
NaHPbO2(aq),其溶解度曲线如图1所示:

结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量________ (填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_______________ (填 “趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(3)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图2所示:

①阴极的电极反应式为______________________ ;
②当有4.14gPb生成时,通过质子交换膜的n(H+)=______________________ 。
(4)PbI2可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00 mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生反应:2RH++PbI2 =R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图3)。加入酚酞指示剂,用0.0050mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液10.00mL。可计算出t℃时Ksp(PbI2)为_________________ 。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1=akJ·mol-1
②PbS(s)2PbO(s)=3Pb(s)+SO2(g) △H2=b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H3=c kJ·mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s) △H=
(2)以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

①“酸溶”时,在Fe2+催化下,Pb和PbO2反应成1 mol PbSO4时转移电子的物质的量为
②已知:PbO溶解在NaOH溶液中,存在化学平衡:PbO(s)+NaOH(aq)
 NaHPbO2(aq),其溶解度曲线如图1所示:
NaHPbO2(aq),其溶解度曲线如图1所示:
结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量
(3)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图2所示:

①阴极的电极反应式为
②当有4.14gPb生成时,通过质子交换膜的n(H+)=
(4)PbI2可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00 mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生反应:2RH++PbI2 =R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图3)。加入酚酞指示剂,用0.0050mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液10.00mL。可计算出t℃时Ksp(PbI2)为
您最近一年使用:0次
2018-07-02更新
|
184次组卷
|
2卷引用:【全国市级联考】湖北省天门市、仙桃市、潜江市2017-2018学年高二下学期期末联考化学试题



