解题方法
1 . 回答下列问题:
I.化石燃料燃烧过程中形成 和
和 等污染物,利用
等污染物,利用 脱除
脱除 的研究获得了广泛关注。在催化剂作用下,
的研究获得了广泛关注。在催化剂作用下, 与
与 的反应为
的反应为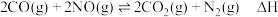 。回答下列问题:
。回答下列问题:
(1)已知: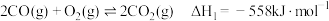
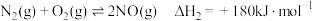
则
___________
(2)向某刚性容器中加入 、
、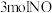 和催化剂,测得平衡时
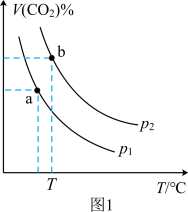
和催化剂,测得平衡时 的体积分数随温度和压强的关系如图1所示。
的体积分数随温度和压强的关系如图1所示。
①下列叙述不能说明反应已经达到平衡状态的是___________ (填标号)。
A.断裂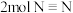 的同时生成
的同时生成
B.压强不再变化
C.混合气体的密度不再变化
D. 的体积分数不再变化
的体积分数不再变化
②压强
___________  (填“>”或“<”,下同),a、b两点的平衡常数
(填“>”或“<”,下同),a、b两点的平衡常数
___________  。
。
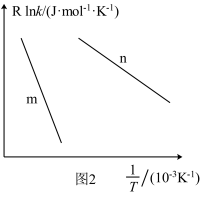
(3)已知Arrhenius经验公式为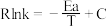 (Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是
(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是___________ (填“m”或“n”)。
Ⅱ. 在催化剂作用下,通过电催化还原为
在催化剂作用下,通过电催化还原为 、
、 等物质被认为是一种具有前景的利用
等物质被认为是一种具有前景的利用 的方式。
的方式。
(4) 催化剂中引入
催化剂中引入 能够提高它的选择性。
能够提高它的选择性。 的价电子排布式为
的价电子排布式为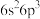 ,其在元素周期表中的位置为
,其在元素周期表中的位置为___________ 。
(5)写出 在酸性介质中电催化还原为
在酸性介质中电催化还原为 的电极反应式
的电极反应式___________ 。
I.化石燃料燃烧过程中形成
 和
和 等污染物,利用
等污染物,利用 脱除
脱除 的研究获得了广泛关注。在催化剂作用下,
的研究获得了广泛关注。在催化剂作用下, 与
与 的反应为
的反应为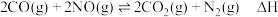 。回答下列问题:
。回答下列问题:(1)已知:
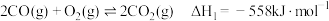
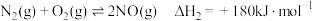
则

(2)向某刚性容器中加入
 、
、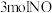 和催化剂,测得平衡时
和催化剂,测得平衡时 的体积分数随温度和压强的关系如图1所示。
的体积分数随温度和压强的关系如图1所示。
①下列叙述不能说明反应已经达到平衡状态的是
A.断裂
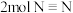 的同时生成
的同时生成
B.压强不再变化
C.混合气体的密度不再变化
D.
 的体积分数不再变化
的体积分数不再变化②压强

 (填“>”或“<”,下同),a、b两点的平衡常数
(填“>”或“<”,下同),a、b两点的平衡常数
 。
。(3)已知Arrhenius经验公式为
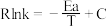 (Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是
(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是
Ⅱ.
 在催化剂作用下,通过电催化还原为
在催化剂作用下,通过电催化还原为 、
、 等物质被认为是一种具有前景的利用
等物质被认为是一种具有前景的利用 的方式。
的方式。(4)
 催化剂中引入
催化剂中引入 能够提高它的选择性。
能够提高它的选择性。 的价电子排布式为
的价电子排布式为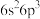 ,其在元素周期表中的位置为
,其在元素周期表中的位置为(5)写出
 在酸性介质中电催化还原为
在酸性介质中电催化还原为 的电极反应式
的电极反应式
您最近一年使用:0次
2 . 2019年12月4日“全球碳计划”发布报告说,全球CO2排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是用CO2转化成为有机物实现碳循环。如:
C2H4 (g) + H2O(l) C2H5OH(l) ΔH=- 44.2 kJ·mol−1
C2H5OH(l) ΔH=- 44.2 kJ·mol−1
2CO2(g) + 2H2O(l) C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol−1
C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol−1
已知2CO2(g) + 3H2O(l) C2H5OH(l) + 3O2(g)其正反应的活化能为Ea kJ·mol−1,则逆反应的活化能为
C2H5OH(l) + 3O2(g)其正反应的活化能为Ea kJ·mol−1,则逆反应的活化能为___________ kJ·mol−1。
(2)利用工业废气中的 CO2可以制取甲醇和水蒸气,一定条件下,往2 L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应 I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
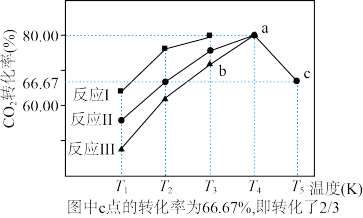
①催化剂效果最佳的反应是__________ (填“反应I”,“反应II”,“反应III”)。
②b点v(正)___________ v(逆) (填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因______________ 。
④c点时该反应的平衡常数K=__________________ 。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:
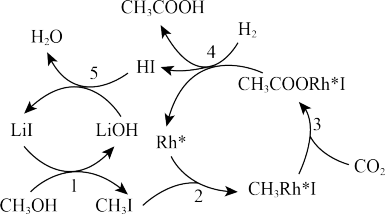
①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式________________ 。
②根据图示,写出总反应的化学方程式:________________ 。
(1)一种途径是用CO2转化成为有机物实现碳循环。如:
C2H4 (g) + H2O(l)
 C2H5OH(l) ΔH=- 44.2 kJ·mol−1
C2H5OH(l) ΔH=- 44.2 kJ·mol−12CO2(g) + 2H2O(l)
 C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol−1
C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol−1已知2CO2(g) + 3H2O(l)
 C2H5OH(l) + 3O2(g)其正反应的活化能为Ea kJ·mol−1,则逆反应的活化能为
C2H5OH(l) + 3O2(g)其正反应的活化能为Ea kJ·mol−1,则逆反应的活化能为(2)利用工业废气中的 CO2可以制取甲醇和水蒸气,一定条件下,往2 L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应 I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:

①催化剂效果最佳的反应是
②b点v(正)
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因
④c点时该反应的平衡常数K=
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:

①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式
②根据图示,写出总反应的化学方程式:
您最近一年使用:0次
3 . 有效去除大气中的NOx,保护臭氧层,是环境保护的重要课题。
(1)在没有NOx催化时,O3的分解可分为以下两步反应进行;
①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=____________ 。
(2)NO做催化剂可以加速臭氧反应,其反应过程如图所示:

已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为____________________________ 。
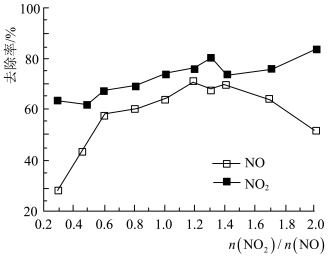
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变 ,NOx的去除率如图所示。
,NOx的去除率如图所示。
已知:NO与Ca(OH)2不反应;
NOx的去除率=1-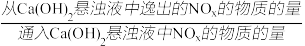 ×100%
×100%
① 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________ 。
②当 大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是
大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8 kJ/mol,反应达到平衡时,N2的体积分数随 的变化曲线如图。
的变化曲线如图。
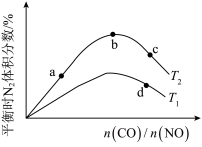
①b点时,平衡体系中C、N原子个数之比接近________ 。
②a、b、c三点CO的转化率从小到大的顺序为________ ;b、c、d三点的平衡常数从大到小的顺序为__________ (以上两空均用a、b、c、d表示)。
③若 =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____ 。
(1)在没有NOx催化时,O3的分解可分为以下两步反应进行;
①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=
(2)NO做催化剂可以加速臭氧反应,其反应过程如图所示:

已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变
 ,NOx的去除率如图所示。
,NOx的去除率如图所示。已知:NO与Ca(OH)2不反应;

NOx的去除率=1-
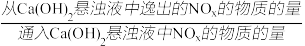 ×100%
×100%①
 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:②当
 大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是
大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8 kJ/mol,反应达到平衡时,N2的体积分数随
 的变化曲线如图。
的变化曲线如图。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从小到大的顺序为
③若
 =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为
您最近一年使用:0次
2020-04-28更新
|
315次组卷
|
5卷引用:湖北省荆门市2020届高三4月模拟考试理综化学试题
解题方法
4 . Ⅰ.已知NO(g)+CO2(g)=NO2(g)+CO(g) ΔH1;2CO(g)+O2(g)=2CO2(g) ΔH2
则2NO2(g) 2NO(g)+O2(g)的反应热ΔH=
2NO(g)+O2(g)的反应热ΔH=___ (用含△H1,△H2的代数式表示)。
Ⅱ.某条件下,在2L密闭容器中发生如下反应:2NO2(g) 2NO(g)+O2(g) ΔH,在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g) ΔH,在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
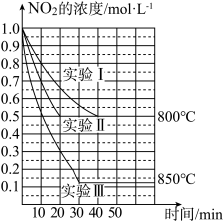
(1)实验Ⅱ隐含的反应条件是___ 。
(2)实验Ⅱ中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为___ 。
(3)800℃时,该反应的平衡常数K=___ 。该反应是___ (填“吸”或“放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),此时正反应方向速率___ 逆反应方向速率(填“大于”或“等于”或“小于”)。
(5)若实验Ⅰ中达到平衡后,再向密闭容器中再通入一定量的NO2(保持温度不变),一段时间后达到新平衡,则新平衡与原平衡相比混合气体中NO2的体积分数___ (填“增大”或“不变”或“减小”)。
(6)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2 7N2+12H2O。该反应中氧化产物与还原产物物质的量的比为:
7N2+12H2O。该反应中氧化产物与还原产物物质的量的比为:___ 。
则2NO2(g)
 2NO(g)+O2(g)的反应热ΔH=
2NO(g)+O2(g)的反应热ΔH=Ⅱ.某条件下,在2L密闭容器中发生如下反应:2NO2(g)
 2NO(g)+O2(g) ΔH,在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g) ΔH,在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
(1)实验Ⅱ隐含的反应条件是
(2)实验Ⅱ中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为
(3)800℃时,该反应的平衡常数K=
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),此时正反应方向速率
(5)若实验Ⅰ中达到平衡后,再向密闭容器中再通入一定量的NO2(保持温度不变),一段时间后达到新平衡,则新平衡与原平衡相比混合气体中NO2的体积分数
(6)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2
 7N2+12H2O。该反应中氧化产物与还原产物物质的量的比为:
7N2+12H2O。该反应中氧化产物与还原产物物质的量的比为:
您最近一年使用:0次
名校
解题方法
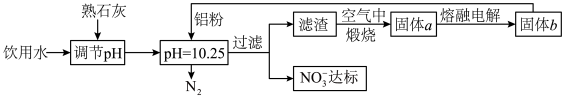
5 . 饮用水的质量关系到关系到每个人的健康,因含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(II),使其失去携氧功能,为了降低饮用水中NO3-的浓度,某兴趣小组提出如图方案:
请回答下列问题:
(1)人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、颗粒细小的还原铁粉,这些铁粉在人体胃酸(胃酸的主要成分是HCl)作用下转化成亚铁盐。写出该反应的离子方程式:____ 。
(2)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3-反应的离子方程式为__ 。
(3)该方案中选用熟石灰调节pH,理由是___ 、___ 。
(4)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为___ 。
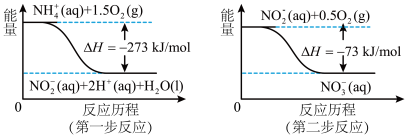
(5)饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如图,试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是____ 。

请回答下列问题:
(1)人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、颗粒细小的还原铁粉,这些铁粉在人体胃酸(胃酸的主要成分是HCl)作用下转化成亚铁盐。写出该反应的离子方程式:
(2)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3-反应的离子方程式为
(3)该方案中选用熟石灰调节pH,理由是
(4)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为
(5)饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如图,试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是

您最近一年使用:0次
名校
解题方法
6 . 已知:用NH3催化还原NOx时包含以下反应.
反应①:4NH3 (g)+6NO(g) 5N2(g)+6H2O(l) ∆H1=-1 807. 0 kJ·mol—1,
5N2(g)+6H2O(l) ∆H1=-1 807. 0 kJ·mol—1,
反应②:4NH3(g)+6NO2(g) 5N2(g)+3O2(g)+6H2O(l) ∆H2=?
5N2(g)+3O2(g)+6H2O(l) ∆H2=?
反应③:2NO(g)+O2(g) 2NO2(g) ∆H3=-113.0kJ·mol一1
2NO2(g) ∆H3=-113.0kJ·mol一1
(1)反应②的∆H2==_____________ 。
(2)为探究温度及不同催化剂对反应①的影响.分别在不同温度、不同催化剂下.保持其他初始条件不变重复实验.在相同时间内测得N2浓度的变化情况如下图所示。
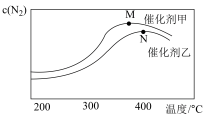
①反应①的平衡常数的表达式K=________ 。相同温度下.在催化剂甲的作用下反应的平衡常数______ (填“大于”“小于”或“等于”)在催化剂乙的作用下反应的平衡常数。
②N点后N2浓度减小的原因可能是_____________________ 。
(3)某温度下,在1 L恒容密闭容器中初始投入4 mol NH3和6 mol NO发生反应①.当气体总物质的量为7.5mol时反应达到平衡.则NH3的转化率为____ ,达平衡所用时间为5 min.则用NO表示此反应0~5 min内的平均反应速率为______ .
反应①:4NH3 (g)+6NO(g)
 5N2(g)+6H2O(l) ∆H1=-1 807. 0 kJ·mol—1,
5N2(g)+6H2O(l) ∆H1=-1 807. 0 kJ·mol—1,反应②:4NH3(g)+6NO2(g)
 5N2(g)+3O2(g)+6H2O(l) ∆H2=?
5N2(g)+3O2(g)+6H2O(l) ∆H2=?反应③:2NO(g)+O2(g)
 2NO2(g) ∆H3=-113.0kJ·mol一1
2NO2(g) ∆H3=-113.0kJ·mol一1(1)反应②的∆H2==
(2)为探究温度及不同催化剂对反应①的影响.分别在不同温度、不同催化剂下.保持其他初始条件不变重复实验.在相同时间内测得N2浓度的变化情况如下图所示。

①反应①的平衡常数的表达式K=
②N点后N2浓度减小的原因可能是
(3)某温度下,在1 L恒容密闭容器中初始投入4 mol NH3和6 mol NO发生反应①.当气体总物质的量为7.5mol时反应达到平衡.则NH3的转化率为
您最近一年使用:0次
2019-07-30更新
|
174次组卷
|
3卷引用:湖北省荆门市龙泉中学、巴东一中2019-2020学年高二10月联考化学试题
名校
7 . 氨气是重要的化工原料。
(1)已知: N2(g)+O2(g)=2NO(g) △H= +180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H= -905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H= -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:_____________________ ;如果在1 L密闭容器中,3mol NH3 在等温条件下充分反应,2min后达到平衡,平衡时吸收的热量为92.4 kJ ,则在这段时间内v(H2)=___________________ ;保持温度不变,将起始NH3的物质的量调整为8 mol,平衡时NH3的转化率为_________________ 。
(2)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:___________________ ,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是 _____________ (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________________________ 。
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是
4NO(g)+6H2O(g) △H<0。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是____________ (填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(4)如果某氨水的电离程度为1%,向浓度为0.01 mol/L MgCl2溶液中滴加氨水,则开始产生沉淀时(忽略溶液体积变化)溶液中的NH3·H2O的浓度为______________ (已知Ksp[Mg(OH)2]=4.010-12])。
(1)已知: N2(g)+O2(g)=2NO(g) △H= +180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H= -905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H= -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:
(2)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H<0。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是
4NO(g)+6H2O(g) △H<0。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(4)如果某氨水的电离程度为1%,向浓度为0.01 mol/L MgCl2溶液中滴加氨水,则开始产生沉淀时(忽略溶液体积变化)溶液中的NH3·H2O的浓度为
您最近一年使用:0次
8 . 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=—1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H= —566kJ/mol
则表示甲烷燃烧热的热化学方程式____________________________________________ 。
(2)氢气、甲烷、甲醇是优质的清洁燃料,可制作燃料电池。
某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是___________ (填序号)

A.电源中的a一定为正极,b一定为负极
B.不能用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++ 2e-= H2↑
(3)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
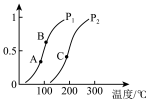
①一定条件下CH4的平衡转化率与温度、压强的关系如图,则Pl_________ P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为___________ (填“<”、“>”“=”)
②100℃时,将1mol CH4和2mol H2O通入容积为10L的反应室,反应达平衡的标志是:_______
a.容器的压强恒定
b.单位时间内消耗0.1mol CH4同时生成0.3mol H2
c.容器内气体密度恒定
d.3v(CH4)=v(H2)
e. 容器内气体平均相对分子质量恒定
③如果将1mol CH4和2mol H2O通入容积为10L的反应室达到平衡时CH4的转化率为50%,则100℃时该反应的平衡常数K=___________ 。
(4)已知2H2(g)+CO(g) CH3OH(g)△H=-akJ•mol-1(a>0),在一个容积固定的容器中加入2mol H2和1mol CO,在500℃时充分反应,达平衡后CH3OH的浓度为W mol•L-1。反应平衡后,若向原来容器中再加入2mol H2和1mol CO,500℃充分反应再次达平衡后,则CH3OH浓度
CH3OH(g)△H=-akJ•mol-1(a>0),在一个容积固定的容器中加入2mol H2和1mol CO,在500℃时充分反应,达平衡后CH3OH的浓度为W mol•L-1。反应平衡后,若向原来容器中再加入2mol H2和1mol CO,500℃充分反应再次达平衡后,则CH3OH浓度___________ 2Wmol•L-1(填“>”、“<”或“=”)。
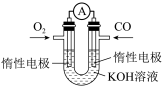
(5)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图所示的电池装置,
①负极的电极反应式为___________ ,
②用该原电池做电源,用惰性电极电解200mL饱和食盐水(足量),消耗标准状况下的CO 224mL,则溶液的pH=___________
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=—1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H= —566kJ/mol
则表示甲烷燃烧热的热化学方程式
(2)氢气、甲烷、甲醇是优质的清洁燃料,可制作燃料电池。
某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是

A.电源中的a一定为正极,b一定为负极
B.不能用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++ 2e-= H2↑
(3)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)

①一定条件下CH4的平衡转化率与温度、压强的关系如图,则Pl
②100℃时,将1mol CH4和2mol H2O通入容积为10L的反应室,反应达平衡的标志是:
a.容器的压强恒定
b.单位时间内消耗0.1mol CH4同时生成0.3mol H2
c.容器内气体密度恒定
d.3v(CH4)=v(H2)
e. 容器内气体平均相对分子质量恒定
③如果将1mol CH4和2mol H2O通入容积为10L的反应室达到平衡时CH4的转化率为50%,则100℃时该反应的平衡常数K=
(4)已知2H2(g)+CO(g)
 CH3OH(g)△H=-akJ•mol-1(a>0),在一个容积固定的容器中加入2mol H2和1mol CO,在500℃时充分反应,达平衡后CH3OH的浓度为W mol•L-1。反应平衡后,若向原来容器中再加入2mol H2和1mol CO,500℃充分反应再次达平衡后,则CH3OH浓度
CH3OH(g)△H=-akJ•mol-1(a>0),在一个容积固定的容器中加入2mol H2和1mol CO,在500℃时充分反应,达平衡后CH3OH的浓度为W mol•L-1。反应平衡后,若向原来容器中再加入2mol H2和1mol CO,500℃充分反应再次达平衡后,则CH3OH浓度(5)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图所示的电池装置,
①负极的电极反应式为
②用该原电池做电源,用惰性电极电解200mL饱和食盐水(足量),消耗标准状况下的CO 224mL,则溶液的pH=
您最近一年使用:0次
名校
解题方法
9 . 目前,人们对环境保护、新能源的开发很重视。
Ⅰ.(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:
4CO(g)+2NO2(g) 4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是
4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是____ (填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体平均密度保持不变
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s)ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5 kJ·mol-1
③H2O(l)=H2O(g)ΔH=+44.0 kJ· mol-1,
写出CO2与NH3合成尿素和液态水的热化学反应方程式_____________________ 。
(3)在饱和的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
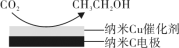
①阴极的电极反应式是___________________________ 。
②从电解后溶液中分离出乙醇的操作方法是____________ (选填字母)。
a.分液 b.过滤 c.蒸馏 d.升华
Ⅱ.工业上利用吸热反应C(s)+2H2O(g) CO2(g)+2H2(g),可制备氢气,氢能源是一种安全高效的新能源。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
CO2(g)+2H2(g),可制备氢气,氢能源是一种安全高效的新能源。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
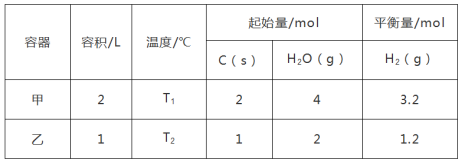
T1℃时,该反应的平衡常数K=_______ ;T1_______ T2(填“>”、“=”或“<”)。
Ⅲ.利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g),已知不同温度对CO2的平衡转化率及催化剂的催化效率影响如图所示,
CH2=CH2(g)+4H2O(g),已知不同温度对CO2的平衡转化率及催化剂的催化效率影响如图所示,
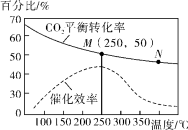
下列有关说法不正确的是________ (填序号)。
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③实际反应应尽可能在较低的温度下进行,以提高CO2的平衡转化率
④温度低于250℃时,随温度升高乙烯的产率减小
Ⅰ.(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:
4CO(g)+2NO2(g)
 4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是
4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体平均密度保持不变
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s)ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5 kJ·mol-1
③H2O(l)=H2O(g)ΔH=+44.0 kJ· mol-1,
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)在饱和的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。

①阴极的电极反应式是
②从电解后溶液中分离出乙醇的操作方法是
a.分液 b.过滤 c.蒸馏 d.升华
Ⅱ.工业上利用吸热反应C(s)+2H2O(g)
 CO2(g)+2H2(g),可制备氢气,氢能源是一种安全高效的新能源。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
CO2(g)+2H2(g),可制备氢气,氢能源是一种安全高效的新能源。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
T1℃时,该反应的平衡常数K=
Ⅲ.利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g)
 CH2=CH2(g)+4H2O(g),已知不同温度对CO2的平衡转化率及催化剂的催化效率影响如图所示,
CH2=CH2(g)+4H2O(g),已知不同温度对CO2的平衡转化率及催化剂的催化效率影响如图所示,
下列有关说法不正确的是
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③实际反应应尽可能在较低的温度下进行,以提高CO2的平衡转化率
④温度低于250℃时,随温度升高乙烯的产率减小
您最近一年使用:0次
名校
解题方法
10 . 氮及其化合物在生产生活中有重要作用。
(1)已知:①氢气的燃烧热为285 kJ/mol ②N2(g) + 2O2(g) = 2NO2(g) ΔH=+133 kJ/mol。试写出H2还原NO2生成液态水和另一种无毒物质的热化学方程式_________________ 。
(2)一氯胺(NH2Cl)的电子式为_______________ ,一氯胺是重要的水消毒剂,其原因是一氯胺在水中会部分水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为______________ 。
(3)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g) NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
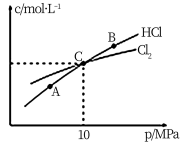
①该反应的ΔH______ 0(填“>”或“<”) ,乙容器中,0~40 min内用Cl2的浓度变化表示的平均反应速率v(Cl2)=_______________________ 。
②对该反应,下列说法不正确的是________________ (填选项字母)。
A.若甲容器内气体密度不变,则表明反应达到平衡状态
B.若乙容器内Cl2和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,分离出少量产物NHCl2,有助于提高Cl2的转化率
③恒温条件下,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示,则A、B、C三点中Cl2转化率最高的是_________ (填“A”“B”或“C”)。
(1)已知:①氢气的燃烧热为285 kJ/mol ②N2(g) + 2O2(g) = 2NO2(g) ΔH=+133 kJ/mol。试写出H2还原NO2生成液态水和另一种无毒物质的热化学方程式
(2)一氯胺(NH2Cl)的电子式为
(3)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)
 NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:| t/min | 0 | 20 | 40 | 60 | 80 |
| n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应的ΔH
②对该反应,下列说法不正确的是
A.若甲容器内气体密度不变,则表明反应达到平衡状态
B.若乙容器内Cl2和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,分离出少量产物NHCl2,有助于提高Cl2的转化率
③恒温条件下,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示,则A、B、C三点中Cl2转化率最高的是

您最近一年使用:0次



