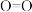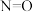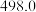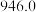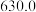氮及其化合物在生产生活中有重要作用。
(1)已知:①氢气的燃烧热为285 kJ/mol ②N2(g) + 2O2(g) = 2NO2(g) ΔH=+133 kJ/mol。试写出H2还原NO2生成液态水和另一种无毒物质的热化学方程式_________________ 。
(2)一氯胺(NH2Cl)的电子式为_______________ ,一氯胺是重要的水消毒剂,其原因是一氯胺在水中会部分水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为______________ 。
(3)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g) NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
①该反应的ΔH______ 0(填“>”或“<”) ,乙容器中,0~40 min内用Cl2的浓度变化表示的平均反应速率v(Cl2)=_______________________ 。
②对该反应,下列说法不正确的是________________ (填选项字母)。
A.若甲容器内气体密度不变,则表明反应达到平衡状态
B.若乙容器内Cl2和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,分离出少量产物NHCl2,有助于提高Cl2的转化率
③恒温条件下,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示,则A、B、C三点中Cl2转化率最高的是_________ (填“A”“B”或“C”)。
(1)已知:①氢气的燃烧热为285 kJ/mol ②N2(g) + 2O2(g) = 2NO2(g) ΔH=+133 kJ/mol。试写出H2还原NO2生成液态水和另一种无毒物质的热化学方程式
(2)一氯胺(NH2Cl)的电子式为
(3)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)
 NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:| t/min | 0 | 20 | 40 | 60 | 80 |
| n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应的ΔH
②对该反应,下列说法不正确的是
A.若甲容器内气体密度不变,则表明反应达到平衡状态
B.若乙容器内Cl2和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,分离出少量产物NHCl2,有助于提高Cl2的转化率
③恒温条件下,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示,则A、B、C三点中Cl2转化率最高的是

更新时间:2019-01-11 15:52:28
|
相似题推荐
【推荐1】随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
(1)方法1:以CO2和NH3为原料合成尿素2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H=-87kJ•mol-1。研究发现,合成尿素反应分两步完成。
CO(NH2)2(s)+H2O(g) ∆H=-87kJ•mol-1。研究发现,合成尿素反应分两步完成。
第1步:2NH3(g)+CO2(g) NH2COONH4(s) ∆H1=-159.47kJ•mol-1
NH2COONH4(s) ∆H1=-159.47kJ•mol-1
第2步:……
①第2步反应的热化学反应方程式为_________ 。
②一定条件下的恒容容器中,充入1.5molNH3和1molCO2,平衡时CO2的转化率为50%,则平衡时n(NH3):n(CO2)=_______ ,已知第2步反应的Kp=mkPa,测得平衡时容器内总压为3mkPa,则反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)的平衡常数Kp=
CO(NH2)2(s)+H2O(g)的平衡常数Kp=________ 。
③若要提高NH3平衡转化率,可采取的措施有_______ (任写一条)。
(2)方法2:电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:
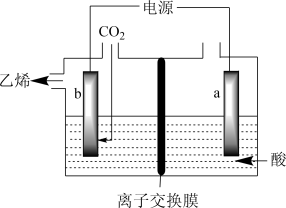
阴极电极反应式为________ ,该装置中使用的是_______ (填“阴”或“阳”)离子交换膜。
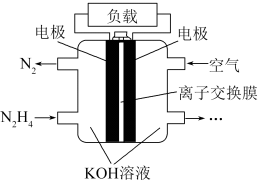
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为________ ,正极反应式为________ 。
(1)方法1:以CO2和NH3为原料合成尿素2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H=-87kJ•mol-1。研究发现,合成尿素反应分两步完成。
CO(NH2)2(s)+H2O(g) ∆H=-87kJ•mol-1。研究发现,合成尿素反应分两步完成。第1步:2NH3(g)+CO2(g)
 NH2COONH4(s) ∆H1=-159.47kJ•mol-1
NH2COONH4(s) ∆H1=-159.47kJ•mol-1第2步:……
①第2步反应的热化学反应方程式为
②一定条件下的恒容容器中,充入1.5molNH3和1molCO2,平衡时CO2的转化率为50%,则平衡时n(NH3):n(CO2)=
 CO(NH2)2(s)+H2O(g)的平衡常数Kp=
CO(NH2)2(s)+H2O(g)的平衡常数Kp=③若要提高NH3平衡转化率,可采取的措施有
(2)方法2:电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:

阴极电极反应式为
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)===N2(g)+2CO2(g),请回答下列问题:
(1)已知:N2(g)+O2(g)===2NO(g) ΔH=+180.5kJ·mol−1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol−1
2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol−1
则2NO(g)+2CO(g)===N2(g)+2CO2(g)的ΔH=____________ kJ·mol−1。
(2)一定温度下,向容积为1L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1mol,n(NO)=0.2mol,n(N2)=a mol,且平衡时混合气体压强为初始气体压强的0.8。
①则该反应的平衡常数K=____________ 。若保持温度及容器容积不变,平衡后在此基础上再向容器中充入2a mol的N2、0.2mol的NO,平衡将____________ (填“向左”“向右”或“不”)移动。
②下列各种情况,可说明该反应已经达到平衡状态的是____________ (填字母)。
A.v(CO2)生成=v(CO)消耗
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n mol N≡N
③在t2时刻,改变某一外界条件,正反应速率的变化曲线如图所示:可能改变的条件是____________ 、_________ 。
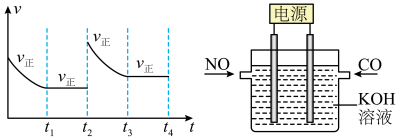
(3)有人提出可以用如图所示的电解原理的方法消除汽车尾气,写出阳极发生的电极反应式:________________________________________ 。
(4)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采用的措施是__________ 。
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
(1)已知:N2(g)+O2(g)===2NO(g) ΔH=+180.5kJ·mol−1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol−1
2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol−1
则2NO(g)+2CO(g)===N2(g)+2CO2(g)的ΔH=
(2)一定温度下,向容积为1L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1mol,n(NO)=0.2mol,n(N2)=a mol,且平衡时混合气体压强为初始气体压强的0.8。
①则该反应的平衡常数K=
②下列各种情况,可说明该反应已经达到平衡状态的是
A.v(CO2)生成=v(CO)消耗
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n mol N≡N
③在t2时刻,改变某一外界条件,正反应速率的变化曲线如图所示:可能改变的条件是

(3)有人提出可以用如图所示的电解原理的方法消除汽车尾气,写出阳极发生的电极反应式:
(4)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采用的措施是
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式_____________________________________ ;
已知:3Fe (s)+2O2(g)="=" Fe3O4(s) △H=-1118.4kJ• mol—1,根据以上信息,则反应 3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g) 的△H=_______________________ ,该反应达平衡时,化学平衡常数表达式K=___________________________ 。
(2)某学生实验小组用50mL0.50mol•L—1的盐酸与50mL0.50mol•L—1的NaOH溶液在下图所示的装置中进行中和反应反应热的测定
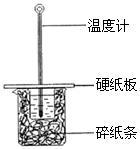
①图中装置缺少的一种仪器,该仪器名称为_____ 。
②将反应混合液的____ 温度记为反应的终止温度。
③下列说法正确的是_____________
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
已知:3Fe (s)+2O2(g)="=" Fe3O4(s) △H=-1118.4kJ• mol—1,根据以上信息,则反应 3Fe(s)+4H2O(g)==Fe3O4(s)+4H2(g) 的△H=
(2)某学生实验小组用50mL0.50mol•L—1的盐酸与50mL0.50mol•L—1的NaOH溶液在下图所示的装置中进行中和反应反应热的测定


①图中装置缺少的一种仪器,该仪器名称为
②将反应混合液的
③下列说法正确的是
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ·mol-1,答下列问题:
2SO3(g) △H=-196.6kJ·mol-1,答下列问题:
(1)某温度下,在体积为2L的刚性密闭容器中投入2mol SO2和3.5mol O2,下图是n(SO2)和n(SO3)随时间变化曲线。
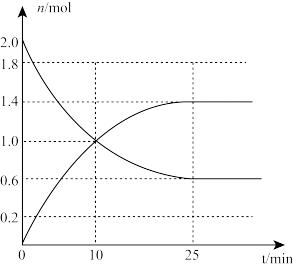
①0~10分钟SO3的平均速率v(SO3)=_______ 。
②反应达到平衡时,反应的平衡常数K=_______ (保留3位有效数字)。
③下列情况不能说明该反应达到化学平衡的是_______ 。
A. v(SO3)=2v(O2)
B. 混合气体的相对分子质量不再变化
C. t 时刻,体系的温度不再发生改变
D. 混合气体的密度保持不变
(2)下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
①从表中数据得出,最优的条件是_______ 。
②在实际生产中,选定的温度为400~500℃和常压(0.1MPa),原因是_______ 。
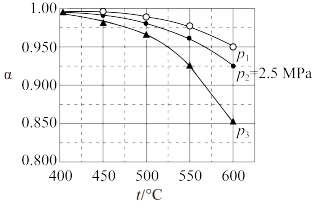
③当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2的平衡转化率α随温度的变化如下图所示。反应在5.0MPa、550℃时的α=_______ 。影响α的因素有温度、压强和_______ 。
 2SO3(g) △H=-196.6kJ·mol-1,答下列问题:
2SO3(g) △H=-196.6kJ·mol-1,答下列问题:(1)某温度下,在体积为2L的刚性密闭容器中投入2mol SO2和3.5mol O2,下图是n(SO2)和n(SO3)随时间变化曲线。

①0~10分钟SO3的平均速率v(SO3)=
②反应达到平衡时,反应的平衡常数K=
③下列情况不能说明该反应达到化学平衡的是
A. v(SO3)=2v(O2)
B. 混合气体的相对分子质量不再变化
C. t 时刻,体系的温度不再发生改变
D. 混合气体的密度保持不变
(2)下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
①从表中数据得出,最优的条件是
②在实际生产中,选定的温度为400~500℃和常压(0.1MPa),原因是
③当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2的平衡转化率α随温度的变化如下图所示。反应在5.0MPa、550℃时的α=

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】 和
和 是重要的能源物质,也是重要的化工原料。为倡导“节能减排”和“低碳经济”,降低大气中
是重要的能源物质,也是重要的化工原料。为倡导“节能减排”和“低碳经济”,降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,工业上通常用
,工业上通常用 来生产燃料甲醇。在体积为
来生产燃料甲醇。在体积为 的密闭容器中,充入
的密闭容器中,充入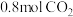 和
和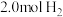 ,一定条件下发生反应:
,一定条件下发生反应: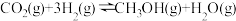 。测得
。测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。

(1)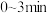 内用
内用 表示该反应的化学反应速率为
表示该反应的化学反应速率为_______ 。
(2)下列措施能提高该反应的化学反应速率的是_______ 。
A.升高温度 B.加入适宜的催化剂 C.缩小容器的体积
(3)能说明上述反应已达到平衡状态的是_______(填字母)。
(4)达到平衡时, 的转化率为
的转化率为_______ ,此时混合气体中 和
和 的物质的量之比为
的物质的量之比为_______ 。
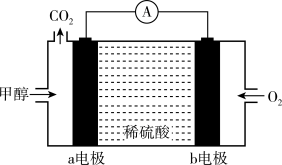
(5)下图为甲醇燃料电池的简易装置,图中a电极为_______ 极(填“正”或“负”);b电极的电极反应式为_______ 。
 和
和 是重要的能源物质,也是重要的化工原料。为倡导“节能减排”和“低碳经济”,降低大气中
是重要的能源物质,也是重要的化工原料。为倡导“节能减排”和“低碳经济”,降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,工业上通常用
,工业上通常用 来生产燃料甲醇。在体积为
来生产燃料甲醇。在体积为 的密闭容器中,充入
的密闭容器中,充入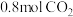 和
和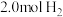 ,一定条件下发生反应:
,一定条件下发生反应: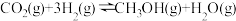 。测得
。测得 和
和 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
(1)
 内用
内用 表示该反应的化学反应速率为
表示该反应的化学反应速率为(2)下列措施能提高该反应的化学反应速率的是
A.升高温度 B.加入适宜的催化剂 C.缩小容器的体积
(3)能说明上述反应已达到平衡状态的是_______(填字母)。
A. 四种气体的物质的量浓度之比为1∶3∶1∶1 四种气体的物质的量浓度之比为1∶3∶1∶1 |
| B.容器内混合气体的压强保持不变 |
C. 的消耗速率与 的消耗速率与 的生成速率之比为1∶1 的生成速率之比为1∶1 |
| D.容器内混合气体的平均相对分子质量保持不变 |
 的转化率为
的转化率为 和
和 的物质的量之比为
的物质的量之比为(5)下图为甲醇燃料电池的简易装置,图中a电极为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)下列反应属于放热反应的是_______ 。
A.铝片与稀H2SO4反应制取H2 B.碳酸钙高温分解成氧化钙和二氧化碳
C.葡萄糖在人体内氧化分解 D. 氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl固体反应
(2)一定条件下,SO2与O2反应5min后,若SO2和SO3物质的量浓度分别为1 mol/L和3 mol/L,则SO2起始物质的量浓度为______ ;用SO3表示这段时间该化学反应速率为_______ 。
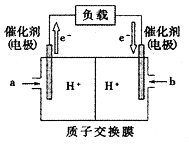
(3)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从____ 处通入(填“a”或b”), 电池内部H+向_____ (填“左”或“右”)移动。写出正极的电极反应式________ 。
(4)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
已知: 1molN2和3molH2反应生成2molNH3时放出热量93kJ,试根据表中所列键能数据计算a的数值_________ 。
(1)下列反应属于放热反应的是
A.铝片与稀H2SO4反应制取H2 B.碳酸钙高温分解成氧化钙和二氧化碳
C.葡萄糖在人体内氧化分解 D. 氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl固体反应
(2)一定条件下,SO2与O2反应5min后,若SO2和SO3物质的量浓度分别为1 mol/L和3 mol/L,则SO2起始物质的量浓度为
(3)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从

(4)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
| 化学键 | H-H | N—H | N≡N |
| 键能kJ/mol | 436 | a | 945 |
已知: 1molN2和3molH2反应生成2molNH3时放出热量93kJ,试根据表中所列键能数据计算a的数值
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】氨气是重要的化工原料,工业合成氨的反应为N2(g)+3H2(g) 2NH3(g) ∆H<0。回答下列问题:
2NH3(g) ∆H<0。回答下列问题:
(1)根据键能数据计算上述合成氨反应的∆H=____ kJ•mol-1(列出计算式即可);升高温度对N2、H2的平衡转化率的影响是____ (填“增大”“减小”或“不变")。
(2)合成氨实际生产中,常用主要成分为铁的催化剂,反应温度773K、压强20~50MPa,投料比n(N2):n(H2)=1:2.8。研究发现:在反应历程中,N2在催化剂表面分解生成N原子的活化能最高;平衡时氨的体积分数在20MPa、50MPa时分别为19.1%、42.2%(其它条件不变)。
①生产中测得合成塔出口混合气体中氨的体积分数为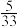 ,说明塔内反应的v正反应
,说明塔内反应的v正反应____ v逆反应(填“大于”“小于”或“等于”);转化率之比α(N2):α(H2)=1.00:____ ;投料中N2适度过量的目的是____ ,提高氢气的转化率。
②选择反应温度为773K的最主要依据是下列中的____ (填标号)。
A.温度对平衡的影响 B.温度对反应速率的影响
C.温度对催化剂活性的影响 D.能耗对生产成本的影响
(3)若投料比n(N2):n(H2)=1:3,反应在恒温773K、恒压40MPa下进行,NH3的平衡产率为ω,则反应的平衡常数Kp=____ (以分压代替平衡浓度表示,分压=总压×物质的量分数);由于反应在高压条件下进行,实际上K,值不仅与温度有关,还与压力和气体组成有关。一定条件下,上述合成氨反应接近平衡时,遵循如下方程:r(NH3)=k正·p(N2)[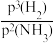 ]1-a-k逆
]1-a-k逆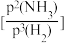 1-a。其中r(NH3)为氨合成反应的净速率,a为常数,与催化剂性质及反应条件有关,若该条件下,实验测得a=0.5,则反应达到平衡时,k正、k逆、Kp三者的关系式为
1-a。其中r(NH3)为氨合成反应的净速率,a为常数,与催化剂性质及反应条件有关,若该条件下,实验测得a=0.5,则反应达到平衡时,k正、k逆、Kp三者的关系式为____ 。
 2NH3(g) ∆H<0。回答下列问题:
2NH3(g) ∆H<0。回答下列问题:| 化学键 | N≡N | H—H | H—N |
| 键能/kJ·mol-1 | 945.6 | 436 | 391 |
(1)根据键能数据计算上述合成氨反应的∆H=
(2)合成氨实际生产中,常用主要成分为铁的催化剂,反应温度773K、压强20~50MPa,投料比n(N2):n(H2)=1:2.8。研究发现:在反应历程中,N2在催化剂表面分解生成N原子的活化能最高;平衡时氨的体积分数在20MPa、50MPa时分别为19.1%、42.2%(其它条件不变)。
①生产中测得合成塔出口混合气体中氨的体积分数为
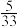 ,说明塔内反应的v正反应
,说明塔内反应的v正反应②选择反应温度为773K的最主要依据是下列中的
A.温度对平衡的影响 B.温度对反应速率的影响
C.温度对催化剂活性的影响 D.能耗对生产成本的影响
(3)若投料比n(N2):n(H2)=1:3,反应在恒温773K、恒压40MPa下进行,NH3的平衡产率为ω,则反应的平衡常数Kp=
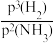 ]1-a-k逆
]1-a-k逆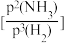 1-a。其中r(NH3)为氨合成反应的净速率,a为常数,与催化剂性质及反应条件有关,若该条件下,实验测得a=0.5,则反应达到平衡时,k正、k逆、Kp三者的关系式为
1-a。其中r(NH3)为氨合成反应的净速率,a为常数,与催化剂性质及反应条件有关,若该条件下,实验测得a=0.5,则反应达到平衡时,k正、k逆、Kp三者的关系式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】治理汽车尾气 是环境保护的重要课题。
是环境保护的重要课题。
(1)汽车尾气中的NO是空气中的 在高温下燃烧生成的,其反应机理如下。
在高温下燃烧生成的,其反应机理如下。
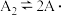


已知:298K时相关化学键的键能数据如下。
①上述机理中, 代表的是
代表的是________ (填“ ”或“
”或“ ”),判断的理由是
”),判断的理由是__________________ 。
②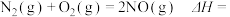
________  。
。
(2)应用SCR脱硝技术除去汽车尾气中的氮氧化物,其反应原理如下。
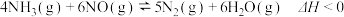
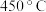 时,将含NO a%(体积分数)的汽车尾气以
时,将含NO a%(体积分数)的汽车尾气以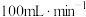 的流速通过盛有氨的反应器,出口气体中NO的含量变为b%(忽略体积变化),则
的流速通过盛有氨的反应器,出口气体中NO的含量变为b%(忽略体积变化),则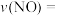
________  。
。
(3)在 催化脱除过程中,更多应用尿素—SCR技术。该技术中生成
催化脱除过程中,更多应用尿素—SCR技术。该技术中生成 的反应如下。
的反应如下。
Ⅰ.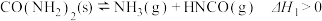
Ⅱ.
①一定温度下,向刚性容器中投入足量 和一定量的
和一定量的 ,当上述反应达到平衡时,测得
,当上述反应达到平衡时,测得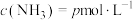 、
、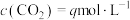 。则
。则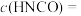
________  (用含p、q的代数式表示,下同),反应Ⅰ的平衡常数为
(用含p、q的代数式表示,下同),反应Ⅰ的平衡常数为____________ 。
②体系中 随温度、氧气浓度的变化如下图所示。
随温度、氧气浓度的变化如下图所示。

温度高于 时,在无氧体系中,
时,在无氧体系中, 浓度减小的原因是
浓度减小的原因是____________ ;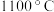 以上,在有氧体系中
以上,在有氧体系中 浓度接近
浓度接近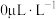 ,理由是
,理由是____________________ 。
 是环境保护的重要课题。
是环境保护的重要课题。(1)汽车尾气中的NO是空气中的
 在高温下燃烧生成的,其反应机理如下。
在高温下燃烧生成的,其反应机理如下。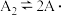


已知:298K时相关化学键的键能数据如下。
化学键 |
|
|
|
键能/( |
|
|
|
①上述机理中,
 代表的是
代表的是 ”或“
”或“ ”),判断的理由是
”),判断的理由是②
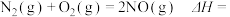
 。
。(2)应用SCR脱硝技术除去汽车尾气中的氮氧化物,其反应原理如下。
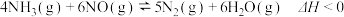
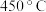 时,将含NO a%(体积分数)的汽车尾气以
时,将含NO a%(体积分数)的汽车尾气以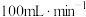 的流速通过盛有氨的反应器,出口气体中NO的含量变为b%(忽略体积变化),则
的流速通过盛有氨的反应器,出口气体中NO的含量变为b%(忽略体积变化),则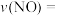
 。
。(3)在
 催化脱除过程中,更多应用尿素—SCR技术。该技术中生成
催化脱除过程中,更多应用尿素—SCR技术。该技术中生成 的反应如下。
的反应如下。Ⅰ.
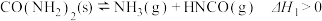
Ⅱ.

①一定温度下,向刚性容器中投入足量
 和一定量的
和一定量的 ,当上述反应达到平衡时,测得
,当上述反应达到平衡时,测得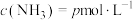 、
、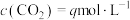 。则
。则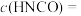
 (用含p、q的代数式表示,下同),反应Ⅰ的平衡常数为
(用含p、q的代数式表示,下同),反应Ⅰ的平衡常数为②体系中
 随温度、氧气浓度的变化如下图所示。
随温度、氧气浓度的变化如下图所示。
温度高于
 时,在无氧体系中,
时,在无氧体系中, 浓度减小的原因是
浓度减小的原因是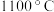 以上,在有氧体系中
以上,在有氧体系中 浓度接近
浓度接近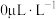 ,理由是
,理由是
您最近一年使用:0次
【推荐3】乙烯是一种重要的基本化工原料,乙烯的产量可以衡量一个国家的石油化工发展水平,研究工业制取乙烯有重要的意义。
I.工业用H2和CO2在一定条件下合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g) ΔH1
CH2=CH2(g)+4H2O(g) ΔH1
已知:①2H2(g)+O2(g)=2H2O(1) ΔH2=-571.4kJ·mol-1
②CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(1) ΔH3=-1411kJ·mol-1
③H2O(g)=H2O(1) ΔH4=-44kJ·mol-1
(1)ΔH1=_______
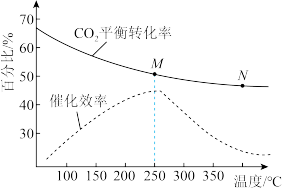
(2)在密闭容器中充入体积比为3:1的H2和CO2,不同温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是_______。
II.工业用甲烷催化法制取乙烯:2CH4(g)=C2H4(g)+2H2(g) ΔH>0,T℃时,向4L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:

(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T℃时k正与k逆的比值为_______ (用含x的代数式表示);若将温度升高,速率常数增大的倍数:k正_______ (填“>”“=”或“<”)k逆。
III.乙烷裂解制乙烯:C2H6(g) C2H4(g)+H2(g)。
C2H4(g)+H2(g)。
(4)T℃时,将乙烷与氦气体积比2:1混合后,通入一密闭容器中发生反应。平衡时容器压强为P0Pa,若乙烷的平衡转化率为50%,反应的平衡常数Kp=_____ (用分压表示,分压=总压×物质的量分数)。
IV.电化学法还原二氧化碳制乙烯原理如下图所示。

(5)阴极电极反应式为:_______ ,电路中转移0.6mol电子,两极共收集气体_______ L(标准状况)。
I.工业用H2和CO2在一定条件下合成乙烯:6H2(g)+2CO2(g)
 CH2=CH2(g)+4H2O(g) ΔH1
CH2=CH2(g)+4H2O(g) ΔH1已知:①2H2(g)+O2(g)=2H2O(1) ΔH2=-571.4kJ·mol-1
②CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(1) ΔH3=-1411kJ·mol-1
③H2O(g)=H2O(1) ΔH4=-44kJ·mol-1
(1)ΔH1=
(2)在密闭容器中充入体积比为3:1的H2和CO2,不同温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是_______。

| A.为了提高乙烯的产率应尽可能选择低温 |
| B.生成乙烯的速率:v(M)可能小于v(N) |
| C.平衡常数:KM<KN |
| D.M点时的压强一定小于N点时的压强 |
II.工业用甲烷催化法制取乙烯:2CH4(g)=C2H4(g)+2H2(g) ΔH>0,T℃时,向4L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:

(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T℃时k正与k逆的比值为
III.乙烷裂解制乙烯:C2H6(g)
 C2H4(g)+H2(g)。
C2H4(g)+H2(g)。(4)T℃时,将乙烷与氦气体积比2:1混合后,通入一密闭容器中发生反应。平衡时容器压强为P0Pa,若乙烷的平衡转化率为50%,反应的平衡常数Kp=
IV.电化学法还原二氧化碳制乙烯原理如下图所示。

(5)阴极电极反应式为:
您最近一年使用:0次
【推荐1】一定温度(t℃)下,向1 L密闭容器中通入H2和 I2各0.15 mol,发生如下反应:H2(g) + I2(g)  2HI(g)。一段时间后达到平衡,测得数据如下:
2HI(g)。一段时间后达到平衡,测得数据如下:
请回答:
(1)2 min内,v(H2) =_______ mol/(L·min)。
(2)下列能证明该反应已经达到平衡的是_______(填字母)。
(3)该反应的化学平衡常数表达式为_______ 。
(4)H2的平衡转化率是_______ 。
(5)该温度(t℃)下,若开始通入一定量的H2和 I2,反应达到平衡时,测得c(H2)=0.4mol/L,c(I2)=0.9mol/L,则平衡时c(HI)=_______ mol/L。
 2HI(g)。一段时间后达到平衡,测得数据如下:
2HI(g)。一段时间后达到平衡,测得数据如下:| t/min | 2 | 4 | 7 | 9 |
| n(I2)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
请回答:
(1)2 min内,v(H2) =
(2)下列能证明该反应已经达到平衡的是_______(填字母)。
| A.v正(H2)= v逆 (HI) |
| B.混合气体的颜色不再发生变化 |
| C.混合气体中各组分的物质的量不再发生变化 |
| D.混合气体的密度不再变化 |
(4)H2的平衡转化率是
(5)该温度(t℃)下,若开始通入一定量的H2和 I2,反应达到平衡时,测得c(H2)=0.4mol/L,c(I2)=0.9mol/L,则平衡时c(HI)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】绿色发展是必由之路,我国宣布二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。
I.以 制备甲醇是实现“双碳”目标的重要途径。在体积为2.5L的密闭容器中,充入
制备甲醇是实现“双碳”目标的重要途径。在体积为2.5L的密闭容器中,充入 和
和 ,180℃下反应仅得甲醇(沸点64.7℃)和物质X,测得各物质物质的量随时间的部分变化图象如图所示:
,180℃下反应仅得甲醇(沸点64.7℃)和物质X,测得各物质物质的量随时间的部分变化图象如图所示:

(1) 的电子式为
的电子式为___________ ;该反应的化学反应方程式为___________ 。
(2)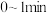 内,甲醇的平均反应速率为
内,甲醇的平均反应速率为___________  (保留两位有效数字)。
(保留两位有效数字)。
(3)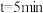 时,正反应速率
时,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
(4)其他条件不变,将该恒容容器,改为体积可变的容器,达到平衡时,测得 的转化率为15%,则平衡时甲醇的浓度为
的转化率为15%,则平衡时甲醇的浓度为___________  。
。
(5)甲醇燃料电池具有启动快、效率高等优点。若以 溶液为电解液,其负极的电极反应式为
溶液为电解液,其负极的电极反应式为___________ 。
II.甲烷与 重整制备合成气也是
重整制备合成气也是 综合利用的研究热点之一、
综合利用的研究热点之一、
(6)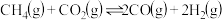 ,此反应的能量变化如图所示:
,此反应的能量变化如图所示:

则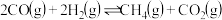 ,属于
,属于___________ 反应(填“吸热”或“放热”)。
(7)恒容条件下,下列描述能证明该反应达到平衡的是___________(填字母)。
I.以
 制备甲醇是实现“双碳”目标的重要途径。在体积为2.5L的密闭容器中,充入
制备甲醇是实现“双碳”目标的重要途径。在体积为2.5L的密闭容器中,充入 和
和 ,180℃下反应仅得甲醇(沸点64.7℃)和物质X,测得各物质物质的量随时间的部分变化图象如图所示:
,180℃下反应仅得甲醇(沸点64.7℃)和物质X,测得各物质物质的量随时间的部分变化图象如图所示:
(1)
 的电子式为
的电子式为(2)
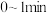 内,甲醇的平均反应速率为
内,甲醇的平均反应速率为 (保留两位有效数字)。
(保留两位有效数字)。(3)
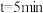 时,正反应速率
时,正反应速率(4)其他条件不变,将该恒容容器,改为体积可变的容器,达到平衡时,测得
 的转化率为15%,则平衡时甲醇的浓度为
的转化率为15%,则平衡时甲醇的浓度为 。
。(5)甲醇燃料电池具有启动快、效率高等优点。若以
 溶液为电解液,其负极的电极反应式为
溶液为电解液,其负极的电极反应式为II.甲烷与
 重整制备合成气也是
重整制备合成气也是 综合利用的研究热点之一、
综合利用的研究热点之一、(6)
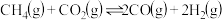 ,此反应的能量变化如图所示:
,此反应的能量变化如图所示:
则
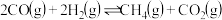 ,属于
,属于(7)恒容条件下,下列描述能证明该反应达到平衡的是___________(填字母)。
| A.容器中气体密度不再改变 |
B.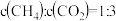 不再改变 不再改变 |
C.断裂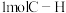 同时断裂 同时断裂 |
D. 的体积分数不再改变 的体积分数不再改变 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】I. 的资源化利用是实现碳中和的重要途径。电化学法将
的资源化利用是实现碳中和的重要途径。电化学法将 转化为甲酸科学家近年发明了一种新型
转化为甲酸科学家近年发明了一种新型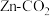 水介质电池。如图所示,电极分别为金属锌和选择性催化材料,放电时,
水介质电池。如图所示,电极分别为金属锌和选择性催化材料,放电时, 被转化为储氢物质甲酸。
被转化为储氢物质甲酸。 和
和 的来源。
的来源。
(1)放电时,正极电极反应式为_______ 。
(2)充电时每生成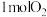 ,理论上阴极获
,理论上阴极获 的物质的量为
的物质的量为_______ 。
(3)与 极室相连的为
极室相连的为_______ 离子交换膜 (填“阴”或“阳”)。
Ⅱ.甲醇气相脱水制甲醚的反应可表示为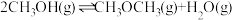 ,
,
请回答下列问题:
(4)一定温度下,在恒容密闭容器中充入一定量的 发生上述反应,能判断反应达到化学平衡状态的是_______。
发生上述反应,能判断反应达到化学平衡状态的是_______。
(5)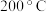 时,向恒容密闭容器中充入一定量的
时,向恒容密闭容器中充入一定量的 发生上述反应,测得
发生上述反应,测得 的浓度随时间(t)的变化如下表:
的浓度随时间(t)的变化如下表:
①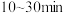 内,用
内,用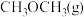 表示该反应的平均速率为
表示该反应的平均速率为_______ 。
② 的平衡转化率为
的平衡转化率为_______ 。
③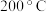 时,向该容器中投入三种成分的浓度如下:
时,向该容器中投入三种成分的浓度如下:
该时刻,正、逆反应速率的大小关系为
_____  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(6)已知:甲醚在一定条件下可分解为 和
和 ,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如图所示试解释
,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如图所示试解释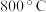 之后甲醇脱水制甲醚产率降低的原因为
之后甲醇脱水制甲醚产率降低的原因为_______ 。
 的资源化利用是实现碳中和的重要途径。电化学法将
的资源化利用是实现碳中和的重要途径。电化学法将 转化为甲酸科学家近年发明了一种新型
转化为甲酸科学家近年发明了一种新型 水介质电池。如图所示,电极分别为金属锌和选择性催化材料,放电时,
水介质电池。如图所示,电极分别为金属锌和选择性催化材料,放电时, 被转化为储氢物质甲酸。
被转化为储氢物质甲酸。
 和
和 的来源。
的来源。(1)放电时,正极电极反应式为
(2)充电时每生成
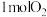 ,理论上阴极获
,理论上阴极获 的物质的量为
的物质的量为(3)与
 极室相连的为
极室相连的为Ⅱ.甲醇气相脱水制甲醚的反应可表示为
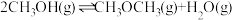 ,
,请回答下列问题:
(4)一定温度下,在恒容密闭容器中充入一定量的
 发生上述反应,能判断反应达到化学平衡状态的是_______。
发生上述反应,能判断反应达到化学平衡状态的是_______。A.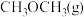 和 和 的浓度比保持不变 的浓度比保持不变 |
B.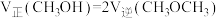 |
| C.容器内压强不再变化 |
| D.混合气体的平均相对分子质量不再变化 |
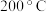 时,向恒容密闭容器中充入一定量的
时,向恒容密闭容器中充入一定量的 发生上述反应,测得
发生上述反应,测得 的浓度随时间(t)的变化如下表:
的浓度随时间(t)的变化如下表: | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
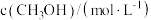 | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
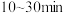 内,用
内,用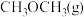 表示该反应的平均速率为
表示该反应的平均速率为②
 的平衡转化率为
的平衡转化率为③
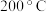 时,向该容器中投入三种成分的浓度如下:
时,向该容器中投入三种成分的浓度如下:| 物质 |  | 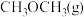 |  |
 | 0.54 | 0.68 | 0.68 |

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(6)已知:甲醚在一定条件下可分解为
 和
和 ,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如图所示试解释
,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如图所示试解释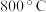 之后甲醇脱水制甲醚产率降低的原因为
之后甲醇脱水制甲醚产率降低的原因为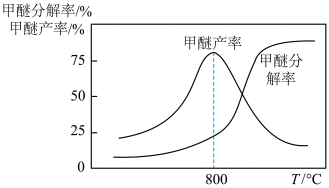
您最近一年使用:0次