在双碳目标驱动下,大批量氢燃料客车在2022年北京冬奥会上投入使用。氢源的获取和利用成为科学研究热点。回答下列问题:
Ⅰ.氢源的获取:电解液氨制氢
氨分子中具有较高的含氢量,因此是制氢的优选原料。现以液氨为原料,使用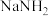 非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有
非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有 、
、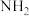 和
和 )
)
(1)产生 的电极反应式为
的电极反应式为______ 。
Ⅱ.氢源的利用: 还原
还原 制甲醇
制甲醇
(2)800℃时, 还原
还原 反应的热化学方程式及其平衡常数如下:
反应的热化学方程式及其平衡常数如下:
反应1:
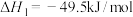

反应2: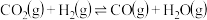

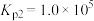
反应3: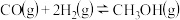
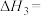
______ 
(3)800℃时,正反应进行的程度“反应2”______ “反应1”(选填“>”或“<”),判断依据是______ 。
(4)反应1在一定条件下建立平衡,关于反应1的相关描述正确的是______。
(5)某温度下,向2L恒容密闭容器中充入0.5mol 和0.9mol
和0.9mol 发生反应1和反应2,经过5min达到平衡状态,反应过程中
发生反应1和反应2,经过5min达到平衡状态,反应过程中 和
和 的物质的量随时间变化情况如下图所示:
的物质的量随时间变化情况如下图所示:
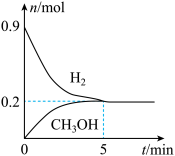
平衡时, 的转化率为
的转化率为______ ,该温度下,反应2的化学平衡常数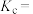
______ 。
(6) 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:______ 。
Ⅰ.氢源的获取:电解液氨制氢
氨分子中具有较高的含氢量,因此是制氢的优选原料。现以液氨为原料,使用
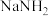 非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有
非水电解质电解制氢。(已知:电解过程中电解液内含氮微粒只有 、
、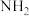 和
和 )
)(1)产生
 的电极反应式为
的电极反应式为Ⅱ.氢源的利用:
 还原
还原 制甲醇
制甲醇(2)800℃时,
 还原
还原 反应的热化学方程式及其平衡常数如下:
反应的热化学方程式及其平衡常数如下:反应1:

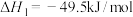

反应2:
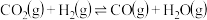

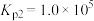
反应3:
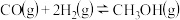
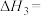

(3)800℃时,正反应进行的程度“反应2”
(4)反应1在一定条件下建立平衡,关于反应1的相关描述正确的是______。
| A.使用高效催化剂可降低反应的活化能,增大活化分子百分数,加快化学反应速率 |
| B.该反应的反应物总能量小于生成物总能量 |
| C.容器内气体的平均相对分子质量不再改变说明反应达到了平衡 |
D.增大压强,反应1的化学平衡常数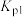 变小 变小 |
 和0.9mol
和0.9mol 发生反应1和反应2,经过5min达到平衡状态,反应过程中
发生反应1和反应2,经过5min达到平衡状态,反应过程中 和
和 的物质的量随时间变化情况如下图所示:
的物质的量随时间变化情况如下图所示:
平衡时,
 的转化率为
的转化率为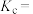
(6)
 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:
更新时间:2022-09-29 16:59:16
|
相似题推荐
【推荐1】甲烷的直接转化具有较高的经济价值,因此备受科学家关注。回答下列问题:
(1)用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
方法I: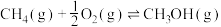
 kJ⋅mol
kJ⋅mol
方法Ⅱ:

已知: 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol ;
;
 kJ⋅mol
kJ⋅mol 。
。
则
___________ 。
(2)某工厂采用(1)中方法I生产甲醇。在恒温恒压的密闭容器内充入1 mol 、0.5 mol
、0.5 mol  和0.5 mol He,测得压强为p MPa,加入合适催化剂后开始反应,测得容器的体积变化如下。
和0.5 mol He,测得压强为p MPa,加入合适催化剂后开始反应,测得容器的体积变化如下。
①下列能说明该反应达到平衡状态的是___________ (填标号)。
A.单位时间内生成1 mol 的同时生成1 mol
的同时生成1 mol 
B.平衡常数不再变化
C.容器内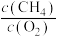 保持不变
保持不变
D.混合气体的平均摩尔质量不再变化
② 的平衡转化率为
的平衡转化率为___________ ,该温度下的平衡常数 为
为___________ 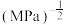 (
( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)北京化工大学某课题组提出了利用光解水产氢过程中形成的活性氧物种活化甲烷直接制甲醇[(1)中方法Ⅱ]的策略。下列说法正确的是___________(填标号)。
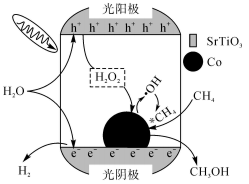
(4)某大学采用甲烷电催化氧化法制备甲醇,研究发现在NaCl的碱性电解液中更容易生成 ,甲烷在
,甲烷在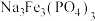 催化剂上可能的反应机理如下:
催化剂上可能的反应机理如下:
i:
ii: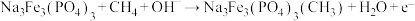
iii:…
iv:
机理iii为___________ 。阴极的电极反应式为___________ 。
(1)用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
方法I:
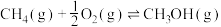
 kJ⋅mol
kJ⋅mol
方法Ⅱ:


已知:
 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol ;
;
 kJ⋅mol
kJ⋅mol 。
。则

(2)某工厂采用(1)中方法I生产甲醇。在恒温恒压的密闭容器内充入1 mol
 、0.5 mol
、0.5 mol  和0.5 mol He,测得压强为p MPa,加入合适催化剂后开始反应,测得容器的体积变化如下。
和0.5 mol He,测得压强为p MPa,加入合适催化剂后开始反应,测得容器的体积变化如下。| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 容器体积/L | 4 | 3.7 | 3.55 | 3.45 | 3.4 | 3.4 |
A.单位时间内生成1 mol
 的同时生成1 mol
的同时生成1 mol 
B.平衡常数不再变化
C.容器内
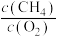 保持不变
保持不变D.混合气体的平均摩尔质量不再变化
②
 的平衡转化率为
的平衡转化率为 为
为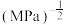 (
( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。(3)北京化工大学某课题组提出了利用光解水产氢过程中形成的活性氧物种活化甲烷直接制甲醇[(1)中方法Ⅱ]的策略。下列说法正确的是___________(填标号)。

A.水在光阳极上发生氧化反应生成 |
B. 生成·OH自由基是化学反应 生成·OH自由基是化学反应 |
| C.反应过程中C、H、O元素化合价均发生改变 |
D.在25℃、容积为V L的容器中,适当增大 分压,有助于提高 分压,有助于提高 的生成速率 的生成速率 |
 ,甲烷在
,甲烷在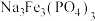 催化剂上可能的反应机理如下:
催化剂上可能的反应机理如下:i:

ii:
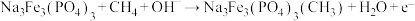
iii:…
iv:

机理iii为
您最近一年使用:0次
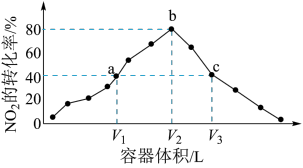
【推荐2】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为________________ 。
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后 ,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应热△H3_____ 0(填“>”、“<”或“=”),该反应的平衡常数表达式为_______________ 。
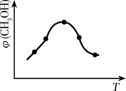
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示,试回答:
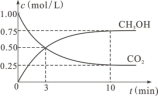
0~10 min内,氢气的平均反应速率为___________________ mol/(L·min)。第10 min后,若向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数____________ (填“增大”、“减小”或“不变”,下同),反应的平衡常数_____________________ 。
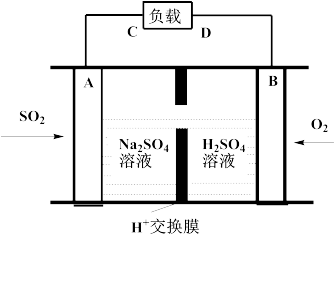
(3)脱硫。
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料。A、B是惰性电极,A极的电极反应式为:_________ 。
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。常温下,将NH4NO3 溶解于水中,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,可以采取的正确措施为_________ 。
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
(1)脱硝。
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示,试回答:

0~10 min内,氢气的平均反应速率为
(3)脱硫。
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料。A、B是惰性电极,A极的电极反应式为:

②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。常温下,将NH4NO3 溶解于水中,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,可以采取的正确措施为
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】氯乙烯是制备塑料的重要中间体,可通过乙炔选择性催化制备。已知:
I.C2H2(g)+HCl(g) C2H3Cl(g) △H1
C2H3Cl(g) △H1
II.C2H2(g)+2HCl(g) C2H4Cl2(g) △H2<0
C2H4Cl2(g) △H2<0
III.C2H2(g) 2C(s)+H2(g) △H3>0
2C(s)+H2(g) △H3>0
回答下列问题:
(1)计算机模拟单个乙炔分子和氯化氢分子在催化剂(HgCl2)表面发生反应I的反应历程如图所示:

①上述单个乙炔分子和氯化氢分子的反应历程中决速步骤的活化能为___________ eV。
②由上述反应历程可推算反应I的反应热△H1,则△H1=___________ eV•mol-1.
(2)在体积可变的密闭容器中以物质的量之比为1:1充入C2H2(g)和HCl(g),分别在不同压强下发生反应,实验测得乙炔的平衡转化率与温度的关系如图所示。Pa、Pb、Pc由大到小的顺序为___________ 。随温度升高,三条曲线逐渐趋于重合的原因为___________ 。

(3)一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为1:1充入C2H2(g)和HCl(g),假设只发生反应I和II。实验测得反应前容器内压强为p0Pa,10min达到平衡时C2H3Cl(g)、HCl(g)的分压分别为p1Pa、p2Pa。
①0~10min内,反应I和反应IIHCl的总的消耗速率v(HCl)=___________ Pa•min-1(用分压表示)。
②反应I的平衡常数Kp=___________ 。(用含P0、P1、P2的代数式表示)
(4)电化学腐蚀法可有效将废水中的三氯乙烯转化为乙烯。利用活性纳米Fe电化学腐蚀处理酸性三氯乙烯废水的过程如图。定义单位时间内纳米Fe释放的总电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。

①上述电化学腐蚀过程①的电极反应为___________ 。
②在处理过程中,当消耗amol纳米Fe时,产生bL的乙烯气体(标准状况),则该电化学腐蚀过程的电流效率η=___________ (用含a、b的代数式表示)。[已知:η=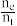 ×100%]
×100%]
I.C2H2(g)+HCl(g)
 C2H3Cl(g) △H1
C2H3Cl(g) △H1II.C2H2(g)+2HCl(g)
 C2H4Cl2(g) △H2<0
C2H4Cl2(g) △H2<0III.C2H2(g)
 2C(s)+H2(g) △H3>0
2C(s)+H2(g) △H3>0回答下列问题:
(1)计算机模拟单个乙炔分子和氯化氢分子在催化剂(HgCl2)表面发生反应I的反应历程如图所示:

①上述单个乙炔分子和氯化氢分子的反应历程中决速步骤的活化能为
②由上述反应历程可推算反应I的反应热△H1,则△H1=
(2)在体积可变的密闭容器中以物质的量之比为1:1充入C2H2(g)和HCl(g),分别在不同压强下发生反应,实验测得乙炔的平衡转化率与温度的关系如图所示。Pa、Pb、Pc由大到小的顺序为

(3)一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为1:1充入C2H2(g)和HCl(g),假设只发生反应I和II。实验测得反应前容器内压强为p0Pa,10min达到平衡时C2H3Cl(g)、HCl(g)的分压分别为p1Pa、p2Pa。
①0~10min内,反应I和反应IIHCl的总的消耗速率v(HCl)=
②反应I的平衡常数Kp=
(4)电化学腐蚀法可有效将废水中的三氯乙烯转化为乙烯。利用活性纳米Fe电化学腐蚀处理酸性三氯乙烯废水的过程如图。定义单位时间内纳米Fe释放的总电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。

①上述电化学腐蚀过程①的电极反应为
②在处理过程中,当消耗amol纳米Fe时,产生bL的乙烯气体(标准状况),则该电化学腐蚀过程的电流效率η=
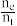 ×100%]
×100%]
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】乙酸是重要的有机化工原料之一,目前世界上一半以上的乙酸都都采用甲醇与CO反应来制备.某实验小组在一个恒压密闭容器中加入0.20molCH3OH和0.22molCO气体,发生反应CH3OH(g)+CO(g) CH3COOH(I),测得甲醇的转化率随温度的变化关系如图所示,其中曲线Ⅰ表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.
CH3COOH(I),测得甲醇的转化率随温度的变化关系如图所示,其中曲线Ⅰ表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.
已知:2CO(g)+O2(g)═2CO2(g) △H=﹣566kJ·mol-1
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(I) △H=﹣1529kJ·mol-1
CH3COOH(I)+2O2(g)═2CO2(g)+2H2O(I) △H=﹣874kJ·mol-1
按要求回答下列问题:
(1)求工业制乙酸反应:CH3OH(g)+CO(g) CH3COOH(I) △H=
CH3COOH(I) △H= ______ kJ·mol-1
(2)在温度为T2时,从反应开始至5min时,用单位时间内物质的量变化表示的乙酸的平均反应速率为_________ mol·min-1.
(3)在温度为T2时,该反应的平衡常数K=_________ ;在T3温度下,C点时,ν(正) ____ ν(逆)(填“>”、“<”或“=” )。
(4)在温度为T2时,往上述已达到平衡的恒压容器中,再在瞬间通入0.12molCH3OH和0.06molCO混合气体,平衡的移动方向为__________ (填“向左”或“向右”或“不移动” )
(5)在温度为T1时,乙酸的物质的量随时间变化的趋势曲线如下图所示.当时间到达t1时,将该反应体系温度迅速上升到T3,并维持该温度。请在图中画出t1时刻后乙酸物质的量的变化总趋势曲线.
__________
 CH3COOH(I),测得甲醇的转化率随温度的变化关系如图所示,其中曲线Ⅰ表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.
CH3COOH(I),测得甲醇的转化率随温度的变化关系如图所示,其中曲线Ⅰ表示在5个不同温度下,均经过5min时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在T2温度下,达到平衡时容器的体积刚好为2L.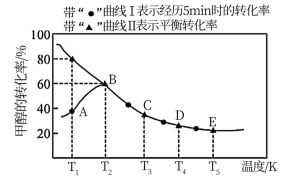
已知:2CO(g)+O2(g)═2CO2(g) △H=﹣566kJ·mol-1
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(I) △H=﹣1529kJ·mol-1
CH3COOH(I)+2O2(g)═2CO2(g)+2H2O(I) △H=﹣874kJ·mol-1
按要求回答下列问题:
(1)求工业制乙酸反应:CH3OH(g)+CO(g)
 CH3COOH(I) △H=
CH3COOH(I) △H= (2)在温度为T2时,从反应开始至5min时,用单位时间内物质的量变化表示的乙酸的平均反应速率为
(3)在温度为T2时,该反应的平衡常数K=
(4)在温度为T2时,往上述已达到平衡的恒压容器中,再在瞬间通入0.12molCH3OH和0.06molCO混合气体,平衡的移动方向为
(5)在温度为T1时,乙酸的物质的量随时间变化的趋势曲线如下图所示.当时间到达t1时,将该反应体系温度迅速上升到T3,并维持该温度。请在图中画出t1时刻后乙酸物质的量的变化总趋势曲线.
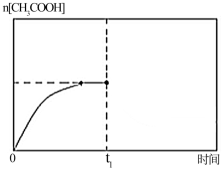
您最近一年使用:0次
【推荐2】甲醇是一种用途非常广泛的基础化工原料,可通过下列反应合成:
Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3
回答下列问题
(1)反应(Ⅰ)的△S________ (填“>”或“<”)0,△H1=________ (用△H2、△H3表示)。
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
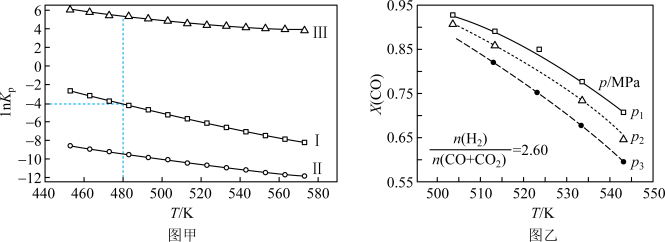
①反应(Ⅱ)的△H________ (填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=________ 。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=________ (KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)若用CO和CO2混合气体合成甲醇,起始时均控制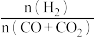 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____ (填字母)。
A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大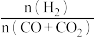 ,X(CO)增大
,X(CO)增大
Ⅰ.CO(g)+2H2(g)
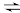 CH3OH(g)△H1
CH3OH(g)△H1Ⅱ.CO2(g)+3H2(g)
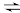 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2Ⅲ.CO(g)+H2O(g)
 CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3回答下列问题
(1)反应(Ⅰ)的△S
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示

①反应(Ⅱ)的△H
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=
(3)若用CO和CO2混合气体合成甲醇,起始时均控制
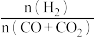 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大
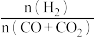 ,X(CO)增大
,X(CO)增大
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】完成下列问题。
(1)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2∶1的 和
和 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡: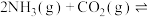
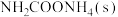
 ,反应过程中氨气质量与时间关系如图所示:
,反应过程中氨气质量与时间关系如图所示:
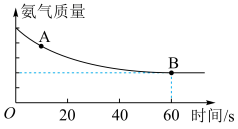
A点正反应速率
___________ B点逆反应速率 (填“>”、“<”或“=”),上述反应达平衡状态后降低体系温度,新平衡体系中
(填“>”、“<”或“=”),上述反应达平衡状态后降低体系温度,新平衡体系中 的体积分数与原平衡相比
的体积分数与原平衡相比___________ (填“下降”、“不变”或“升高”)
(2)温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol ,发生反应:
,发生反应: ,反应相同时间,测得各容器中
,反应相同时间,测得各容器中 的转化率与容器体积的关系如下图所示。
的转化率与容器体积的关系如下图所示。
下列说法正确的是___________ 。
A.容器内的压强: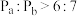
B.图中c点所示条件下,
C.向a点平衡体系中充入一定量的 ,达到平衡时,
,达到平衡时, 的转化率比原平衡大
的转化率比原平衡大
(3)电解法制取 ,同时可获得氢气:
,同时可获得氢气: ,工作原理如图1所示。已知:若NaOH溶液浓度过高,铁电极区会产生红褐色物质:
,工作原理如图1所示。已知:若NaOH溶液浓度过高,铁电极区会产生红褐色物质: 只在强碱性条件下稳定。
只在强碱性条件下稳定。
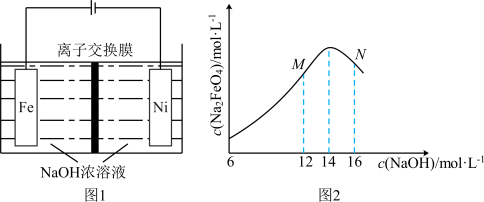
①电解时,Fe电极发生的电极反应式为___________ 。
②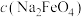 随初始
随初始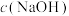 的变化如图2,则分别分析M、N点
的变化如图2,则分别分析M、N点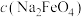 均低于最高值的可能的原因:M点
均低于最高值的可能的原因:M点___________ ;N点___________ 。
(4)甲醚( )是重要的化工原料,制取原理如下:
)是重要的化工原料,制取原理如下:
主反应①: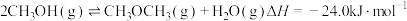 。
。
副反应②: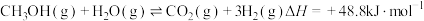 。
。
选择合适的催化剂。在不同温度和5MPa压强下,测得甲醚的选择性如下图所示。 的选择性=(2×
的选择性=(2× 的物质的量/反应的
的物质的量/反应的 的物质的量)×100%
的物质的量)×100%
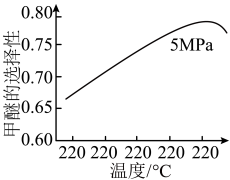
图中,温度高于265℃后甲醚选择性降低,从平衡的角度分析,其可能的原因是___________ 。
(1)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2∶1的
 和
和 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡: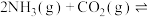
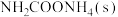
 ,反应过程中氨气质量与时间关系如图所示:
,反应过程中氨气质量与时间关系如图所示:
A点正反应速率
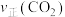
 (填“>”、“<”或“=”),上述反应达平衡状态后降低体系温度,新平衡体系中
(填“>”、“<”或“=”),上述反应达平衡状态后降低体系温度,新平衡体系中 的体积分数与原平衡相比
的体积分数与原平衡相比(2)温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol
 ,发生反应:
,发生反应: ,反应相同时间,测得各容器中
,反应相同时间,测得各容器中 的转化率与容器体积的关系如下图所示。
的转化率与容器体积的关系如下图所示。
下列说法正确的是
A.容器内的压强:
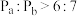
B.图中c点所示条件下,

C.向a点平衡体系中充入一定量的
 ,达到平衡时,
,达到平衡时, 的转化率比原平衡大
的转化率比原平衡大(3)电解法制取
 ,同时可获得氢气:
,同时可获得氢气: ,工作原理如图1所示。已知:若NaOH溶液浓度过高,铁电极区会产生红褐色物质:
,工作原理如图1所示。已知:若NaOH溶液浓度过高,铁电极区会产生红褐色物质: 只在强碱性条件下稳定。
只在强碱性条件下稳定。
①电解时,Fe电极发生的电极反应式为
②
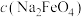 随初始
随初始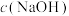 的变化如图2,则分别分析M、N点
的变化如图2,则分别分析M、N点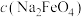 均低于最高值的可能的原因:M点
均低于最高值的可能的原因:M点(4)甲醚(
 )是重要的化工原料,制取原理如下:
)是重要的化工原料,制取原理如下:主反应①:
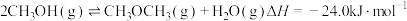 。
。副反应②:
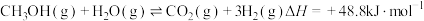 。
。选择合适的催化剂。在不同温度和5MPa压强下,测得甲醚的选择性如下图所示。
 的选择性=(2×
的选择性=(2× 的物质的量/反应的
的物质的量/反应的 的物质的量)×100%
的物质的量)×100%
图中,温度高于265℃后甲醚选择性降低,从平衡的角度分析,其可能的原因是
您最近一年使用:0次
【推荐1】大量的碳排放会直接推高全球地表的平均温度,如果不加以控制,将对生态环境和人类社会造成巨大的影响。为充分利用碳资源,减少碳排放,在一定条件下,可利用二氧化碳合成低碳烯烃。如二氧化碳与氢气反应合成乙烯,其反应式为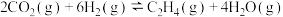
 。
。
(1)该反应能自发进行的条件是___________ (填“高温”“低温”或“任意温度”);理由是___________ 。
(2)一定条件下,在恒容密闭容器中该反应温度、投料比[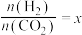 ]对
]对 平衡转化率的影响如下图所示。
平衡转化率的影响如下图所示。

①a___________ 3(填“>”“<”或“=”);M、N两点反应的平衡常数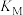
___________ 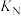 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②300℃,往3L反应容器中加入 ,
, ,反应10min达到平衡。求0到10min氢气的平均反应速率
,反应10min达到平衡。求0到10min氢气的平均反应速率___________ 。
③若该反应有一副反应 ,当温度为300℃,
,当温度为300℃, 时,
时, 的平衡转化率为60%,生成乙烯的选择性为
的平衡转化率为60%,生成乙烯的选择性为 (选择性:生成C2H4消耗的
(选择性:生成C2H4消耗的 与共转化的
与共转化的 之比),则该副反应的平衡常数
之比),则该副反应的平衡常数
___________ 。
(3)中国科学院福建物质结构研究所电催化还原 制乙烯,原理如图所示。
制乙烯,原理如图所示。

①已知PTFE浸泡了饱和KCl溶液,请写出阴极的电极反应式___________ 。
②若外电路通过的电子为16.5mol,电流效率( )为80%,则生成标准状况下的
)为80%,则生成标准状况下的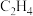 的体积为
的体积为___________ L( )。
)。
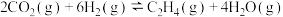
 。
。(1)该反应能自发进行的条件是
(2)一定条件下,在恒容密闭容器中该反应温度、投料比[
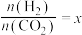 ]对
]对 平衡转化率的影响如下图所示。
平衡转化率的影响如下图所示。
①a
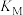
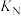 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②300℃,往3L反应容器中加入
 ,
, ,反应10min达到平衡。求0到10min氢气的平均反应速率
,反应10min达到平衡。求0到10min氢气的平均反应速率③若该反应有一副反应
 ,当温度为300℃,
,当温度为300℃, 时,
时, 的平衡转化率为60%,生成乙烯的选择性为
的平衡转化率为60%,生成乙烯的选择性为 (选择性:生成C2H4消耗的
(选择性:生成C2H4消耗的 与共转化的
与共转化的 之比),则该副反应的平衡常数
之比),则该副反应的平衡常数
(3)中国科学院福建物质结构研究所电催化还原
 制乙烯,原理如图所示。
制乙烯,原理如图所示。
①已知PTFE浸泡了饱和KCl溶液,请写出阴极的电极反应式
②若外电路通过的电子为16.5mol,电流效率(
 )为80%,则生成标准状况下的
)为80%,则生成标准状况下的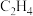 的体积为
的体积为 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】我国高含硫天然气资源丰富,天然气脱硫和甲烷与硫化氢重整制氢具有重要的现实意义。回答下列问题:
(1)天然气脱硫工艺涉及如下反应:
H2S(g)+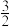 O2(g)=SO2(g)+H2O(g) ΔH=akJ·mol-1
O2(g)=SO2(g)+H2O(g) ΔH=akJ·mol-1
2H2S(g)+SO2(g)=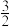 S2(g)+2H2O(g) ΔH=bkJ·mol-1
S2(g)+2H2O(g) ΔH=bkJ·mol-1
H2S(g)+ O2(g)=S(g)+H2O(g) ΔH=ckJ·mol-1
O2(g)=S(g)+H2O(g) ΔH=ckJ·mol-1
则2S(g)=S2(g) ΔH=___________ kJ·mol-l。
(2)甲烷与H2S重整制氢是一条全新的H2S转化与制氢技术路线。为了研究甲烷对H2S制氢的影响,理论计算表明,原料初始组成n(CH4):n(H2S)=1:2,在体系压强为0.1 MPa,反应CH4(g)+2H2S(g)→CS2(g)+4H2(g)达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示:___________ 、___________ 。反应达平衡的标志是___________ (填标号)。
A.2v正(H2S)=4v逆(H2) B.CH4的体积分数不再变化
C. 不再变化 D.混合气体的密度不再改变
不再变化 D.混合气体的密度不再改变
②由图可知该反应的ΔH___________ 0(填“>”“<”或“=”),判断的理由是___________ 。
③M点对应温度下,CH4的转化率为___________ ;950℃时该反应的Kp=___________ (MPa)2。
(3)H2S燃料电池的原理如图所示。电池的正极是___________ ,负极的电极反应式为___________ 。
(1)天然气脱硫工艺涉及如下反应:
H2S(g)+
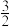 O2(g)=SO2(g)+H2O(g) ΔH=akJ·mol-1
O2(g)=SO2(g)+H2O(g) ΔH=akJ·mol-12H2S(g)+SO2(g)=
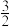 S2(g)+2H2O(g) ΔH=bkJ·mol-1
S2(g)+2H2O(g) ΔH=bkJ·mol-1H2S(g)+
 O2(g)=S(g)+H2O(g) ΔH=ckJ·mol-1
O2(g)=S(g)+H2O(g) ΔH=ckJ·mol-1则2S(g)=S2(g) ΔH=
(2)甲烷与H2S重整制氢是一条全新的H2S转化与制氢技术路线。为了研究甲烷对H2S制氢的影响,理论计算表明,原料初始组成n(CH4):n(H2S)=1:2,在体系压强为0.1 MPa,反应CH4(g)+2H2S(g)→CS2(g)+4H2(g)达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示:

A.2v正(H2S)=4v逆(H2) B.CH4的体积分数不再变化
C.
 不再变化 D.混合气体的密度不再改变
不再变化 D.混合气体的密度不再改变②由图可知该反应的ΔH
③M点对应温度下,CH4的转化率为
(3)H2S燃料电池的原理如图所示。电池的正极是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】工业废气中的二氧化碳加氢制甲醇是“碳中和”的一个重要研究方向,在催化剂作用下,主要发生以下反应:
ⅰ.
 ;
;
ⅱ.
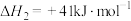 ;
;
ⅲ.
 。
。
(1)已知反应ⅲ正反应的活化能为 ,则其逆反应的活化能为
,则其逆反应的活化能为___________  (用含有
(用含有 的式子表示)。
的式子表示)。
(2)①一定温度下,向恒容密闭容器中通入物质的量之比为1:3的 与
与 ,发生以上3个反应,下列能说明反应达到平衡状态的是
,发生以上3个反应,下列能说明反应达到平衡状态的是___________ 。
A. B.平衡常数不再发生变化
B.平衡常数不再发生变化
C.气体密度不再改变 D.测得 的浓度保持不变
的浓度保持不变
②若起始压强为 ,反应经
,反应经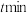 后达到平衡,此时体系压强为
后达到平衡,此时体系压强为 ,
, 的分压:
的分压: ,则
,则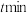 内反应的平均速率
内反应的平均速率
___________ 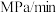 ,
, 的选择性为
的选择性为___________ %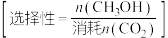 ,反应ⅰ的平衡常数
,反应ⅰ的平衡常数
___________ (保留两位有效数字)。
(3)在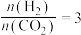 时,反应ⅰ在不同条件下达到平衡,设体系中甲醇物质的量分数为
时,反应ⅰ在不同条件下达到平衡,设体系中甲醇物质的量分数为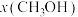 ,在
,在 ℃下的
℃下的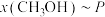 、在
、在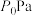 下的
下的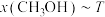 。如图所示。
。如图所示。___________ 。当 的平衡转化率为
的平衡转化率为 时,反应条件可能为
时,反应条件可能为___________ 或___________ 。
(4)为探究原料气中混入 气体对反应的影响。测得平衡时
气体对反应的影响。测得平衡时 的转化率
的转化率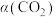 、
、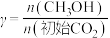 随原料气中
随原料气中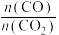 的变化如图所示。请解释
的变化如图所示。请解释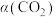 、
、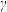 呈现该变化的趋势的原因:
呈现该变化的趋势的原因:___________ 。
ⅰ.

 ;
;ⅱ.

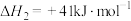 ;
;ⅲ.

 。
。(1)已知反应ⅲ正反应的活化能为
 ,则其逆反应的活化能为
,则其逆反应的活化能为 (用含有
(用含有 的式子表示)。
的式子表示)。(2)①一定温度下,向恒容密闭容器中通入物质的量之比为1:3的
 与
与 ,发生以上3个反应,下列能说明反应达到平衡状态的是
,发生以上3个反应,下列能说明反应达到平衡状态的是A.
 B.平衡常数不再发生变化
B.平衡常数不再发生变化C.气体密度不再改变 D.测得
 的浓度保持不变
的浓度保持不变②若起始压强为
 ,反应经
,反应经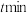 后达到平衡,此时体系压强为
后达到平衡,此时体系压强为 ,
, 的分压:
的分压: ,则
,则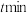 内反应的平均速率
内反应的平均速率
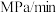 ,
, 的选择性为
的选择性为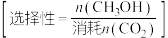 ,反应ⅰ的平衡常数
,反应ⅰ的平衡常数
(3)在
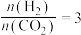 时,反应ⅰ在不同条件下达到平衡,设体系中甲醇物质的量分数为
时,反应ⅰ在不同条件下达到平衡,设体系中甲醇物质的量分数为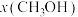 ,在
,在 ℃下的
℃下的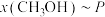 、在
、在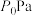 下的
下的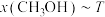 。如图所示。
。如图所示。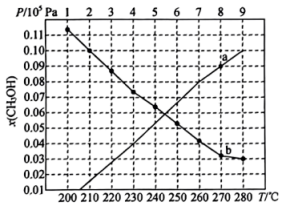
 的平衡转化率为
的平衡转化率为 时,反应条件可能为
时,反应条件可能为(4)为探究原料气中混入
 气体对反应的影响。测得平衡时
气体对反应的影响。测得平衡时 的转化率
的转化率 、
、 随原料气中
随原料气中 的变化如图所示。请解释
的变化如图所示。请解释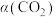 、
、 呈现该变化的趋势的原因:
呈现该变化的趋势的原因:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】目前世界各国都规划了碳达峰、碳中和的时间节点,以CO2为碳源,将其转化为能源物质。选择性加氢合成CH3OH,合成过程中发生下列反应:
反应i:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1=-akJ‧mol-1
反应ii:CO(g)+2H2(g)⇌CH3OH(g) ∆H2
反应iii:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H3=-bkJ‧mol-1
回答下列问题:
(1)根据盖斯定律,∆H2=。___________ kJ‧mol-1(用含a,b的代数式表示)。
(2)在一绝热、刚性容器中,只发生反应iii。下列说法表明反应已达到平衡状态的是___________(填序号)。
(3)中科院兰州化物所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,反应过程如图所示。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。

在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表所示:
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加Na助剂是否效果最好?_________ (填“是”或“否”),请叙述原因:___________ 。
(4)合成二甲醚反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H=-74kJ‧mol-1。该反应正反应的活化能___________ (填“>”“<”或“=”) 逆反应的活化能。
(5)在一定条件下,将1molCO和2molH2充入IL恒容密闭容器中:发生反应:CO(g)+2H2(g)⇌CH3OH(g) ∆H2,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
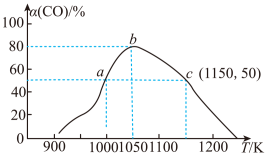
①温度为1000K时,反应开始至2min时,v(H2)=___________ mol‧L-1‧min-1
②CO的转化率随温度的升高先增大后变小的原因是___________ 。
(6)为实现CO2资源化利用,通过光电转化原理以CO2为原料制备甲酸产品(如图所示)。
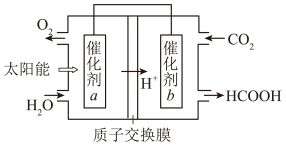
①光电转化过程中,阴极反应式为___________
②催化剂b附近生成lmolHCOOH时,标准状况下催化剂a附近理论上产生______ L气体。
反应i:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1=-akJ‧mol-1
反应ii:CO(g)+2H2(g)⇌CH3OH(g) ∆H2
反应iii:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H3=-bkJ‧mol-1
回答下列问题:
(1)根据盖斯定律,∆H2=。
(2)在一绝热、刚性容器中,只发生反应iii。下列说法表明反应已达到平衡状态的是___________(填序号)。
| A.混合气体的总物质的量不再变化 | B.n(CH3OH):n(H2O)=1:1 |
| C.v正(CH3OH)=3v逆(H2) | D.该反应的K不再变化 |

在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表所示:
| 助剂 | CO2转化率(%) | 各产物在所有产物中的占比 | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
(4)合成二甲醚反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H=-74kJ‧mol-1。该反应正反应的活化能
(5)在一定条件下,将1molCO和2molH2充入IL恒容密闭容器中:发生反应:CO(g)+2H2(g)⇌CH3OH(g) ∆H2,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:

①温度为1000K时,反应开始至2min时,v(H2)=
②CO的转化率随温度的升高先增大后变小的原因是
(6)为实现CO2资源化利用,通过光电转化原理以CO2为原料制备甲酸产品(如图所示)。

①光电转化过程中,阴极反应式为
②催化剂b附近生成lmolHCOOH时,标准状况下催化剂a附近理论上产生
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】以钛铁矿(主要成分为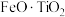 ,还含有
,还含有 、
、 、
、 等杂质)为原料合成锂离子电池的电极材料钛酸锂(
等杂质)为原料合成锂离子电池的电极材料钛酸锂(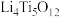 )和磷酸亚铁锂(
)和磷酸亚铁锂( )的工艺流程如下:
)的工艺流程如下:

回答下列问题:
(1)“溶浸”后溶液中的金属阳离子主要包括 、
、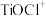
_______ 。“滤液”经加热水解后转化为富钛渣(钛元素主要以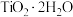 形式存在),写出上述制备
形式存在),写出上述制备 的离子方程式:
的离子方程式:_______ 。在制备时加入大量的水,同时加热的目的是_______
(2)“溶钛”过程反应温度不能太高,其原因是_______ 。
(3)“沉铁”步骤反应的化学方程式为_______ ,“沉铁”后的滤液经处理后可返回_______ 工序循环利用。
(4)“煅烧”制备 过程中,
过程中, 和
和 的理论投入量的物质的量之比为
的理论投入量的物质的量之比为_______ 。
(5)以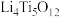 和
和 作电极组成电池,充电时发生反应:
作电极组成电池,充电时发生反应: (
(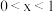 ),阳极的电极反应式为
),阳极的电极反应式为_______ 。
(6)从废旧 电极中可回收锂元素。用硝酸充分溶浸废旧
电极中可回收锂元素。用硝酸充分溶浸废旧 电极,测得浸取液中
电极,测得浸取液中 ,加入等体积的碳酸钠溶液将
,加入等体积的碳酸钠溶液将 转化为
转化为 沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中
沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中 的浓度为
的浓度为_______  [已知
[已知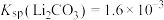 ,假设反应后溶液体积为反应前两溶液之和]。
,假设反应后溶液体积为反应前两溶液之和]。
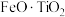 ,还含有
,还含有 、
、 、
、 等杂质)为原料合成锂离子电池的电极材料钛酸锂(
等杂质)为原料合成锂离子电池的电极材料钛酸锂(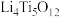 )和磷酸亚铁锂(
)和磷酸亚铁锂( )的工艺流程如下:
)的工艺流程如下:
回答下列问题:
(1)“溶浸”后溶液中的金属阳离子主要包括
 、
、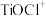
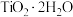 形式存在),写出上述制备
形式存在),写出上述制备 的离子方程式:
的离子方程式:(2)“溶钛”过程反应温度不能太高,其原因是
(3)“沉铁”步骤反应的化学方程式为
(4)“煅烧”制备
 过程中,
过程中, 和
和 的理论投入量的物质的量之比为
的理论投入量的物质的量之比为(5)以
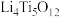 和
和 作电极组成电池,充电时发生反应:
作电极组成电池,充电时发生反应: (
(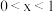 ),阳极的电极反应式为
),阳极的电极反应式为(6)从废旧
 电极中可回收锂元素。用硝酸充分溶浸废旧
电极中可回收锂元素。用硝酸充分溶浸废旧 电极,测得浸取液中
电极,测得浸取液中 ,加入等体积的碳酸钠溶液将
,加入等体积的碳酸钠溶液将 转化为
转化为 沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中
沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中 的浓度为
的浓度为 [已知
[已知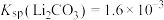 ,假设反应后溶液体积为反应前两溶液之和]。
,假设反应后溶液体积为反应前两溶液之和]。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】水是“生命之基质”,是“永远值得探究的物质”。
(1)关于反应H2(g)+ O2(g)=H2O(l),下列说法不正确的是
O2(g)=H2O(l),下列说法不正确的是______
A. 焓变ΔH<0,熵变ΔS<0
B. 可以把反应设计成原电池,实现能量的转化
C. 一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行
D. 选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2)根据H2O的成键特点,画出与图中H2O分子直接相连的所有氢键(O—H…O)______ 。

(3)水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1MPa)时的水称为超临界水。
①与常温常压的水相比。高温高压液态水的离子积会显著增大。解释其原因______ 。
②如果水的离子积Kw从10×10-14增大到1.0×10-10,则相应的电离度是原来的______ 倍。
③超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计算的物质的量分数,t为反应时间。

下列说法合理的是______
A. 乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B. 在550℃条件下,反应时间大于15s时,乙醇氧化为二氧化碳已趋于完全
C. 乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,而且两者数值相等
D. 随温度升高,xCO峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
(4)以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2;其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是______ 。
②制备H2O2的总反应方程式是______ 。
(1)关于反应H2(g)+
 O2(g)=H2O(l),下列说法不正确的是
O2(g)=H2O(l),下列说法不正确的是A. 焓变ΔH<0,熵变ΔS<0
B. 可以把反应设计成原电池,实现能量的转化
C. 一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行
D. 选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2)根据H2O的成键特点,画出与图中H2O分子直接相连的所有氢键(O—H…O)

(3)水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1MPa)时的水称为超临界水。
①与常温常压的水相比。高温高压液态水的离子积会显著增大。解释其原因
②如果水的离子积Kw从10×10-14增大到1.0×10-10,则相应的电离度是原来的
③超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计算的物质的量分数,t为反应时间。

下列说法合理的是
A. 乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B. 在550℃条件下,反应时间大于15s时,乙醇氧化为二氧化碳已趋于完全
C. 乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,而且两者数值相等
D. 随温度升高,xCO峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
(4)以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2;其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是
②制备H2O2的总反应方程式是
您最近一年使用:0次



