煤和石油等化石燃料燃烧产生的 是大气中氮氧化物的主要来源。选择性催化还原脱硝技术是控制尾部烟气中
是大气中氮氧化物的主要来源。选择性催化还原脱硝技术是控制尾部烟气中 排放的最成熟有效的技术之一
排放的最成熟有效的技术之一
Ⅰ.在相同时间内,三种催化剂下NO的转化率、 浓度随温度变化如图1所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图2所示。
浓度随温度变化如图1所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图2所示。
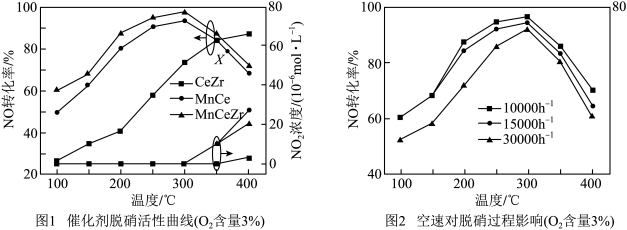
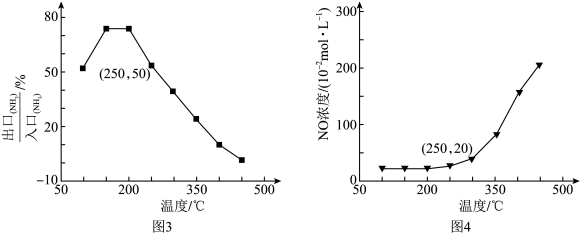
(1)根据图1和图2分析,选取工业脱硝的最佳反应条件为___________ 。350~400℃产生较多 的原因为
的原因为___________ 。
(2)通过改善催化剂的结构特性可以使脱硝效率得到提升。较低温度下,MnCeZr催化剂的脱硝效率远高于CeZr催化剂,说明主要是___________ (填元素符号)的存在改善了催化剂的低温活性。在MnCe催化剂催化下,X点的正反应速率___________ (填“>”“<”或“=”)逆反应速率,说明理由:___________ 。
Ⅱ.氧气的添加可以使较低温度下催化剂的脱硝效率迅速提高,氧气会与未反应的氨气反应。
i.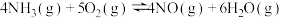

ii.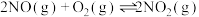
iii.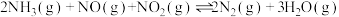
iv.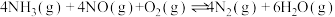
(3) =
=___________ (用 、
、 表示)。
表示)。
(4)已知反应i和反应iv为竞争反应,若只考虑这两个反应,相同时间内 的值随温度变化及出口NO浓度随温度变化分别如图3、图4所示。在容积为2L的恒容密闭容器中,
的值随温度变化及出口NO浓度随温度变化分别如图3、图4所示。在容积为2L的恒容密闭容器中, 、
、 均以4mol投料,250℃时反应已达平衡,则此时反应iv的平衡常数K=
均以4mol投料,250℃时反应已达平衡,则此时反应iv的平衡常数K=___________ (列出计算式)。
 是大气中氮氧化物的主要来源。选择性催化还原脱硝技术是控制尾部烟气中
是大气中氮氧化物的主要来源。选择性催化还原脱硝技术是控制尾部烟气中 排放的最成熟有效的技术之一
排放的最成熟有效的技术之一Ⅰ.在相同时间内,三种催化剂下NO的转化率、
 浓度随温度变化如图1所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图2所示。
浓度随温度变化如图1所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图2所示。
(1)根据图1和图2分析,选取工业脱硝的最佳反应条件为
 的原因为
的原因为(2)通过改善催化剂的结构特性可以使脱硝效率得到提升。较低温度下,MnCeZr催化剂的脱硝效率远高于CeZr催化剂,说明主要是
Ⅱ.氧气的添加可以使较低温度下催化剂的脱硝效率迅速提高,氧气会与未反应的氨气反应。
i.
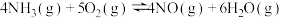

ii.
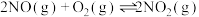
iii.
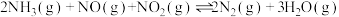
iv.
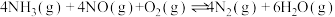
(3)
 =
= 、
、 表示)。
表示)。(4)已知反应i和反应iv为竞争反应,若只考虑这两个反应,相同时间内
 的值随温度变化及出口NO浓度随温度变化分别如图3、图4所示。在容积为2L的恒容密闭容器中,
的值随温度变化及出口NO浓度随温度变化分别如图3、图4所示。在容积为2L的恒容密闭容器中, 、
、 均以4mol投料,250℃时反应已达平衡,则此时反应iv的平衡常数K=
均以4mol投料,250℃时反应已达平衡,则此时反应iv的平衡常数K=
2023·全国·模拟预测 查看更多[4]
更新时间:2023-04-11 13:26:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】低碳烯烃是重要的化工原料,广泛用于生产塑料、溶剂、药物、化妆品等。低碳烯烃主要是指乙烯、丙烯、丁烯。回答下列问题:
Ⅰ.我国科学家研究出新型催化剂 /ZMS—5,能使
/ZMS—5,能使 加氢生成乙烯,反应过程如图所示:
加氢生成乙烯,反应过程如图所示:
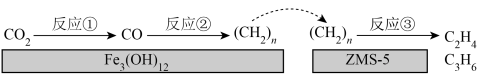
(1) 催化
催化 加氢的反应由反应①和反应②两步完成,反应①的活化能
加氢的反应由反应①和反应②两步完成,反应①的活化能 >反应②的活化能
>反应②的活化能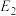 ,则
,则 催化
催化 加氢反应的决速步骤是
加氢反应的决速步骤是___________ (填“反应①”或“反应②”)。反应③为解聚、烯烃异构化反应,烯烃异构化是指改变烯烃结构而相对分子质量不变的反应过程,化工生产中的下列烯烃能发生异构化反应的是___________ (填字母)。
A.乙烯 B.2-甲基丙烯 C.2,3-二甲基-1-丁烯
Ⅱ.丙烯作为化工原料,其用量仅次于乙烯,应用丙烷脱氢制丙烯成为丙烯的重要来源,涉及的主要反应如下:
ⅰ.

ⅱ.

(2)

___________  。
。
(3)按起始投料比 将气体匀速通入到恒压(100kPa)密闭容器中,发生反应ⅰ和反应ⅱ。在相同时间不同温度(T)下,测得反应过程中
将气体匀速通入到恒压(100kPa)密闭容器中,发生反应ⅰ和反应ⅱ。在相同时间不同温度(T)下,测得反应过程中 、
、 的转化率变化曲线如图所示:
的转化率变化曲线如图所示:

M表示___________ (填“ ”或“
”或“ ”)的转化率随温度变化的曲线;C点后,随着温度升高,主要进行的反应是
”)的转化率随温度变化的曲线;C点后,随着温度升高,主要进行的反应是___________ (填“ⅰ”或“ⅱ”),该反应在温度为 K时的压强平衡常数
K时的压强平衡常数
___________ kPa(保留一位小数)。
Ⅲ.中国科学院大连化学物理研究所利用金属氧化物和分子筛的复合催化剂(OXZEO)实现了合成气(CO、)转化为低碳烯烃,反应过程如图所示:
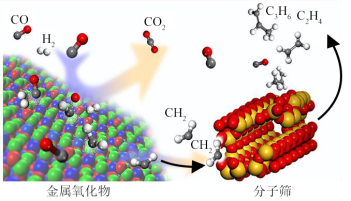
(4)该图显示,CO吸附到金属氧化物表面,碳氧键被“剪断”变成O原子和C原子, 与C原子反应形成烃类中间体,该烃类中间体的电子式为
与C原子反应形成烃类中间体,该烃类中间体的电子式为_____________ 。该中间体通过碳原子的链式增长,生成各种烯烃。该反应机理中,碳原子的链式增长的位置为___________ (填字母)。
A.金属氧化物表面 B.金属氧化物与分子筛之间的气体氛围中
C.分子筛表面 D.分子筛的孔道中
Ⅰ.我国科学家研究出新型催化剂
 /ZMS—5,能使
/ZMS—5,能使 加氢生成乙烯,反应过程如图所示:
加氢生成乙烯,反应过程如图所示:
(1)
 催化
催化 加氢的反应由反应①和反应②两步完成,反应①的活化能
加氢的反应由反应①和反应②两步完成,反应①的活化能 >反应②的活化能
>反应②的活化能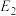 ,则
,则 催化
催化 加氢反应的决速步骤是
加氢反应的决速步骤是A.乙烯 B.2-甲基丙烯 C.2,3-二甲基-1-丁烯
Ⅱ.丙烯作为化工原料,其用量仅次于乙烯,应用丙烷脱氢制丙烯成为丙烯的重要来源,涉及的主要反应如下:
ⅰ.


ⅱ.


(2)


 。
。(3)按起始投料比
 将气体匀速通入到恒压(100kPa)密闭容器中,发生反应ⅰ和反应ⅱ。在相同时间不同温度(T)下,测得反应过程中
将气体匀速通入到恒压(100kPa)密闭容器中,发生反应ⅰ和反应ⅱ。在相同时间不同温度(T)下,测得反应过程中 、
、 的转化率变化曲线如图所示:
的转化率变化曲线如图所示:
M表示
 ”或“
”或“ ”)的转化率随温度变化的曲线;C点后,随着温度升高,主要进行的反应是
”)的转化率随温度变化的曲线;C点后,随着温度升高,主要进行的反应是 K时的压强平衡常数
K时的压强平衡常数
Ⅲ.中国科学院大连化学物理研究所利用金属氧化物和分子筛的复合催化剂(OXZEO)实现了合成气(CO、)转化为低碳烯烃,反应过程如图所示:

(4)该图显示,CO吸附到金属氧化物表面,碳氧键被“剪断”变成O原子和C原子,
 与C原子反应形成烃类中间体,该烃类中间体的电子式为
与C原子反应形成烃类中间体,该烃类中间体的电子式为A.金属氧化物表面 B.金属氧化物与分子筛之间的气体氛围中
C.分子筛表面 D.分子筛的孔道中
您最近一年使用:0次
【推荐2】煤的气化产物(CO、H2)可用于制备合成天然气(SNG),涉及的主要反应如下:
CO甲烷化:CO(g)+3H2(g) CH4(g)+H2O(g)
CH4(g)+H2O(g) H1=-206.2kJ/mol
H1=-206.2kJ/mol
水煤气变换:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) H2=-41.2.kJ/mol
H2=-41.2.kJ/mol
回答下列问题:
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g) H=
H=_____ kJ/mol。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____ (填“A”或“B”)。
(2)在恒压管道反应器中按n(H2) : n(CO)=3:1通入原料气,在催化剂作用下制备合成天然气,400°C、P总为100kPa时反应体系平衡组成如下表所示。

①该条件下CO的总转化率α=______ 。若将管道反应器升温至500°C,反应迅达到平衡后CH4的体积分数φ______ 45.0%(填“>”、“<”或“=”)。
②Kp、Kx分别是以分压、物质的量分数表示的平衡常数,Kp只受温度影响。400°C时,CO甲烷化反应的平衡常数Kp=_____ kPa-2(计算结果保留1位小数);Kx=______ (以K和P总表示)。其他条件不变,增大P总至150kPa,Kx____ (填“增大”、减小”或“不变”)。
(3)制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。积碳反应为:
反应ⅠCH4(g) C(s)+2H2(g)
C(s)+2H2(g) H=+75kJ/mol
H=+75kJ/mol
反应Ⅱ2CO(g) C(s)+CO2(g)
C(s)+CO2(g) H=-172kJ/mol
H=-172kJ/mol
平衡体系中水蒸气浓度对积碳量的影响如下图所示,下列说法正确的是______ (双选)。

A.曲线1在550-700°C积碳量增大的原因可能是反应Ⅰ、Ⅱ的速率增大
B.曲线1在700-800°C积碳量减小的原因可能是反应Ⅱ逆向移动
C.曲线2、3在550-800°C积碳量较低的原因是水蒸气的稀释作用使积碳反应速率减小
D.水蒸气能吸收反应放出的热量,降低体系温度至550°C以下,有利于减少积碳
CO甲烷化:CO(g)+3H2(g)
 CH4(g)+H2O(g)
CH4(g)+H2O(g) H1=-206.2kJ/mol
H1=-206.2kJ/mol水煤气变换:CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g) H2=-41.2.kJ/mol
H2=-41.2.kJ/mol回答下列问题:
(1)反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g) H=
H=(2)在恒压管道反应器中按n(H2) : n(CO)=3:1通入原料气,在催化剂作用下制备合成天然气,400°C、P总为100kPa时反应体系平衡组成如下表所示。

①该条件下CO的总转化率α=
②Kp、Kx分别是以分压、物质的量分数表示的平衡常数,Kp只受温度影响。400°C时,CO甲烷化反应的平衡常数Kp=
(3)制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。积碳反应为:
反应ⅠCH4(g)
 C(s)+2H2(g)
C(s)+2H2(g) H=+75kJ/mol
H=+75kJ/mol反应Ⅱ2CO(g)
 C(s)+CO2(g)
C(s)+CO2(g) H=-172kJ/mol
H=-172kJ/mol平衡体系中水蒸气浓度对积碳量的影响如下图所示,下列说法正确的是

A.曲线1在550-700°C积碳量增大的原因可能是反应Ⅰ、Ⅱ的速率增大
B.曲线1在700-800°C积碳量减小的原因可能是反应Ⅱ逆向移动
C.曲线2、3在550-800°C积碳量较低的原因是水蒸气的稀释作用使积碳反应速率减小
D.水蒸气能吸收反应放出的热量,降低体系温度至550°C以下,有利于减少积碳
您最近一年使用:0次
【推荐3】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途。
(1)真空碳热还原—氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=__________kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:

①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= 。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO
b.通入一定量的N2
c.适当升高反应体系的温度
d.加入合适的催化剂
e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
C.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前3Omin的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)="____" _____mol/L。NO的转化率_________(填“增大”、“减小”或“不变”)。
(3)铝电池性能优越,,Al-Ag2O电池可用作水下动力电源,其原理如图所示
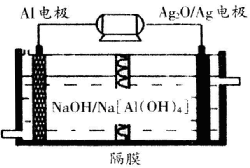
请写出该电池正极反应式___________;常温下,用该化学电源和惰性电极电解300mL硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的pH=___________(不考虑溶液体积的变化)。
(1)真空碳热还原—氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=__________kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= 。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO
b.通入一定量的N2
c.适当升高反应体系的温度
d.加入合适的催化剂
e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
C.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前3Omin的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)="____" _____mol/L。NO的转化率_________(填“增大”、“减小”或“不变”)。
(3)铝电池性能优越,,Al-Ag2O电池可用作水下动力电源,其原理如图所示

请写出该电池正极反应式___________;常温下,用该化学电源和惰性电极电解300mL硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的pH=___________(不考虑溶液体积的变化)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=____________ 。
(2)\在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数表达式为K=
CH3OH(g)+H2O(g),,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数表达式为K=________
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
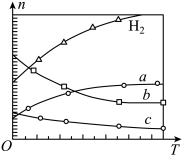
①该反应的ΔH________ 0(填“>”或“<”)。
②曲线c表示的物质为________ 。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施是_________________ 。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=
(2)\在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数表达式为K=
CH3OH(g)+H2O(g),,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数表达式为K=(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
①该反应的ΔH
②曲线c表示的物质为
③为提高H2的平衡转化率,除改变温度外,还可采取的措施是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一。SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)  4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0
(1)氮氧化物破坏臭氧层原理为:①NO+O3 NO2+O2②NO2+O
NO2+O2②NO2+O NO+O2。常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O
NO+O2。常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O 2O2的平衡常数K =
2O2的平衡常数K =_______ (用K1、K2表示)。氮氧化物在该反应中的作用是___________ 。
(2)SCR法除NO时,投料比一定时有利于提高NO平衡转化率的反应条件是________ 、________ 。
(3)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。
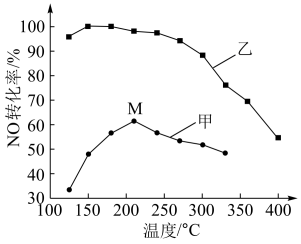
①工业上选择催化剂乙的原因是______________ ;
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率__________ (填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是( ) 。
A.温度高于210oC,反应放热,平衡逆移
B.催化剂活性降低
C.温度高于210oC,发生了副反应
(4)二甲醚(CH3-O-CH3)代替氟利昂作为制冷剂可减少臭氧空洞。若用二甲醚-O2燃料电池作为电源,利用电解法制备纳米Cu2O,其装置如图所示。
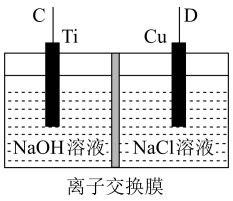
①上述装置中D电极应连接二甲醚燃料电池中通_______ (填“CH3-O-CH3”或“O2”)的一极,该电解池中离子交换膜为_____ 离子交换膜(填“阴”或“阳”)。
②该电解池的阳极反应式为______________ 。
 4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0(1)氮氧化物破坏臭氧层原理为:①NO+O3
 NO2+O2②NO2+O
NO2+O2②NO2+O NO+O2。常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O
NO+O2。常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O 2O2的平衡常数K =
2O2的平衡常数K =(2)SCR法除NO时,投料比一定时有利于提高NO平衡转化率的反应条件是
(3)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。

①工业上选择催化剂乙的原因是
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率
A.温度高于210oC,反应放热,平衡逆移
B.催化剂活性降低
C.温度高于210oC,发生了副反应
(4)二甲醚(CH3-O-CH3)代替氟利昂作为制冷剂可减少臭氧空洞。若用二甲醚-O2燃料电池作为电源,利用电解法制备纳米Cu2O,其装置如图所示。

①上述装置中D电极应连接二甲醚燃料电池中通
②该电解池的阳极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】近年来对CO2的有效控制及其高效利用的研究正引起全球广泛关注。据中国化工报报道,美国科学家发现了一种新的可将CO2转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近90倍。由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H 1=-49.58 kJ•mol-1
CH3OH(g) +H2O(g) △H 1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H 2
CO(g)+H2O(g) △H 2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H 3=-90.77 kJ•mol-1
CH3OH(g) △H 3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H 2=_____ ,反应Ⅲ自发进行条件是_____ (填“较低温”、“较高温”或“任何温度”)。
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如下图所示。

①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是___ ;
A.n(H2)=3mol,n(CO2)=1.5mol; 650K
B.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650K
D.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡:
a.用H2表示该反应的速率为_______ ;
b.该温度下,反应I的平衡常数K=_______ ;
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图中画出3~10min内容器中CH3OH浓度的变化趋势曲线:________________

(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得了不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示,请回答问题:

①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______ (选填编号)。
A.改用高效催化剂
B.升高温度
C.缩小容器体积
D.分离出甲醇
E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而_____ (填“增大”、“减小”、“不变”或“无法判断”),其原因是_________ 。
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g) +H2O(g) △H 1=-49.58 kJ•mol-1
CH3OH(g) +H2O(g) △H 1=-49.58 kJ•mol-1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H 2
CO(g)+H2O(g) △H 2反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g) △H 3=-90.77 kJ•mol-1
CH3OH(g) △H 3=-90.77 kJ•mol-1回答下列问题:
(1)反应Ⅱ的△H 2=
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如下图所示。

①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是
A.n(H2)=3mol,n(CO2)=1.5mol; 650K
B.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650K
D.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡:
a.用H2表示该反应的速率为
b.该温度下,反应I的平衡常数K=
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图中画出3~10min内容器中CH3OH浓度的变化趋势曲线:

(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得了不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示,请回答问题:

①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是
A.改用高效催化剂
B.升高温度
C.缩小容器体积
D.分离出甲醇
E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。当前,科学家成功利用CO2和H2合成了CH3CH2OH、CH3OH,这对节能减排、降低碳排放具有重大意义。回答下列问题:
(1)一定压强下,测得某密闭容器中由CO2和H2制备CH3CH2OH的实验数据中,起始投料比、温度与CO2转化率的关系如图所示。

已知:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ΔH。
CH3CH2OH(g)+3H2O(g) ΔH。
①每生成0.2molCH3CH2OH产生的热量为akJ(a为正值),则ΔH=___________ kJ·mol-1(用含a的代数式表示)。
②在上述条件下,发生该反应适宜的温度为___________ (填“500”、“600”、“700”或“800”)K,判断的理由为___________ 。
③某温度下,向2L恒容密闭容器中充入2molH2和1molCO2,2min末反应达到平衡,此时测得反应前后的总压强之比为5:3,则CO2的平衡转化率为___________ ,0~2min内,v(CH3CH2OH)=___________ mol·L-1·min-1。
(2)对于CO2和H2合成CH3CH2OH的反应,下列说法正确的是___________ (填字母)。
a.混合气体的平均相对分子质量不再发生改变时,该反应达到平衡
b.加入合适的催化剂,正、逆反应速率均增大,同时CH3CH2OH的产率也提高
c.H2的物质的量分数不再发生改变时,该反应达到平衡
d.增大压强,可提高CO2的转化率,同时平衡常数也增大
(3)将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49kJ·mol-1,测得CO2的平衡转化率随温度、压强的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49kJ·mol-1,测得CO2的平衡转化率随温度、压强的变化如图所示。
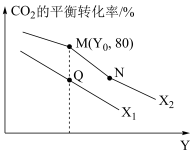
①X1___________ (填“>”、“=”或“<”)X2。
②若M点对应平衡压强为10MPa,则对应的平衡常数KP=___________ (精确到0.01,Kp为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
(1)一定压强下,测得某密闭容器中由CO2和H2制备CH3CH2OH的实验数据中,起始投料比、温度与CO2转化率的关系如图所示。

已知:2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) ΔH。
CH3CH2OH(g)+3H2O(g) ΔH。①每生成0.2molCH3CH2OH产生的热量为akJ(a为正值),则ΔH=
②在上述条件下,发生该反应适宜的温度为
③某温度下,向2L恒容密闭容器中充入2molH2和1molCO2,2min末反应达到平衡,此时测得反应前后的总压强之比为5:3,则CO2的平衡转化率为
(2)对于CO2和H2合成CH3CH2OH的反应,下列说法正确的是
a.混合气体的平均相对分子质量不再发生改变时,该反应达到平衡
b.加入合适的催化剂,正、逆反应速率均增大,同时CH3CH2OH的产率也提高
c.H2的物质的量分数不再发生改变时,该反应达到平衡
d.增大压强,可提高CO2的转化率,同时平衡常数也增大
(3)将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49kJ·mol-1,测得CO2的平衡转化率随温度、压强的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49kJ·mol-1,测得CO2的平衡转化率随温度、压强的变化如图所示。
①X1
②若M点对应平衡压强为10MPa,则对应的平衡常数KP=
您最近一年使用:0次
【推荐2】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)⇌C2H4(g)+2H2(g) ΔH>0
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=____________ (用含a、b、c、d的代数式表示)。
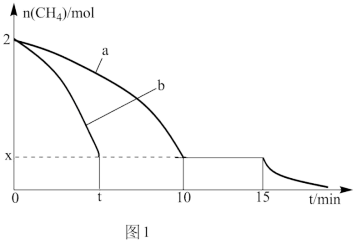
(2)T1温度时,向1 L的恒容反应器中充入2mol CH4,仅发生上述反应,反应过程中 0~15min CH4的物质的量随时间变化如图1,测得10~15min时H2的浓度为1.6mol/L。
①0~10min内CH4表示的反应速率为__________ mol/(L·min)。
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(CH4)变化曲线,其中表示催化剂表面积较大的曲线是________ (填“a”或 “b”)。
③15min时,若改变外界反应条件,导致n(CH4)发生图1中所示变化,则改变的条件可能是_____________________________________ (任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2)其中k正、k逆为速率常数仅与温度有关,T1温度时k正与k逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正____ v逆(填“>”“=”或“<”),判断的理由是_________________ 。
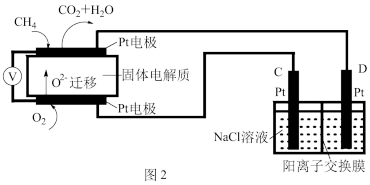
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-。
①C极的Pt为______ 极(填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________ 。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112mL,则阴极区所得溶液在25℃时pH=_______ (假设电解前后NaCl溶液的体积均为500mL)。
| 化学键 | H—H | C—H | C=C | C—C |
| E(kJ/mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=


(2)T1温度时,向1 L的恒容反应器中充入2mol CH4,仅发生上述反应,反应过程中 0~15min CH4的物质的量随时间变化如图1,测得10~15min时H2的浓度为1.6mol/L。
①0~10min内CH4表示的反应速率为
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(CH4)变化曲线,其中表示催化剂表面积较大的曲线是
③15min时,若改变外界反应条件,导致n(CH4)发生图1中所示变化,则改变的条件可能是
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2)其中k正、k逆为速率常数仅与温度有关,T1温度时k正与k逆的比值为
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-。
①C极的Pt为
②该电池工作时负极反应方程式为
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112mL,则阴极区所得溶液在25℃时pH=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氨是一种重要化工产品,研究有关氨反应规律具有重要意义。
已知 、298K时:
、298K时:

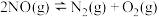

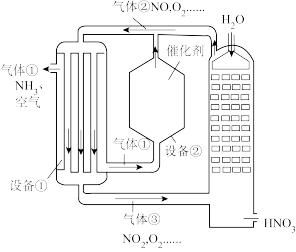
(1)工业以氨为原料制取硝酸的流图如图所示。
①设备②中发生主要反应的热化学方程式:________ 。
②设备②中生成的 难与
难与 大量转化为
大量转化为 的原因是
的原因是________ 。
(2)研究人员以 为催化剂研究将工业废气中的氨转化为
为催化剂研究将工业废气中的氨转化为 的方案.实验将
的方案.实验将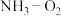 及载气(惰性气体)以一定流速通过催化反应床,研究了不同
及载气(惰性气体)以一定流速通过催化反应床,研究了不同 含量对
含量对 催化氧化的影响,实验结果如图(
催化氧化的影响,实验结果如图( 代表相应氧化物)。
代表相应氧化物)。
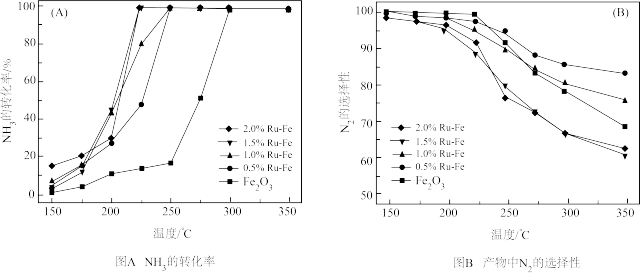
已知: 的选择性
的选择性 (生成
(生成 消耗的
消耗的 的物质的量
的物质的量 消耗
消耗 的总物质的量)
的总物质的量)
①分析上述实验结果,下列说法正确的是________ 。
A. 的加入,降低了催化剂的活化温度
的加入,降低了催化剂的活化温度
B. 含量越大,催化剂的活性越好
含量越大,催化剂的活性越好
C.运用该技术消除废气中 的最佳条件为:
的最佳条件为: 、
、
D.一定温度范围, 的加入使得生成副产物反应活化能降低更为显著
的加入使得生成副产物反应活化能降低更为显著
②某实验条件下,维持反应系统压强为 ,原料气中
,原料气中 、O2、载气的物质的量分别为
、O2、载气的物质的量分别为 、
、 ;测得
;测得 的转化率和
的转化率和 的选择性均为80%,
的选择性均为80%, 氧化的副产物仅为
氧化的副产物仅为 。反应
。反应 用气体分压表示的平衡常数为
用气体分压表示的平衡常数为________ (代入数据,不要求计算结果;组分分压 总压
总压 组分物质的量分数)
组分物质的量分数)
(3)关于 催化氧化为
催化氧化为 的反应机理有诸多研究,其中一种为“
的反应机理有诸多研究,其中一种为“ ”机理:吸附在催化剂表面活性位的
”机理:吸附在催化剂表面活性位的 解离为
解离为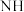 和H,同时活性O参与反应;请用方程式将反应过程补充完整:①
和H,同时活性O参与反应;请用方程式将反应过程补充完整:① ,②
,②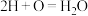 ,③
,③_________ ,④ 。
。
已知
 、298K时:
、298K时:
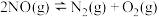


(1)工业以氨为原料制取硝酸的流图如图所示。
①设备②中发生主要反应的热化学方程式:
②设备②中生成的
 难与
难与 大量转化为
大量转化为 的原因是
的原因是(2)研究人员以
 为催化剂研究将工业废气中的氨转化为
为催化剂研究将工业废气中的氨转化为 的方案.实验将
的方案.实验将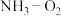 及载气(惰性气体)以一定流速通过催化反应床,研究了不同
及载气(惰性气体)以一定流速通过催化反应床,研究了不同 含量对
含量对 催化氧化的影响,实验结果如图(
催化氧化的影响,实验结果如图( 代表相应氧化物)。
代表相应氧化物)。
已知:
 的选择性
的选择性 (生成
(生成 消耗的
消耗的 的物质的量
的物质的量 消耗
消耗 的总物质的量)
的总物质的量)①分析上述实验结果,下列说法正确的是
A.
 的加入,降低了催化剂的活化温度
的加入,降低了催化剂的活化温度B.
 含量越大,催化剂的活性越好
含量越大,催化剂的活性越好C.运用该技术消除废气中
 的最佳条件为:
的最佳条件为: 、
、
D.一定温度范围,
 的加入使得生成副产物反应活化能降低更为显著
的加入使得生成副产物反应活化能降低更为显著②某实验条件下,维持反应系统压强为
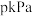 ,原料气中
,原料气中 、O2、载气的物质的量分别为
、O2、载气的物质的量分别为 、
、 ;测得
;测得 的转化率和
的转化率和 的选择性均为80%,
的选择性均为80%, 氧化的副产物仅为
氧化的副产物仅为 。反应
。反应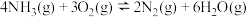 用气体分压表示的平衡常数为
用气体分压表示的平衡常数为 总压
总压 组分物质的量分数)
组分物质的量分数) (3)关于
 催化氧化为
催化氧化为 的反应机理有诸多研究,其中一种为“
的反应机理有诸多研究,其中一种为“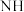 ”机理:吸附在催化剂表面活性位的
”机理:吸附在催化剂表面活性位的 解离为
解离为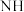 和H,同时活性O参与反应;请用方程式将反应过程补充完整:①
和H,同时活性O参与反应;请用方程式将反应过程补充完整:① ,②
,②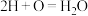 ,③
,③ 。
。
您最近一年使用:0次



