中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)⇌C2H4(g)+2H2(g) ΔH>0
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=____________ (用含a、b、c、d的代数式表示)。
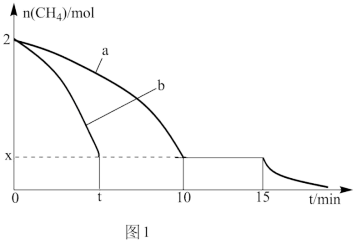
(2)T1温度时,向1 L的恒容反应器中充入2mol CH4,仅发生上述反应,反应过程中 0~15min CH4的物质的量随时间变化如图1,测得10~15min时H2的浓度为1.6mol/L。
①0~10min内CH4表示的反应速率为__________ mol/(L·min)。
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(CH4)变化曲线,其中表示催化剂表面积较大的曲线是________ (填“a”或 “b”)。
③15min时,若改变外界反应条件,导致n(CH4)发生图1中所示变化,则改变的条件可能是_____________________________________ (任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2)其中k正、k逆为速率常数仅与温度有关,T1温度时k正与k逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正____ v逆(填“>”“=”或“<”),判断的理由是_________________ 。
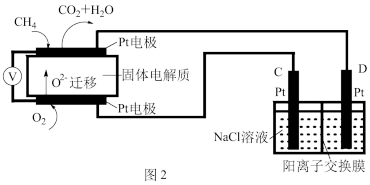
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-。
①C极的Pt为______ 极(填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________ 。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112mL,则阴极区所得溶液在25℃时pH=_______ (假设电解前后NaCl溶液的体积均为500mL)。
| 化学键 | H—H | C—H | C=C | C—C |
| E(kJ/mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=


(2)T1温度时,向1 L的恒容反应器中充入2mol CH4,仅发生上述反应,反应过程中 0~15min CH4的物质的量随时间变化如图1,测得10~15min时H2的浓度为1.6mol/L。
①0~10min内CH4表示的反应速率为
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(CH4)变化曲线,其中表示催化剂表面积较大的曲线是
③15min时,若改变外界反应条件,导致n(CH4)发生图1中所示变化,则改变的条件可能是
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2)其中k正、k逆为速率常数仅与温度有关,T1温度时k正与k逆的比值为
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-。
①C极的Pt为
②该电池工作时负极反应方程式为
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112mL,则阴极区所得溶液在25℃时pH=
2019·陕西宝鸡·三模 查看更多[8]
更新时间:2020-04-02 21:39:56
|
相似题推荐
【推荐1】生物天然气是一种廉价的生物质能,它是由秸秆、杂草等废弃物经微生物发酵后产生的,其主要成分为CH4,甲烷燃烧时的能量变化如图所示。

(1)下列说法正确的是___________ (填序号)。
A.该反应的热化学方程式为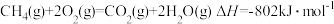
B.甲烷完全燃烧时化学能全部转化为热能
C.为充分利用甲烷,通入的空气越多越好
(2)用CH4催化还原 ,可消除氮氧化物的污染。
,可消除氮氧化物的污染。
已知:①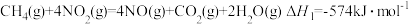
②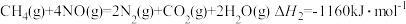
请写出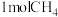 将
将 还原为
还原为 的热化学方程式
的热化学方程式___________ 。
(3)甲烷可用于生产合成水煤气,其反应为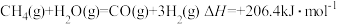 ,已知断裂1mol相关化学键所需的能量如下表:
,已知断裂1mol相关化学键所需的能量如下表:
则a=___________ 。
(4)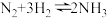 在恒容密闭容器中,下列能作为合成氨反应达到平衡的依据的是
在恒容密闭容器中,下列能作为合成氨反应达到平衡的依据的是___________ 。
a.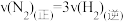 b.混合气体的密度保持不变
b.混合气体的密度保持不变
c.容器内压强保持不变 d. 、
、 、
、 的浓度之比为1∶3∶2
的浓度之比为1∶3∶2

(1)下列说法正确的是
A.该反应的热化学方程式为
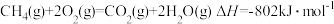
B.甲烷完全燃烧时化学能全部转化为热能
C.为充分利用甲烷,通入的空气越多越好
(2)用CH4催化还原
 ,可消除氮氧化物的污染。
,可消除氮氧化物的污染。已知:①
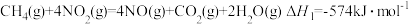
②
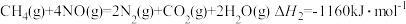
请写出
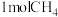 将
将 还原为
还原为 的热化学方程式
的热化学方程式(3)甲烷可用于生产合成水煤气,其反应为
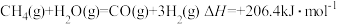 ,已知断裂1mol相关化学键所需的能量如下表:
,已知断裂1mol相关化学键所需的能量如下表:| 化学键 | H-H | O-H | C-H |  |
| 键能/(kJ/mol) | 436 | 465 | a | 1076 |
(4)
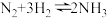 在恒容密闭容器中,下列能作为合成氨反应达到平衡的依据的是
在恒容密闭容器中,下列能作为合成氨反应达到平衡的依据的是a.
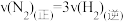 b.混合气体的密度保持不变
b.混合气体的密度保持不变c.容器内压强保持不变 d.
 、
、 、
、 的浓度之比为1∶3∶2
的浓度之比为1∶3∶2
您最近一年使用:0次
【推荐2】当前,实现碳中和已经成为全球的广泛共识,化学科学在此过程中发挥着至关重要的作用。
(1)一种将二氧化碳催化合成甲醇的技术原理为
 。
。
①一定条件下,将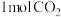 和
和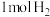 充入某恒温恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
充入某恒温恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_______ 。
A. 的消耗速率与
的消耗速率与 的消耗速率相等
的消耗速率相等
B. 的体积分数保持不变
的体积分数保持不变
C.混合气体的密度保持不变
D.混合气体的平均相对分子质量保持不变
②设平衡体系中甲醇的物质的量分数为 。若控制初始投料比
。若控制初始投料比 ,使反应在不同条件下达到平衡。测得
,使反应在不同条件下达到平衡。测得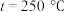 下
下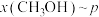 的关系和
的关系和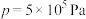 下
下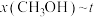 的关系如图1所示,则图中表示
的关系如图1所示,则图中表示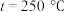 下
下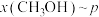 的关系的曲线是
的关系的曲线是_______ (填“a”或“b”)。通过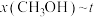 变化趋势说明该反应的
变化趋势说明该反应的
_______ 0(填“=”、“ ”或“
”或“ ”)。当
”)。当 时,
时, 的平衡转化率a为
的平衡转化率a为_______ (保留三位有效数字)%。

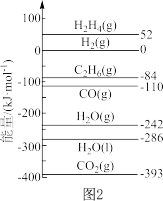
(2) 也可以转化为重要的工业原料乙烯。已知298K时,有关物质的相对能量如图2所示,则
也可以转化为重要的工业原料乙烯。已知298K时,有关物质的相对能量如图2所示,则 与
与 反应生成
反应生成 、CO和液态水的热化学方程式为
、CO和液态水的热化学方程式为___________ 。
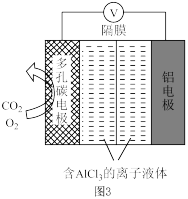
(3) 辅助的
辅助的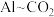 电池电容量大,能有效利用
电池电容量大,能有效利用 ,其工作原理如图3所示。其中,离子液体是优良的溶剂,具有导电性;电池反应产物
,其工作原理如图3所示。其中,离子液体是优良的溶剂,具有导电性;电池反应产物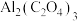 为重要的化工原料。此电池的正极区总反应式为
为重要的化工原料。此电池的正极区总反应式为___________ ,反应过程中 的作用是
的作用是_______ 。
(1)一种将二氧化碳催化合成甲醇的技术原理为

 。
。①一定条件下,将
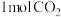 和
和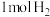 充入某恒温恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
充入某恒温恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是A.
 的消耗速率与
的消耗速率与 的消耗速率相等
的消耗速率相等B.
 的体积分数保持不变
的体积分数保持不变C.混合气体的密度保持不变
D.混合气体的平均相对分子质量保持不变
②设平衡体系中甲醇的物质的量分数为
 。若控制初始投料比
。若控制初始投料比 ,使反应在不同条件下达到平衡。测得
,使反应在不同条件下达到平衡。测得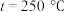 下
下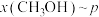 的关系和
的关系和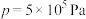 下
下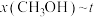 的关系如图1所示,则图中表示
的关系如图1所示,则图中表示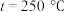 下
下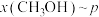 的关系的曲线是
的关系的曲线是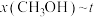 变化趋势说明该反应的
变化趋势说明该反应的
 ”或“
”或“ ”)。当
”)。当 时,
时, 的平衡转化率a为
的平衡转化率a为
(2)
 也可以转化为重要的工业原料乙烯。已知298K时,有关物质的相对能量如图2所示,则
也可以转化为重要的工业原料乙烯。已知298K时,有关物质的相对能量如图2所示,则 与
与 反应生成
反应生成 、CO和液态水的热化学方程式为
、CO和液态水的热化学方程式为
(3)
 辅助的
辅助的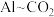 电池电容量大,能有效利用
电池电容量大,能有效利用 ,其工作原理如图3所示。其中,离子液体是优良的溶剂,具有导电性;电池反应产物
,其工作原理如图3所示。其中,离子液体是优良的溶剂,具有导电性;电池反应产物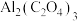 为重要的化工原料。此电池的正极区总反应式为
为重要的化工原料。此电池的正极区总反应式为 的作用是
的作用是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】
(1)顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如右转化:

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
已知:t1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应达平衡时,c(反-1,2-二甲基环丙烷):c(顺-1,2-二甲基环丙烷)=_____________ ;
该反应的活化能Ea(正)小于Ea(逆),则
________ 0(填“小于”“等于”或“大于”)。
(2)催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g)⇌ CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g) ⇌ CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比;
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):反应II的ΔH2=__________ kJ·mol-1。
在右图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的曲线):__________

(1)顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如右转化:

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
已知:t1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应达平衡时,c(反-1,2-二甲基环丙烷):c(顺-1,2-二甲基环丙烷)=
该反应的活化能Ea(正)小于Ea(逆),则

(2)催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g)⇌ CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g) ⇌ CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比;
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):反应II的ΔH2=
在右图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的曲线):

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氮及其化合物与人们的生活、生产密切相关。回答下列问题:
(1)微生物作用下,废水中的 可转化为
可转化为 ,该反应分两步反应:
,该反应分两步反应:
Ⅰ:
Ⅱ: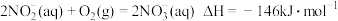
则低浓度氨氮废水中的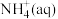 氧化生成
氧化生成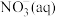 的热化学方程式为
的热化学方程式为________________ 。
(2)在容积固定的密闭容器中,通入一定量的 ,发生反应
,发生反应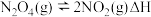 ,随温度升高,混合气体的颜色变深。
,随温度升高,混合气体的颜色变深。
①温度T时反应达平衡,混合气体平衡总压强为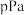 ,
, 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应 的平衡常数
的平衡常数
______________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高, 值将
值将___________ (填“增大”、“减小”或“不变”)。
②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向___________ (填“正反应”或“逆反应”)方向移动,判断理由是__________________________ 。
(1)微生物作用下,废水中的
 可转化为
可转化为 ,该反应分两步反应:
,该反应分两步反应:Ⅰ:

Ⅱ:
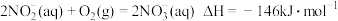
则低浓度氨氮废水中的
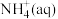 氧化生成
氧化生成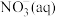 的热化学方程式为
的热化学方程式为(2)在容积固定的密闭容器中,通入一定量的
 ,发生反应
,发生反应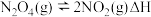 ,随温度升高,混合气体的颜色变深。
,随温度升高,混合气体的颜色变深。①温度T时反应达平衡,混合气体平衡总压强为
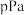 ,
, 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应 的平衡常数
的平衡常数
 值将
值将②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】合成氨是人类科学技术上的一项重大突破,氨有广泛的应用。
已知:N2(g)+3H2(g) 2NH3(g) ∆H1=-a kJ∙mol-1;
2NH3(g) ∆H1=-a kJ∙mol-1;
2H2(g)+O2(g) 2H2O(l) ∆H2=-b kJ∙mol-1
2H2O(l) ∆H2=-b kJ∙mol-1
(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是___________ 。
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下H2的转化率为___________ (可用分数表示),平衡常数K=___________ (可用分数表示)。
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为___________ (填“正向”、“逆向”或“无法判断”)。
③L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
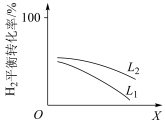
i.X代表的物理量是___________ 。
ii.判断L1、L2的大小关系,并简述理由___________ 。
已知:N2(g)+3H2(g)
 2NH3(g) ∆H1=-a kJ∙mol-1;
2NH3(g) ∆H1=-a kJ∙mol-1;2H2(g)+O2(g)
 2H2O(l) ∆H2=-b kJ∙mol-1
2H2O(l) ∆H2=-b kJ∙mol-1(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
物质 | N2 | H2 | NH3 |
平衡时物质的量/mol | 0.2 | 0.6 | 0.2 |
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为
物质 | N2 | H2 | NH3 |
起始浓度(mol/L) | 0.5 | 1.5 | 0.5 |

i.X代表的物理量是
ii.判断L1、L2的大小关系,并简述理由
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】I.汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。已知4CO(g)+2NO2(g) 4CO2(g)+N2(g)
4CO2(g)+N2(g)  H=-1200kJ/mol。
H=-1200kJ/mol。
(1)该反应在___________ (填“高温、低温或任何温度”)下能自发进行。
(2)对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是___________ (填标号)。
(3)某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料。甲:NO2 0.2mol,CO 0.4mol;乙:NO2 0.1mol,CO 0.2mol。经过一段时间后达到平衡状态。
①N2的平衡体积分数:甲___________ 乙(填“>、=、<或不确定”,下同)。
②NO2的平衡浓度:甲___________ 乙。
③甲中CO的转化率为50%,该反应的平衡常数为___________ 。
II.二氧化碳的开发利用是化学家和化学工作者一直关注的热门话题,试回答:在1.0L恒容密闭容器中投入1.25molCO2和1.75molH2发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示:
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示:___________ 反应,p1、p2、p3从大到小的关系排序为___________ 。
(5)M点对应的平衡常数K=___________ ,在p2及512K时,图中N点v正___________ v逆(填“>”<”或“=”)。
 4CO2(g)+N2(g)
4CO2(g)+N2(g)  H=-1200kJ/mol。
H=-1200kJ/mol。(1)该反应在
(2)对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是___________ (填标号)。
A. | B.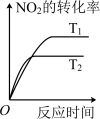 | C.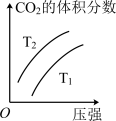 | D.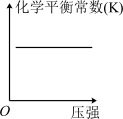 |
(3)某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料。甲:NO2 0.2mol,CO 0.4mol;乙:NO2 0.1mol,CO 0.2mol。经过一段时间后达到平衡状态。
①N2的平衡体积分数:甲
②NO2的平衡浓度:甲
③甲中CO的转化率为50%,该反应的平衡常数为
II.二氧化碳的开发利用是化学家和化学工作者一直关注的热门话题,试回答:在1.0L恒容密闭容器中投入1.25molCO2和1.75molH2发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示:
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示: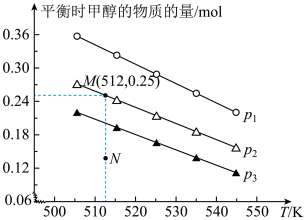
(5)M点对应的平衡常数K=
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
【推荐1】烃A在一定条件下可以按下图进行转化:
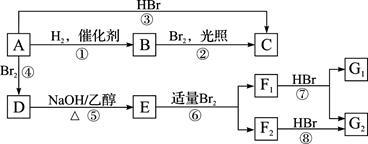
已知D为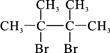 ,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体。据此作答:
,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体。据此作答:
(1)框图中属于取代反应的是_______ (填序号);B完全燃烧后生成的CO2和水的质量比为_________ 。
(2)A的结构简式是_________________ ;G1的结构简式是____________________ 。
(3)写出E在一定条件下生成高聚物的化学方程式:____________________
(4)已知B可在碱性条件下和O2构建成燃料电池,写出负极的电极反应式:___________________

已知D为
 ,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体。据此作答:
,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体。据此作答:(1)框图中属于取代反应的是
(2)A的结构简式是
(3)写出E在一定条件下生成高聚物的化学方程式:
(4)已知B可在碱性条件下和O2构建成燃料电池,写出负极的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】I.已知拆开或形成1 mol化学键所吸收或放出的能量叫做该化学键的键能,单位kJ·mol-1。白磷在氧气中燃烧的化学方程式可用结构式表示为如图所示:
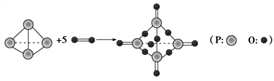
试根据下表中的化学键键能计算0.1molP4(白磷)在氧气中充分燃烧放出能量_____ kJ。
Ⅱ.化学能在一定条件下能够转化为电能,构成原电池。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是_________ (填序号)。
A. 2FeBr2 + 3Cl2 = 2FeCl3+2Br2
B. Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
C. 2H2O = 2H2↑+O2↑
D. Cu+2AgNO3 = 2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。
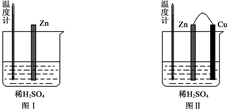
有关实验现象,下列说法正确的是:_____________ (填序号)。
图Ⅰ中气泡产生在锌棒表面,Ⅱ中产生在铜棒表面
图Ⅰ和图Ⅱ的气泡均产生在锌棒表面
两图中生成气体的速率几乎一样快
图Ⅱ中产生气体的速度比Ⅰ快
温度计显示的均为室温
图Ⅱ中温度计的示数高于图Ⅰ的示数
图Ⅰ中温度计的示数高于图Ⅱ的示数
图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
(3)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O。负极反应式为____________________ ,一段时间后,负极增重48克,转移电子_______ mol。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
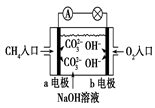
①电池的负极反应式为:____________ 。
②电池工作一段时间后电解质溶液的pH__________ (填“增大”“减小”或“不变”)。

试根据下表中的化学键键能计算0.1molP4(白磷)在氧气中充分燃烧放出能量
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/kJ·mol-1 | 198 | 360 | 498 | 585 |
Ⅱ.化学能在一定条件下能够转化为电能,构成原电池。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是
A. 2FeBr2 + 3Cl2 = 2FeCl3+2Br2
B. Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
C. 2H2O = 2H2↑+O2↑
D. Cu+2AgNO3 = 2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。

有关实验现象,下列说法正确的是:
图Ⅰ中气泡产生在锌棒表面,Ⅱ中产生在铜棒表面
图Ⅰ和图Ⅱ的气泡均产生在锌棒表面
两图中生成气体的速率几乎一样快
图Ⅱ中产生气体的速度比Ⅰ快
温度计显示的均为室温
图Ⅱ中温度计的示数高于图Ⅰ的示数
图Ⅰ中温度计的示数高于图Ⅱ的示数
图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
(3)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O。负极反应式为
(4)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极反应式为:
②电池工作一段时间后电解质溶液的pH
您最近一年使用:0次
【推荐3】(1)2017年5月,我国在南海成功开采“可燃冰”(甲烷水合物),标志着在技术方面取得了突破性进展。甲烷是优质的清洁能源,综合开发利用能有效缓解大气污染问题。
已知:CH4(g)+2O2(g)=CO2(g) +2H2O(g) ΔH =- 802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1
H2O(g)=H2O(l) ΔH =- 44kJ·mol-1
则1mol CH4(g)不完全燃烧生成CO和H2O(l) 的热化学方程式为:___________________________ 。
(2)甲烷转化为CO和H2的反应为:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。
①一定条件下,CH4的平衡转化率与温度、压强的关系如下图1所示。则P1________ P2(填“<”、“>”或“=”) ;A、B、C 三点处对应的平衡常数(KA、KB、KC)由大到小的顺序为___________________ 。
②将CH4和H2O(g)按等物质的量混合,一定条件下反应达到平衡,CH4转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为________________ 。


(3)甲烷燃料电池工作原理如上图2所示。a气体是______________ ,b气体通入电极的反应式为__________ 。用该燃料电池作电源、以石墨作电极电解硫酸铜溶液,一段时间后,若将0.1mol Cu2(OH)2CO3溶解于该溶液,恰好使溶液恢复至起始成分和浓度,则燃料电池中理论上消耗CH4的体积(标准状况)为_________________ 。
(4)25℃时,H2CO3的电离常数分别为:Ka1=4.4×10-7mol·L-1;Ka2=5.0×10-11 mol·L-1。在20mL0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液20mL,所得溶液pH=8。此溶液中各阴离子的物质的量浓度大小关系为__________________ ,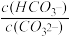 =
=__________________ 。
已知:CH4(g)+2O2(g)=CO2(g) +2H2O(g) ΔH =- 802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1
H2O(g)=H2O(l) ΔH =- 44kJ·mol-1
则1mol CH4(g)不完全燃烧生成CO和H2O(l) 的热化学方程式为:
(2)甲烷转化为CO和H2的反应为:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。①一定条件下,CH4的平衡转化率与温度、压强的关系如下图1所示。则P1
②将CH4和H2O(g)按等物质的量混合,一定条件下反应达到平衡,CH4转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为


(3)甲烷燃料电池工作原理如上图2所示。a气体是
(4)25℃时,H2CO3的电离常数分别为:Ka1=4.4×10-7mol·L-1;Ka2=5.0×10-11 mol·L-1。在20mL0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液20mL,所得溶液pH=8。此溶液中各阴离子的物质的量浓度大小关系为
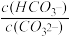 =
=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】图中X是直流电源。Y烧杯中c、d为石墨棒,Z烧杯中e、f是质量相同的铜棒。接通电路后,发现d附近溶液显红色。
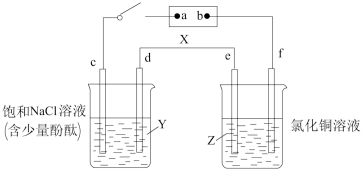
(1)①电源b极为________ (填“正”“负”或“阴”“阳”,下同)极。
②Z烧杯中e为________ 极。
③连接Y、Z烧杯线路中,电子流动的方向是d________ (填“→”或“←”)e。
(2)①写出Y烧杯中c极上的电极反应式:_______________________________
②写出Y烧杯中总反应的化学方程式:________________________________
③写出Z烧杯中e极上的电极反应式:_______________________________
(3)①电解2 min后,取出e、f,洗净、烘干、称量,质量差为1.28 g,在通电过程中,电路中通过的电子为______ mol。
②若Y烧杯中溶液体积为500 mL(电解后体积可视为不变),电解反应的速率v(OH-)=________ 。

(1)①电源b极为
②Z烧杯中e为
③连接Y、Z烧杯线路中,电子流动的方向是d
(2)①写出Y烧杯中c极上的电极反应式:
②写出Y烧杯中总反应的化学方程式:
③写出Z烧杯中e极上的电极反应式:
(3)①电解2 min后,取出e、f,洗净、烘干、称量,质量差为1.28 g,在通电过程中,电路中通过的电子为
②若Y烧杯中溶液体积为500 mL(电解后体积可视为不变),电解反应的速率v(OH-)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状态)气体。回答:

(1)直流电源中,M为____________ 极。
(2)Pt电极上生成的物质是_________ ,其质量为________ g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成物的物质的量之比为2∶___ ∶____ ∶______ 。
(4)AgNO3溶液的浓度(填增大、减小或不变。下同)____ ,H2SO4溶液的pH______ 。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原H2SO4溶液为______ g。

(1)直流电源中,M为
(2)Pt电极上生成的物质是
(3)电源输出的电子,其物质的量与电极b、c、d分别生成物的物质的量之比为2∶
(4)AgNO3溶液的浓度(填增大、减小或不变。下同)
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原H2SO4溶液为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】铅酸蓄电池是常见的化学电源,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸。充放电的总反应是: Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
(1)该蓄电池放电工作时电解质溶液中SO42-移向________ (填“正极”或“负极”,下同)充电时,该极接直流电源的_________ 。
(2)Cu2O是一种半导体材料,可通过右图的电解装置制取,电解总反应为:2Cu+H2O Cu2O+H2↑
Cu2O+H2↑
阴极的电极反应式是__________________________ 。 若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为_______ g。
(3)为防止钢闸门在水中被腐蚀,可将其与铅酸蓄电池的_______ 极相连(填Pb或PbO2)。
(4)用铅蓄电池电解500mL饱和食盐水(足量)。电解一段时间后,共收集到气体1120mL(已折算成标准状况下),则所得溶液的pH=_________ (不考虑气体的溶解及电解前后溶液体积的变化)
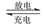 2PbSO4+2H2O
2PbSO4+2H2O
(1)该蓄电池放电工作时电解质溶液中SO42-移向
(2)Cu2O是一种半导体材料,可通过右图的电解装置制取,电解总反应为:2Cu+H2O
 Cu2O+H2↑
Cu2O+H2↑阴极的电极反应式是
(3)为防止钢闸门在水中被腐蚀,可将其与铅酸蓄电池的
(4)用铅蓄电池电解500mL饱和食盐水(足量)。电解一段时间后,共收集到气体1120mL(已折算成标准状况下),则所得溶液的pH=
您最近一年使用:0次



