名校
解题方法
1 . 二甲醚是一种重要的清洁燃料,也可替代氟氯昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________ 。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)=CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g)=CO2(g)+H2(g);△H=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的△H=________________ ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________________ (填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(3)下列可以说明反应③CO(g)+H2O(g) CO2(g)+H2(g)已经达到平衡状态的是
CO2(g)+H2(g)已经达到平衡状态的是________________ (填字母代号)。
A.单位时间内一个H-H键断裂的同时有两个H-O键断裂
B.H2O与CO2的浓度相等
C.温度和体积一定时,容器内的压强保持不变
D.条件一定时,混合气体的平均相对分子质量不再变化
E.温度和体积一定时,CO的浓度保持不变
(4)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
若加入CH3OH后,经过10min反应达到平衡,此时c(CH3OH)=___________ 。
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)=CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g)=CO2(g)+H2(g);△H=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的△H=
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(3)下列可以说明反应③CO(g)+H2O(g)
 CO2(g)+H2(g)已经达到平衡状态的是
CO2(g)+H2(g)已经达到平衡状态的是A.单位时间内一个H-H键断裂的同时有两个H-O键断裂
B.H2O与CO2的浓度相等
C.温度和体积一定时,容器内的压强保持不变
D.条件一定时,混合气体的平均相对分子质量不再变化
E.温度和体积一定时,CO的浓度保持不变
(4)已知反应②2CH3OH(g)
 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
若加入CH3OH后,经过10min反应达到平衡,此时c(CH3OH)=
您最近一年使用:0次
2020-10-17更新
|
172次组卷
|
3卷引用:湖北省黄冈市罗田县第一中学2020-2021学年高二10月月考化学试题
解题方法
2 . 氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。回答下列问题:
(1)氧化还原法消除NOx的转化如下:
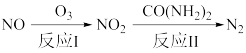
已知:NO(g)+O3(g)=NO2(g)+O2(g)△H=-201kJ·mol-1
2NO(g)+O2(g)=2NO2(g)△H=-116kJ·mol-1
反应I只有一种生成物,则反应I的热化学方程式为_______________ 。
(2)柴油机氮氧化物(NOx)处理技术是一种系统简单,占用空间较小的柴油车尾气处理技术,氮氧化物主要在催化转化装置中被处理。柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,催化转化装置中的物质变化如图所示。
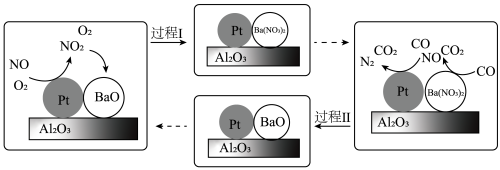
①BaO吸收NO2的化学方程式是______________ 。
②研究CO2对BaO吸收氮氧化物的影响,一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如图所示。

下列相关分析中正确的是_______________ 。
A.一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因可能是BaO与CO2反应生成BaCO3,覆盖在BaO表面
B.当CO2体积分数达到10%~20%时,氮氧化物吸收率依然较高,其原因可能是BaCO3在一定程度上也能吸收NOx
C.若柴油中硫含量较高,在稀燃过程中,柴油中的硫氧化为SO2,2BaO+2SO2+O2=2BaSO4,BaO吸收氮氧化物的能力会下降至较低水平
D.以上分析均不对
(3)用食盐水作电解液电解烟气脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为 ,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
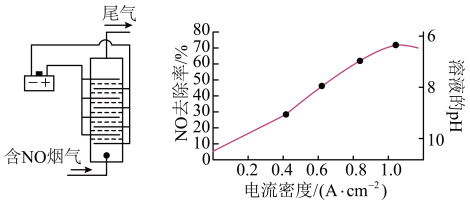
①NO被阳极产生的氧化性物质氧化为 反应的离子方程式为
反应的离子方程式为_______________ 。
②溶液的pH对NO去除率影响的原因是_______________ 。
(1)氧化还原法消除NOx的转化如下:
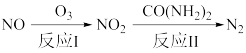
已知:NO(g)+O3(g)=NO2(g)+O2(g)△H=-201kJ·mol-1
2NO(g)+O2(g)=2NO2(g)△H=-116kJ·mol-1
反应I只有一种生成物,则反应I的热化学方程式为
(2)柴油机氮氧化物(NOx)处理技术是一种系统简单,占用空间较小的柴油车尾气处理技术,氮氧化物主要在催化转化装置中被处理。柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,催化转化装置中的物质变化如图所示。

①BaO吸收NO2的化学方程式是
②研究CO2对BaO吸收氮氧化物的影响,一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如图所示。

下列相关分析中正确的是
A.一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因可能是BaO与CO2反应生成BaCO3,覆盖在BaO表面
B.当CO2体积分数达到10%~20%时,氮氧化物吸收率依然较高,其原因可能是BaCO3在一定程度上也能吸收NOx
C.若柴油中硫含量较高,在稀燃过程中,柴油中的硫氧化为SO2,2BaO+2SO2+O2=2BaSO4,BaO吸收氮氧化物的能力会下降至较低水平
D.以上分析均不对
(3)用食盐水作电解液电解烟气脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为
 ,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
①NO被阳极产生的氧化性物质氧化为
 反应的离子方程式为
反应的离子方程式为②溶液的pH对NO去除率影响的原因是
您最近一年使用:0次
2020-09-25更新
|
442次组卷
|
2卷引用:湖北省黄冈市2021届高三9月质量检测化学试题
3 . 碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g) 2CO2(g)△H1=-566kJ·molˉ1
2CO2(g)△H1=-566kJ·molˉ1
H2O(g)+CO(g) H2(g)+CO2(g)△H2=-41kJ·molˉ1
H2(g)+CO2(g)△H2=-41kJ·molˉ1
CO(g)+2H2(g) CH3OH(g)△H3=-107kJ.molˉ1
CH3OH(g)△H3=-107kJ.molˉ1
则2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g)△H=
2CO2(g)+4H2O(g)△H=___ kJ·molˉ1
(2)T℃时,向容积为2L的恒容密闭容器中通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-50kJ·molˉ1。5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
CH3OH(g)+H2O(g)△H=-50kJ·molˉ1。5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
①在0~5min内容器中v(CH3OH)=___ ;
②反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是___ (填标号)
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.H2O(g)的物质的量增加
d.v正(CO2)=v逆(H2)
(3)T℃时,通入2.0molCO和6.0molH2于恒压密闭容器中,起始容积为2L,发生反应:CO(g)+2H2(g) CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
①该温度下上述反应的平衡常数K=___ (保留两位有效数字);
②若达平衡后,再将CO、H2、CH3OH各充入1.0mol,平衡向___ (填“正反应方向”、“逆反应方向”或“不”)移动。
(1)已知:2CO(g)+O2(g)
 2CO2(g)△H1=-566kJ·molˉ1
2CO2(g)△H1=-566kJ·molˉ1H2O(g)+CO(g)
 H2(g)+CO2(g)△H2=-41kJ·molˉ1
H2(g)+CO2(g)△H2=-41kJ·molˉ1CO(g)+2H2(g)
 CH3OH(g)△H3=-107kJ.molˉ1
CH3OH(g)△H3=-107kJ.molˉ1则2CH3OH(g)+3O2(g)
 2CO2(g)+4H2O(g)△H=
2CO2(g)+4H2O(g)△H=(2)T℃时,向容积为2L的恒容密闭容器中通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-50kJ·molˉ1。5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
CH3OH(g)+H2O(g)△H=-50kJ·molˉ1。5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:①在0~5min内容器中v(CH3OH)=
②反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.H2O(g)的物质的量增加
d.v正(CO2)=v逆(H2)
(3)T℃时,通入2.0molCO和6.0molH2于恒压密闭容器中,起始容积为2L,发生反应:CO(g)+2H2(g)
 CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:①该温度下上述反应的平衡常数K=
②若达平衡后,再将CO、H2、CH3OH各充入1.0mol,平衡向
您最近一年使用:0次
2020-09-24更新
|
342次组卷
|
3卷引用:湖北省麻城实验高中2020-2021学年高二上学期12月月考化学试题
4 . 有效去除大气中的NOx,保护臭氧层,是环境保护的重要课题。
(1)在没有NOx催化时,O3的分解可分为以下两步反应进行;
①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=____________ 。
(2)NO做催化剂可以加速臭氧反应,其反应过程如图所示:

已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为____________________________ 。
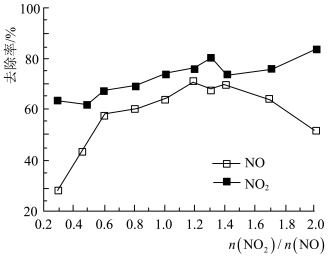
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变 ,NOx的去除率如图所示。
,NOx的去除率如图所示。
已知:NO与Ca(OH)2不反应;
NOx的去除率=1-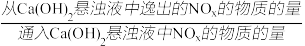 ×100%
×100%
① 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________ 。
②当 大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是
大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8 kJ/mol,反应达到平衡时,N2的体积分数随 的变化曲线如图。
的变化曲线如图。
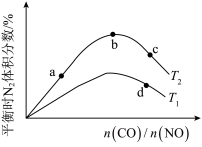
①b点时,平衡体系中C、N原子个数之比接近________ 。
②a、b、c三点CO的转化率从小到大的顺序为________ ;b、c、d三点的平衡常数从大到小的顺序为__________ (以上两空均用a、b、c、d表示)。
③若 =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____ 。
(1)在没有NOx催化时,O3的分解可分为以下两步反应进行;
①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=
(2)NO做催化剂可以加速臭氧反应,其反应过程如图所示:

已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变
 ,NOx的去除率如图所示。
,NOx的去除率如图所示。已知:NO与Ca(OH)2不反应;

NOx的去除率=1-
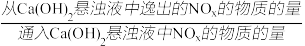 ×100%
×100%①
 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:②当
 大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是
大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8 kJ/mol,反应达到平衡时,N2的体积分数随
 的变化曲线如图。
的变化曲线如图。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从小到大的顺序为
③若
 =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为
您最近一年使用:0次
2020-04-28更新
|
316次组卷
|
5卷引用:湖北省黄冈市麻城市实验高级中学2020届高三第六次模拟考试理综化学试题
5 . 汽车排放的尾气是大气污染气体之一。如何减少污染气体的排放是科学家研究的热门课题。请回答下列问题:
(1)已知:CO的燃烧热为283.0kJ·mol−1,N2(g)+2O2(g) =2NO2(g) ΔH=+64kJ·mol−1,则NO2(g)+2CO(g)= N2(g)+2CO2(g) ΔH=
N2(g)+2CO2(g) ΔH=___ kJ·mol−1,若反应中有14g还原剂发生反应,则转移电子___ mol。
(2)使汽车排放的CO和NO在一定条件下发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6molNO、8molCO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6molNO、8molCO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
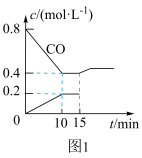
①该反应的化学平衡常数K=___ 。NO的平衡转化率=___ 。
②15min时,若改变反应条件,导致CO浓度发生如图1所示的变化,则改变的条件可能是___ 。
a.缩小容器体积b.增加CO2的量c.体积不变通入少量氩气d.加入催化剂
③当NO与CO的起始浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图2所示,则下列说法正确的是___ 。
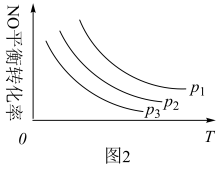
A.该反应ΔH<0 B.p1<p2<p3
C.升高温度正反应速率减小,逆反应速率增大 D.温度不变,增大压强,平衡常数增大
④以下说法中能判断反应2NO(g)+2CO(g) N2(g)+2CO2(g)达到平衡的是
N2(g)+2CO2(g)达到平衡的是___ 。
A.反应物和生成物的物质的量相等 B.单位时间内消耗1molNO同时生成1molCO2
C.混合气体压强不再发生变化 D.NO的浓度不再变化
⑤向反应容器中再分别充入下列气体,能使NO转化率增大的是___ 。
A.O2 B.N2 C.CO D.NO
(1)已知:CO的燃烧热为283.0kJ·mol−1,N2(g)+2O2(g) =2NO2(g) ΔH=+64kJ·mol−1,则NO2(g)+2CO(g)=
 N2(g)+2CO2(g) ΔH=
N2(g)+2CO2(g) ΔH=(2)使汽车排放的CO和NO在一定条件下发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6molNO、8molCO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6molNO、8molCO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
①该反应的化学平衡常数K=
②15min时,若改变反应条件,导致CO浓度发生如图1所示的变化,则改变的条件可能是
a.缩小容器体积b.增加CO2的量c.体积不变通入少量氩气d.加入催化剂
③当NO与CO的起始浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图2所示,则下列说法正确的是

A.该反应ΔH<0 B.p1<p2<p3
C.升高温度正反应速率减小,逆反应速率增大 D.温度不变,增大压强,平衡常数增大
④以下说法中能判断反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)达到平衡的是
N2(g)+2CO2(g)达到平衡的是A.反应物和生成物的物质的量相等 B.单位时间内消耗1molNO同时生成1molCO2
C.混合气体压强不再发生变化 D.NO的浓度不再变化
⑤向反应容器中再分别充入下列气体,能使NO转化率增大的是
A.O2 B.N2 C.CO D.NO
您最近一年使用:0次
名校
6 . 工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:2NO(g)+O2(g)⇌2NO2(g)△H=-113.0kJ•mol-1,2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1;SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为__ 。
②随温度升高,该反应化学平衡常数变化趋势是___ 。
(2)提高2SO2+O2⇌2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是__ 。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是___ (填字母)。
a.温度和容器体积不变,充入1.0molHe b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(1)NOx和SO2在空气中存在下列平衡:2NO(g)+O2(g)⇌2NO2(g)△H=-113.0kJ•mol-1,2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1;SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为
②随温度升高,该反应化学平衡常数变化趋势是
(2)提高2SO2+O2⇌2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是
a.温度和容器体积不变,充入1.0molHe b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
您最近一年使用:0次
2019-10-31更新
|
47次组卷
|
3卷引用:湖北省黄冈市2019-2020学年高二10月月考化学试题
7 . 碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g) 2CO2(g) △H1=-566kJ·molˉ1
2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g) H2(g)+CO2(g) △H2=-41kJ·molˉ1
H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g) CH3OH(g) △H3=-107kJ·molˉ1
CH3OH(g) △H3=-107kJ·molˉ1
则CH3OH(g)+ O2(g)
O2(g)  CO2(g)+2H2O(g) △H=
CO2(g)+2H2O(g) △H=___ kJ·molˉ1
(2)T℃时,向容积均为2L的A、B两个密闭容器中均通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
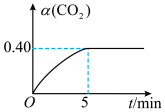
①在0~5min内A容器中v(CH3OH)=___ ;该温度下上述反应的平衡常数K=___ (保留两位有效数字)。
②反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)___ (填“>”“<”或“=”)v(B)。
③反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是___ (填标号)
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.断裂H-H键的数目是形成C-O键数目的2倍
d.v逆(CO2)=v正(H2)
(1)已知:2CO(g)+O2(g)
 2CO2(g) △H1=-566kJ·molˉ1
2CO2(g) △H1=-566kJ·molˉ1H2O(g)+CO(g)
 H2(g)+CO2(g) △H2=-41kJ·molˉ1
H2(g)+CO2(g) △H2=-41kJ·molˉ1CO(g)+2H2(g)
 CH3OH(g) △H3=-107kJ·molˉ1
CH3OH(g) △H3=-107kJ·molˉ1则CH3OH(g)+
 O2(g)
O2(g)  CO2(g)+2H2O(g) △H=
CO2(g)+2H2O(g) △H=(2)T℃时,向容积均为2L的A、B两个密闭容器中均通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
①在0~5min内A容器中v(CH3OH)=
②反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)
③反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.断裂H-H键的数目是形成C-O键数目的2倍
d.v逆(CO2)=v正(H2)
您最近一年使用:0次
2019-09-28更新
|
219次组卷
|
4卷引用:湖北省黄冈市麻城市实验高中2020-2021学年高二上学期10月月考化学试题
名校
解题方法
8 . H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-49.0kJ•mol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJ•mol-1
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.1kJ•mol-1
CO2(g)+H2(g) ΔH3=-41.1kJ•mol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ΔH1,则ΔH1=
CH3OH(g) ΔH1,则ΔH1=___ kJ•mol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
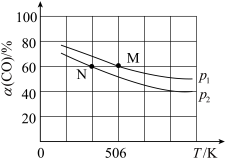
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g) CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__ P2,判断的理由是_____ 。
(3)若反应 CO(g)+2H2(g) CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
①下列各项能作为判断该反应达到平衡标志的是____ (填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___ (kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___ kPa•min-1。
(1)已知:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-49.0kJ•mol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJ•mol-1CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3=-41.1kJ•mol-1
CO2(g)+H2(g) ΔH3=-41.1kJ•mol-1H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)
 CH3OH(g) ΔH1,则ΔH1=
CH3OH(g) ΔH1,则ΔH1=A.高温 B.低温 C.任何温度条件下
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)
 CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1
(3)若反应 CO(g)+2H2(g)
 CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:| 时间/min | 0 | 5 | 10 | 15 |
| H2 | 4 | 2 | ||
| CO | 2 | 1 | ||
| CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=
您最近一年使用:0次
2019-09-28更新
|
359次组卷
|
5卷引用:湖北省黄岗市浠水实验高中2020届高三上学期12月月考理综化学试题
名校
9 . 研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3•H2O(aq) =NH4HSO3(aq) △H1 = a kJ•mol-1;② NH3•H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJ•mol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJ•mol-1,则反应 2SO2(g) + 4NH3•H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H =______ 。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)⇌N2(g) + CO2(g) △H=-34.0 kJ•mol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
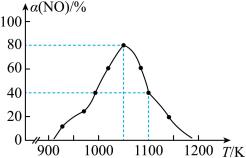
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________ ; 在1100K 时,CO2的体积分数为______ 。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________ (已知:气体分压=气体总压×体积分数)。
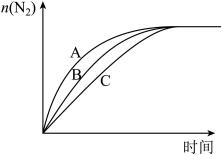
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________ (填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)⇌N2(g) + 2CO2(g) △H2 =-746.8 kJ•mol-1。实验测得,υ正=k正•c2(NO) •c2(CO) ,υ逆=k逆•c(N2) •c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____ (填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则 =
=_____ (保留2位有效数字)。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3•H2O(aq) =NH4HSO3(aq) △H1 = a kJ•mol-1;② NH3•H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJ•mol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJ•mol-1,则反应 2SO2(g) + 4NH3•H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H =
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)⇌N2(g) + CO2(g) △H=-34.0 kJ•mol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:

①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是

(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)⇌N2(g) + 2CO2(g) △H2 =-746.8 kJ•mol-1。实验测得,υ正=k正•c2(NO) •c2(CO) ,υ逆=k逆•c(N2) •c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
 =
=
您最近一年使用:0次
2019-05-28更新
|
868次组卷
|
9卷引用:湖北省罗田县第一中学2022-2023学年高二上学期12月月考化学试题
名校
解题方法
10 . 雾霾中含有多种污染物,其中有氮氧化物(NOx)、CO、SO2等,给人类健康带来了严重影响,化学在解决雾霾污染中发挥了重要作用。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原消除污染。请写出CH4与NO2反应的化学方程式_____________ 。
(2)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-746.8kJ·mol-1
N2(g)+2CO2(g) △H=-746.8kJ·mol-1
4CO(g)+2NO2(g) 3CO2(g)+N2(g) △H=-1200kJ·mol-1
3CO2(g)+N2(g) △H=-1200kJ·mol-1
则反应的CO(g)+NO2(g) CO2(g)+NO(g) △H=
CO2(g)+NO(g) △H=_____ kJ·mol-1
(3)氮硫的氧化物间存在如下转化SO2(g)+NO2(g) SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:
SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:

①该反应正反应的活化能___ (填“>”或“<”)逆反应的活化能。
②反应速率v=V正-V逆=k正xSO2·xNO2-k逆xSO3·xNO,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,T℃时,k正_____ k逆(填“>”、“<”或“=”)。
③T℃时,在体积为2L的容器中加入1molSO2(g)、1molNO2(g),5min时测得xSO3=0.2,此时平衡向___ (填“正”或“逆”)反应方向移动, =
=___ (保留2位小数)。
(4)已知:2NO(g)=N2(g)+O2(g) ΔH=-180.6kJ/mol,在某表面催化剂的作用下,NO可以分解生成N2、O2,其反应机理可简化为:
第一步:2NO →N2O2快
第二步:N2O2 →N2+O2慢
下列表述正确的是____ (填标号)。
A.所有化合反应都是放热反应
B.N2O2是该反应的的中间产物
C.加入合适的催化剂可以减小反应热ΔH,加快反应速率
D.第一步的活化能比第二步低
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原消除污染。请写出CH4与NO2反应的化学方程式
(2)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H=-746.8kJ·mol-1
N2(g)+2CO2(g) △H=-746.8kJ·mol-14CO(g)+2NO2(g)
 3CO2(g)+N2(g) △H=-1200kJ·mol-1
3CO2(g)+N2(g) △H=-1200kJ·mol-1则反应的CO(g)+NO2(g)
 CO2(g)+NO(g) △H=
CO2(g)+NO(g) △H=(3)氮硫的氧化物间存在如下转化SO2(g)+NO2(g)
 SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:
SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:
①该反应正反应的活化能
②反应速率v=V正-V逆=k正xSO2·xNO2-k逆xSO3·xNO,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,T℃时,k正
③T℃时,在体积为2L的容器中加入1molSO2(g)、1molNO2(g),5min时测得xSO3=0.2,此时平衡向
 =
=(4)已知:2NO(g)=N2(g)+O2(g) ΔH=-180.6kJ/mol,在某表面催化剂的作用下,NO可以分解生成N2、O2,其反应机理可简化为:
第一步:2NO →N2O2快
第二步:N2O2 →N2+O2慢
下列表述正确的是
A.所有化合反应都是放热反应
B.N2O2是该反应的的中间产物
C.加入合适的催化剂可以减小反应热ΔH,加快反应速率
D.第一步的活化能比第二步低
您最近一年使用:0次



