亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为__________ 。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g) 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
则n=_________ ;k=___________ 。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
则该温度下,ΔH3=______ kJ/mol;K3=______ (用K1和K2表示)。
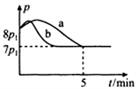
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=______ (填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)的变化如图曲线b所示,则改变的条件是_____________ ;K3=___________ L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________ (填“增大”、“减小”或“不变”)。
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为
(2)一定条件下,在密闭容器中发生反应:2NOCl(g)
 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:| 序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
| ① | 0.30 | 3.60×10-9 |
| ② | 0.60 | 1.44×10-8 |
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
| 序号 | 热化学方程式 | 平衡常数 |
| ① | 2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g) ΔH1=a kJ/mol NaNO3(s)+NOCl(g) ΔH1=a kJ/mol | K1 |
| ② | 4NO2(g)+2NaCl(s) 2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ/mol 2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ/mol | K2 |
| ③ | 2NO(g)+Cl2(g) 2NOCl(g) ΔH3 2NOCl(g) ΔH3 | K3 |
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=

更新时间:2018-05-26 19:11:51
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】I.(1)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
① CaSO4(s)+CO(g)=
CaSO4(s)+CO(g)= CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g)= C(s)+
C(s)+ CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)=CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=___________________________________________________ (用ΔH1、ΔH2和ΔH3表示)。
(2)已知:25 ℃、101 kPa时,Mn(s)+O2(g)=MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是___________________________ 。
(3)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
①2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
②NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
③(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
ΔH3和ΔH1、ΔH2之间的关系是ΔH3=__________________________________ 。
(4)已知: ①WO2(s)+2H2(g)=W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1
②WO2(g)+2H2(g)=W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1
则WO2(s)=WO2(g)的ΔH=_____________________________________________ 。
II.利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测定混合液最高温度。回答下列问题:
(1)写出该反应的热化学方程式[生成1 mol H2O(l)时的反应热为-57.3 kJ/mol]:________________________________________________________________________ 。
(2)使盐酸与NaOH溶液混合均匀的正确操作是______ (填字母)。
A.用温度计小心搅拌 B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒上下轻轻地搅动
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=________ (结果保留一位小数)。
①
 CaSO4(s)+CO(g)=
CaSO4(s)+CO(g)= CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g)=
 C(s)+
C(s)+ CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1反应2CaSO4(s)+7CO(g)=CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=
(2)已知:25 ℃、101 kPa时,Mn(s)+O2(g)=MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是
(3)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
①2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
②NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
③(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
ΔH3和ΔH1、ΔH2之间的关系是ΔH3=
(4)已知: ①WO2(s)+2H2(g)=W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1
②WO2(g)+2H2(g)=W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1
则WO2(s)=WO2(g)的ΔH=
II.利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测定混合液最高温度。回答下列问题:
(1)写出该反应的热化学方程式[生成1 mol H2O(l)时的反应热为-57.3 kJ/mol]:
(2)使盐酸与NaOH溶液混合均匀的正确操作是
A.用温度计小心搅拌 B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒上下轻轻地搅动
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
您最近一年使用:0次
【推荐2】研究氮及其化合物的性质及转化,对研究自然界中氮的循环有着重大的意义。
I.合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。
工业合成氨方程式为:N2(g)+3H2(g) 2NH3(g) △H
2NH3(g) △H
我国科学家在合成氨反应机理研究中取得新进展,首次报道了Li-3d过渡金属这一复合催化体系,并提出了“氮转移”催化机理。
①3LiH(s)+N2(g)=Li2NH(s)+LiNH2(s) △H1=akJ•mol-1
②Li2NH(s)+2H2(g)=2LiH(s)+NH3(g) △H2=bkJ•mol-1
③LiNH2(s)+H2g)=LiH(s)+NH3(g) △H3=ckJ•mol-1
(1)当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

则①N2(g)+3H2(g) 2NH3(g) △H=
2NH3(g) △H=___ kJ•mol-1;该反应属于反应填___ (“放热”、“吸热”),判断理由___ 。
②500℃时,反应的平衡常数Kp(100MPa)___ Kp(30MPa)。填“大于”、“等于”、“小于”)
③500℃、30MPa时,氢气的平衡转化率为___ (保留4位有效数字),Kp=___ (列出计算式即可)。[Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
II.防治氮氧化物造成的空气污染是目前环境保护领域的重要课题之一。
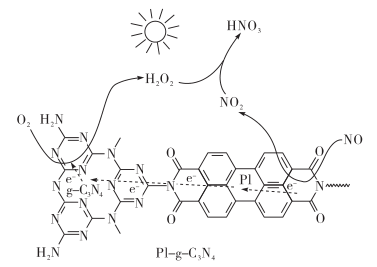
(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应为O2+2H++2e-=H2O2,则Pl端的反应为___ 。
(3)将NO和CO的混合气体(物质的量之比1:1)以一定的流速通过催化剂a,相同时间、不同温度下测得脱氮率与温度的关系如图所示。
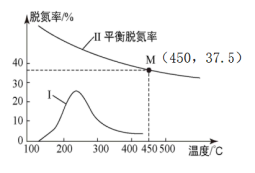
①曲线Ⅰ显示随着温度升高脱氮率先增大后减小,其中减小的原因是___ 。
②已知催化剂b活性高于催化剂a,且450℃下活性最大,若保持其它条件和反应时间不变,用b替代a进行上述实验,则450℃下对应的脱氮率__ 37.5%(填“≤”、“<”、“无法判断”)。
I.合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。
工业合成氨方程式为:N2(g)+3H2(g)
 2NH3(g) △H
2NH3(g) △H我国科学家在合成氨反应机理研究中取得新进展,首次报道了Li-3d过渡金属这一复合催化体系,并提出了“氮转移”催化机理。
①3LiH(s)+N2(g)=Li2NH(s)+LiNH2(s) △H1=akJ•mol-1
②Li2NH(s)+2H2(g)=2LiH(s)+NH3(g) △H2=bkJ•mol-1
③LiNH2(s)+H2g)=LiH(s)+NH3(g) △H3=ckJ•mol-1
(1)当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

则①N2(g)+3H2(g)
 2NH3(g) △H=
2NH3(g) △H=②500℃时,反应的平衡常数Kp(100MPa)
③500℃、30MPa时,氢气的平衡转化率为
II.防治氮氧化物造成的空气污染是目前环境保护领域的重要课题之一。
(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应为O2+2H++2e-=H2O2,则Pl端的反应为

(3)将NO和CO的混合气体(物质的量之比1:1)以一定的流速通过催化剂a,相同时间、不同温度下测得脱氮率与温度的关系如图所示。

①曲线Ⅰ显示随着温度升高脱氮率先增大后减小,其中减小的原因是
②已知催化剂b活性高于催化剂a,且450℃下活性最大,若保持其它条件和反应时间不变,用b替代a进行上述实验,则450℃下对应的脱氮率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】高铁酸盐等具有强氧化性,溶液pH越小氧化性越强,可用于除去废水中的氨氮、重金属等。
(1)用Na2O2与FeSO4干法制备Na2FeO4的反应历程中包含的热化学方程式有:
2FeSO4(s)+ Na2O2(s) = Fe2O3(s)+Na2SO4(s)+SO3(g) H1=akJ·mol-1
H1=akJ·mol-1
2 Fe2O3(s)+2 Na2O2(s) =4NaFeO2(s)+ O2(g) H2=bkJ·mol-1
H2=bkJ·mol-1
2SO3(g) +2Na2O2(s) =2Na2SO4(s)+ O2(g) H3=ckJ·mol-1
H3=ckJ·mol-1
2NaFeO2(s)+3Na2O2(s) =2Na2FeO4(s)+2Na2O(s) H4=dkJ·mol-1
H4=dkJ·mol-1
则反应2FeSO4(s) + 6Na2O2(s) =2Na2FeO4(s)+2Na2O(s)+2Na2SO4(s) + O2(g)的 H=
H=_____ kJ·mol-1(用含a、b、c、d的代数式表示);该反应中,每生成1mol Na2FeO4转移电子数为_____ mol。
(2)J.C.Poggendor早在1841年利用纯铁作电极插入浓的NaOH溶液电解制得Na2FeO4,阳极生成FeO42-的电极反应式为_____ ;Deinimger等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是_____ 。
(3)K2FeO4的稳定性与pH关系如图-1所示,用K2FeO4去除某氨氮(NH3-N)废水,氨氮去除率与pH关系如图-2;用K2FeO4处理Zn2+浓度为0.12mg·L—1的含锌废水{Ksp[Zn(OH)2]=1.2×10-17},锌残留量与pH关系如图-3所示(已知:K2FeO4与H2O反应生成Fe(OH)3的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀)。
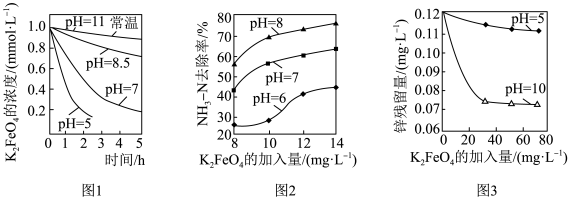
①pH=11时,K2FeO4与H2O反应生成Fe(OH)3和O2等物质的离子方程式为_____ 。
②图-2中:pH越大氨氮的去除率也越大,其原因可能是_____ 。
③图-3中:pH=10时锌的去除率比pH=5时大得多,其原因是_____ (从锌的存在形态的角度说明)。
(1)用Na2O2与FeSO4干法制备Na2FeO4的反应历程中包含的热化学方程式有:
2FeSO4(s)+ Na2O2(s) = Fe2O3(s)+Na2SO4(s)+SO3(g)
 H1=akJ·mol-1
H1=akJ·mol-12 Fe2O3(s)+2 Na2O2(s) =4NaFeO2(s)+ O2(g)
 H2=bkJ·mol-1
H2=bkJ·mol-12SO3(g) +2Na2O2(s) =2Na2SO4(s)+ O2(g)
 H3=ckJ·mol-1
H3=ckJ·mol-12NaFeO2(s)+3Na2O2(s) =2Na2FeO4(s)+2Na2O(s)
 H4=dkJ·mol-1
H4=dkJ·mol-1则反应2FeSO4(s) + 6Na2O2(s) =2Na2FeO4(s)+2Na2O(s)+2Na2SO4(s) + O2(g)的
 H=
H=(2)J.C.Poggendor早在1841年利用纯铁作电极插入浓的NaOH溶液电解制得Na2FeO4,阳极生成FeO42-的电极反应式为
(3)K2FeO4的稳定性与pH关系如图-1所示,用K2FeO4去除某氨氮(NH3-N)废水,氨氮去除率与pH关系如图-2;用K2FeO4处理Zn2+浓度为0.12mg·L—1的含锌废水{Ksp[Zn(OH)2]=1.2×10-17},锌残留量与pH关系如图-3所示(已知:K2FeO4与H2O反应生成Fe(OH)3的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀)。

①pH=11时,K2FeO4与H2O反应生成Fe(OH)3和O2等物质的离子方程式为
②图-2中:pH越大氨氮的去除率也越大,其原因可能是
③图-3中:pH=10时锌的去除率比pH=5时大得多,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】优化反应条件是研究化学反应的重要方向。
(1)某实验小组设计以 与
与 的反应(
的反应(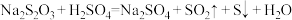 )来探究外界条件对化学反应速率的影响,实验方案如下表所示。
)来探究外界条件对化学反应速率的影响,实验方案如下表所示。
①表中,
___________ ,
___________ 。
②实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象为___________ 。
(2)对于反应 ,速率方程
,速率方程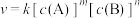 ,k为速率常数(只受温度影响),
,k为速率常数(只受温度影响),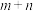 为反应级数。已知
为反应级数。已知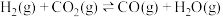
 ,
, 的瞬时生成速率
的瞬时生成速率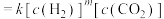 。一定温度下,控制
。一定温度下,控制 起始浓度为
起始浓度为 ,改变
,改变 的起始浓度,进行上述反应,得到
的起始浓度,进行上述反应,得到 的瞬时生成速率和
的瞬时生成速率和 起始浓度呈如图所示的直线关系。
起始浓度呈如图所示的直线关系。

①该反应的反应级数为___________ 。
②速率常数
___________ 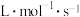 。
。
③当 的起始浓度为
的起始浓度为 ,反应进行到某一时刻时,测得
,反应进行到某一时刻时,测得 的浓度为
的浓度为 ,此时
,此时 的瞬时生成速率
的瞬时生成速率
___________  。
。
④该反应的反应速率(v)随时间(t)的变化关系如图所示,若 、
、 时刻只改变一个条件,下列说法错误的是
时刻只改变一个条件,下列说法错误的是___________ (填标号)。

a.在 时,采取的措施可以是升高温度
时,采取的措施可以是升高温度
b.在 时,采取的措施可以是增大
时,采取的措施可以是增大 的浓度
的浓度
c.在 时,容器内
时,容器内 的转化率是整个过程中的最大值
的转化率是整个过程中的最大值
(1)某实验小组设计以
 与
与 的反应(
的反应(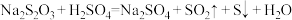 )来探究外界条件对化学反应速率的影响,实验方案如下表所示。
)来探究外界条件对化学反应速率的影响,实验方案如下表所示。| 实验序号 |  溶液 溶液 |  溶液 溶液 | 蒸馏水 | 温度/℃ | ||
浓度/( ) ) | 体积 | 浓度/( ) ) | 体积 | 体积 | ||
| Ⅰ | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
| Ⅱ | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
| Ⅲ | 0.1 | b | 0.1 | 1.5 | 9 | 30 |


②实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象为
(2)对于反应
 ,速率方程
,速率方程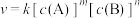 ,k为速率常数(只受温度影响),
,k为速率常数(只受温度影响),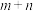 为反应级数。已知
为反应级数。已知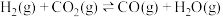
 ,
, 的瞬时生成速率
的瞬时生成速率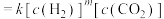 。一定温度下,控制
。一定温度下,控制 起始浓度为
起始浓度为 ,改变
,改变 的起始浓度,进行上述反应,得到
的起始浓度,进行上述反应,得到 的瞬时生成速率和
的瞬时生成速率和 起始浓度呈如图所示的直线关系。
起始浓度呈如图所示的直线关系。
①该反应的反应级数为
②速率常数

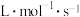 。
。③当
 的起始浓度为
的起始浓度为 ,反应进行到某一时刻时,测得
,反应进行到某一时刻时,测得 的浓度为
的浓度为 ,此时
,此时 的瞬时生成速率
的瞬时生成速率
 。
。④该反应的反应速率(v)随时间(t)的变化关系如图所示,若
 、
、 时刻只改变一个条件,下列说法错误的是
时刻只改变一个条件,下列说法错误的是
a.在
 时,采取的措施可以是升高温度
时,采取的措施可以是升高温度b.在
 时,采取的措施可以是增大
时,采取的措施可以是增大 的浓度
的浓度c.在
 时,容器内
时,容器内 的转化率是整个过程中的最大值
的转化率是整个过程中的最大值
您最近一年使用:0次
【推荐2】已知
Fe(s)+CO2(g) FeO(s)+CO(g) K1①
FeO(s)+CO(g) K1①
Fe(s)+H2O(g) FeO(s)+H2(g) K2②
FeO(s)+H2(g) K2②
H2(g)+CO2(g) H2O(g)+CO(g)K3③
H2O(g)+CO(g)K3③
又已知不同温度下,K1、K2值如右表:
(1)判断反应③达到化学平衡状态的依据是____________ 。
a.混合气体的平均摩尔质量不变
b.混合气体中c(CO)不变
c.v(H2O)正=v(H2)逆
d.断裂2 mol H—O键的同时生成1 mol H—H键
(2)若500 ℃时进行反应①,CO2起始浓度为2 mol·L-1,2分钟后建立平衡,则CO2转化率为________ ,用CO表示的速率为________________ 。
(3)下列图象不符合反应②的是___________ (填序号)(图中v是速率,φ为混合物中H2的体积百分含量)。
(4)900 ℃进行反应③,其平衡常数K3为____________ (求具体数值),焓变ΔH__________ 0(填“>”“=”或“<”),理由是______________ 。
Fe(s)+CO2(g)
 FeO(s)+CO(g) K1①
FeO(s)+CO(g) K1①Fe(s)+H2O(g)
 FeO(s)+H2(g) K2②
FeO(s)+H2(g) K2②H2(g)+CO2(g)
 H2O(g)+CO(g)K3③
H2O(g)+CO(g)K3③又已知不同温度下,K1、K2值如右表:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
(1)判断反应③达到化学平衡状态的依据是
a.混合气体的平均摩尔质量不变
b.混合气体中c(CO)不变
c.v(H2O)正=v(H2)逆
d.断裂2 mol H—O键的同时生成1 mol H—H键
(2)若500 ℃时进行反应①,CO2起始浓度为2 mol·L-1,2分钟后建立平衡,则CO2转化率为
(3)下列图象不符合反应②的是

(4)900 ℃进行反应③,其平衡常数K3为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】苯甲醛(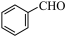 )是生产氨苄青霉素、某些苯胺染料等产品的重要中间体。制备苯甲醛的常用方法有气相催化氧化法和电催化氧化法。
)是生产氨苄青霉素、某些苯胺染料等产品的重要中间体。制备苯甲醛的常用方法有气相催化氧化法和电催化氧化法。
I.气相催化氧化法(以Ce/ZSM-5为催化剂)主要反应: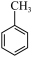 (g)+O2(g)
(g)+O2(g)
 (g)+H2O(g) ΔH
(g)+H2O(g) ΔH
①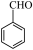 (g)+ 8O2(g)=7CO2(g)+3H2O(g) ΔH=-3452.6kJ/mol
(g)+ 8O2(g)=7CO2(g)+3H2O(g) ΔH=-3452.6kJ/mol
② (g)+9O2(g)= 7CO2(g)+4H2O(g) ΔH=-3784.9kJ/mol
(g)+9O2(g)= 7CO2(g)+4H2O(g) ΔH=-3784.9kJ/mol
则反应 (g)+ O2(g)
(g)+ O2(g)
 (g) +H2O(g) ΔH=
(g) +H2O(g) ΔH=



(3)其他条件相同、不同空速下测得苯甲醛的选择性和收率如图所示。
已知:①空缝指鼓入空气的速度,单位为h-1;
②苯甲醛只有吸附在催化剂表面才能被进一步氧化为苯甲酸。
据以上信息,分析空缝由1000h-1增大至2500h-1过程中苯甲醛选择性增加的原因:
(4)合成苯甲醛的最佳温度和空速应为___________(填序号)。
| A.350℃、5000h-1 | B.350℃、2500h-1 |
| C.410℃、5000h-1 | D.410℃、2500h-1 |
II.电催化氧化法
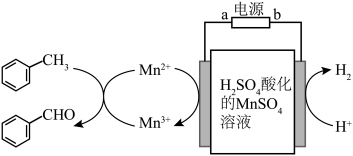
以硫酸酸化的MnSO4溶液作为电解媒质间接氧化甲苯制备苯甲醛的工艺方案如图所示:
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】碳及其化合物与人类工农业生产、生活紧密相关。如甲醇就是一种重要的化工原料。
(1)已知:①CH3OH(l)+ O2(g)=CO2(g)+2H2O(g) ΔH =-637.8 kJ·mol-1;
O2(g)=CO2(g)+2H2O(g) ΔH =-637.8 kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) ΔH=- 566.0 kJ·mol-1
则反应③CH3OH(1)+O2(g) CO(g)+2H2O(g)的ΔH=
CO(g)+2H2O(g)的ΔH=________________ 。
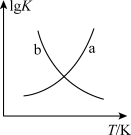
(2)图中能正确表示反应③的平衡常数的对数(lgK)随着温度(T)变化的曲线是_____________ (填“a”或“b”)。
(3)不同催化剂对CO和H2生成CH3OH的效果比较如下表所示:
①结合上表信息综合考虑,建议目前最好选择____________ 作催化剂。一般来说,催化剂的活性越好,表示使反应活化能降低得越____________ (填“多”或“少”),反应速率越____________ (填“快”或“慢”);
②选择催化剂无须考虑的因素是____________ (填正确答案标号)
A.更长的使用寿命
B.在延长使用期间有更高的平衡转化率
C.较高的活性和优越的选择性,副产物少
D.在较大的合成气组成范围内的操作弹性
E.对硫敏感(易与杂质气体中的硫元素结合)
(4)某实验室控制CO和H2的初始投料比为1:2 (物质的量)时,进行反应:
CO(g)+2H2(g) CH3OH(g) ΔH= - 90.0 kJ·mol-1
CH3OH(g) ΔH= - 90.0 kJ·mol-1
下列措施不利于提高CO平衡转化率的措施是 。(填正确答案标号)
(1)已知:①CH3OH(l)+
 O2(g)=CO2(g)+2H2O(g) ΔH =-637.8 kJ·mol-1;
O2(g)=CO2(g)+2H2O(g) ΔH =-637.8 kJ·mol-1; ②2CO(g)+O2(g)=2CO2(g) ΔH=- 566.0 kJ·mol-1
则反应③CH3OH(1)+O2(g)
 CO(g)+2H2O(g)的ΔH=
CO(g)+2H2O(g)的ΔH=(2)图中能正确表示反应③的平衡常数的对数(lgK)随着温度(T)变化的曲线是

(3)不同催化剂对CO和H2生成CH3OH的效果比较如下表所示:
| 催化剂种类 | 操作条件 | 性能比较 |
| 锌铬催化剂 (ZnO-Cr2O3) | 590 K-670 K 25 MPa-35 MPa | 选择性低 活性低 |
| 铜基催化剂 (CuO-ZnO-Al2O3) | 483 K-573 K 5 MPa-10 MPa | 选择性高(99%) 活性好 |
| 钯系催化剂 | ________ | 选择性低 活性一般 |
| 钼系催化剂 (MoS2-K2CO3-MgO-SiO2) | 533 K 8.1 MPa | 选择性53.2% CO的转化率36.1% |
②选择催化剂无须考虑的因素是
A.更长的使用寿命
B.在延长使用期间有更高的平衡转化率
C.较高的活性和优越的选择性,副产物少
D.在较大的合成气组成范围内的操作弹性
E.对硫敏感(易与杂质气体中的硫元素结合)
(4)某实验室控制CO和H2的初始投料比为1:2 (物质的量)时,进行反应:
CO(g)+2H2(g)
 CH3OH(g) ΔH= - 90.0 kJ·mol-1
CH3OH(g) ΔH= - 90.0 kJ·mol-1下列措施不利于提高CO平衡转化率的措施是 。(填正确答案标号)
| A.适当降低反应温度 |
| B.恒压条件下再充入a mol CO和2a mol H2 |
| C.恒容条件下再充入a mol CO和2a mol H2 |
| D.液化分离甲醇 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】为了保护环境,充分利用资源,可将工业废弃物转变成重要的化工原料。回答下列问题:
(1)可用NaClO3氧化酸性FeCl2废液得到FeCl3,FeCl3具有净水作用,但腐蚀设备。
①写出NaClO3氧化酸性FeCl2的离子方程式:__________________________ 。
②若酸性FeCl2废液中:c(Fe2+)=2.0×10-2 mol∕L,c(Fe3+)=1.0×10-3 mol∕L,c(Cl-)=5.3×10-2 mol∕L,则该溶液的pH约为_________ 。
③FeCl3净水的原理是:___________________________ (用离子方程式及适当文字回答);
(2)可用废铁屑为原料,按下图的工艺流程制备聚合硫酸铁(PFS),PFS是一种新型的
絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
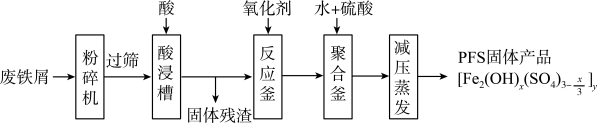
①酸浸时最合适的酸是______________ 。
②反应釜中加入的氧化剂,下列试剂中最合适的是____________ (填标号)。
a.HNO3 b.KMnO4 c.Cl2 d.H2O2
检验其中Fe2+是否完全被氧化,应选择__________ (填标号)。
a.K3[Fe(CN)6]溶液 b.Na2SO3溶液 c.KSCN溶液
③生成PFS的离子方程式为:xFe3++yH2O ⇌ Fex(OH)y(3x-y)++yH+欲使平衡正向移动可采用的方法是____________ (填标号)。
a.加入NaHCO3 b.降温 c.加水稀释 d.加入NH4Cl
(1)可用NaClO3氧化酸性FeCl2废液得到FeCl3,FeCl3具有净水作用,但腐蚀设备。
①写出NaClO3氧化酸性FeCl2的离子方程式:
②若酸性FeCl2废液中:c(Fe2+)=2.0×10-2 mol∕L,c(Fe3+)=1.0×10-3 mol∕L,c(Cl-)=5.3×10-2 mol∕L,则该溶液的pH约为
③FeCl3净水的原理是:
(2)可用废铁屑为原料,按下图的工艺流程制备聚合硫酸铁(PFS),PFS是一种新型的
絮凝剂,处理污水比FeCl3高效,且腐蚀性小。

①酸浸时最合适的酸是
②反应釜中加入的氧化剂,下列试剂中最合适的是
a.HNO3 b.KMnO4 c.Cl2 d.H2O2
检验其中Fe2+是否完全被氧化,应选择
a.K3[Fe(CN)6]溶液 b.Na2SO3溶液 c.KSCN溶液
③生成PFS的离子方程式为:xFe3++yH2O ⇌ Fex(OH)y(3x-y)++yH+欲使平衡正向移动可采用的方法是
a.加入NaHCO3 b.降温 c.加水稀释 d.加入NH4Cl
您最近一年使用:0次
【推荐3】李克强总理在《2018年国务院政府工作报告》中强调“今年二氧化硫、氮氧化物排放量要下降3%。”研究烟气的脱硝(除NOx)、脱硫(除SO2)有着积极的环保意义。
Ⅰ.汽车排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g) 2CO2(g)+N2(g)ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如图。
2CO2(g)+N2(g)ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如图。

(1)图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是___ (填“a”或“b”)。
(2)在a曲线所示反应中,0~10min内,CO的平均反应速率v(CO)=____ ;T℃时,该反应的化学平衡常数K=___ ;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2mol,则平衡将移动____ (填“向左”、“向右”或“不”)。
(3)15min时,n(NO)发生图中所示变化,则改变的条件可能是___ (填序号)
A.充入少量CO B.将N2液化移出体系 C.升高温度 D.加入催化剂
(4)Ⅱ.已知有下列反应:
①5O2(g)+4NH3(g) 6H2O(g)+4NO(g)△H1
6H2O(g)+4NO(g)△H1
②N2(g)+O2(g) 2NO(g)△H2
2NO(g)△H2
③2NO(g)+O2(g) 2NO2(g)△H3
2NO2(g)△H3
若在高效催化剂作用下可发生8NH3(g)+6NO2(g)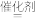 7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=
7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=___ (用△H1,△H2,△H3表示),△S___ 0。
(5)某温度下,向某恒容密闭容器中充入一定量的NH3和NO2,按照(4)的原理模拟污染物的处理。若容器中观察到___ (填序号),可判断该反应达到平衡状态。
A.混合气体颜色不再改变
B.混合气体的密度不再改变
C.混合气体平均相对分子质量不再改变
D.NH3和NO2的物质的量之比不再改变
Ⅰ.汽车排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)
 2CO2(g)+N2(g)ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如图。
2CO2(g)+N2(g)ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如图。
(1)图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是
(2)在a曲线所示反应中,0~10min内,CO的平均反应速率v(CO)=
(3)15min时,n(NO)发生图中所示变化,则改变的条件可能是
A.充入少量CO B.将N2液化移出体系 C.升高温度 D.加入催化剂
(4)Ⅱ.已知有下列反应:
①5O2(g)+4NH3(g)
 6H2O(g)+4NO(g)△H1
6H2O(g)+4NO(g)△H1②N2(g)+O2(g)
 2NO(g)△H2
2NO(g)△H2③2NO(g)+O2(g)
 2NO2(g)△H3
2NO2(g)△H3若在高效催化剂作用下可发生8NH3(g)+6NO2(g)
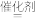 7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=
7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=(5)某温度下,向某恒容密闭容器中充入一定量的NH3和NO2,按照(4)的原理模拟污染物的处理。若容器中观察到
A.混合气体颜色不再改变
B.混合气体的密度不再改变
C.混合气体平均相对分子质量不再改变
D.NH3和NO2的物质的量之比不再改变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】NH3水溶液呈弱碱性,并可用作农业化肥,现进行下列研究:
现将一定量的H2和N2充入10L的密闭容器中,在一定条件下使其发生反应,有关H2、N2、NH3三者的物质的量的变化与时间的关系如图所示:

(1)若t1 = 10min,则0至t1时间内H2物质的反应速率为_______________________ ;
(2)下列说法中,可以证明反应N2(g)+3H2(g) 2NH3(g)已达到平衡状态的是
2NH3(g)已达到平衡状态的是__________ 。
①单位时间内生成n molN2的同时生成2n molNH3
②1个N≡N键断裂的同时,有3个H—H键形成
③1个N≡N键断裂的同时,有6个N—H键形成
④混合气体的压强不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
(3)根据图中曲线变化情况判断,t1时刻改变的反应条件可能是________ (填下列各项序号)
a.加入了催化剂 b.降低了反应的温度 c.向容器中又充入了气体N2
(4)平衡时N2的转化率为____________ ,容器内总压强是反应前的__________ 倍。
现将一定量的H2和N2充入10L的密闭容器中,在一定条件下使其发生反应,有关H2、N2、NH3三者的物质的量的变化与时间的关系如图所示:

(1)若t1 = 10min,则0至t1时间内H2物质的反应速率为
(2)下列说法中,可以证明反应N2(g)+3H2(g)
 2NH3(g)已达到平衡状态的是
2NH3(g)已达到平衡状态的是①单位时间内生成n molN2的同时生成2n molNH3
②1个N≡N键断裂的同时,有3个H—H键形成
③1个N≡N键断裂的同时,有6个N—H键形成
④混合气体的压强不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
(3)根据图中曲线变化情况判断,t1时刻改变的反应条件可能是
a.加入了催化剂 b.降低了反应的温度 c.向容器中又充入了气体N2
(4)平衡时N2的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】丙烯是重要的化工原料,通常用丙烷脱氢反应制备。其中丙烷无氧脱氢反应方程式为:CH3CH2CH3(g) CH3CH=CH2(g)+H2(g) △H。
CH3CH=CH2(g)+H2(g) △H。
(1)科学家将最稳定的单质的标准生成焓规定为零。在温度为298.15K时由最稳定的单质生成1mol化合物时的焓变,叫做该物质的标准摩尔生成焓。部分物质的标准摩尔生成焓数据如表(单位:kJ·mol-1):
由此可求得△H=__ kJ·mol-1。
(2)在一定条件下的体积为2L的密闭容器中投入1mol丙烷,体系的起始压强为P0kPa。反应过程中压强变化如表:
则反应前6分钟内用氢气的浓度表示的反应速率为__ (结果保留两位有效数据,下同)。此温度下的压强平衡常数Kp=__ 。
(3)如图中四条线对应的是(2)中在0.01kPa和0.1kPa下丙烷和丙烯在平衡体系中的体积分数随温度的变化情况。
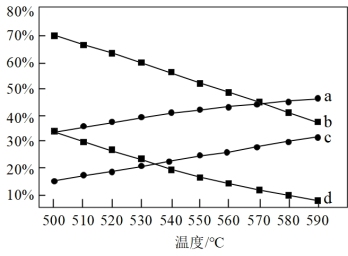
某同学认为曲线b不可能表示丙烯的体积分数,请写出两条支持该观点的理由:①__ ;②__ 。表示在0.1kPa下丙烯的体积分数的曲线为__ 。
(4)丙烷在有氧气参与的条件下也可以发生脱氢反应:2CH3CH2CH3(g)+O2(g) 2CH3CH=CH2(g)+2H2O(g) △H=-235kJ·mol-1。相比丙烷的无氧脱氢反应,丙烷的有氧脱氢反应的优点可能有
2CH3CH=CH2(g)+2H2O(g) △H=-235kJ·mol-1。相比丙烷的无氧脱氢反应,丙烷的有氧脱氢反应的优点可能有__ 、__ 。
 CH3CH=CH2(g)+H2(g) △H。
CH3CH=CH2(g)+H2(g) △H。(1)科学家将最稳定的单质的标准生成焓规定为零。在温度为298.15K时由最稳定的单质生成1mol化合物时的焓变,叫做该物质的标准摩尔生成焓。部分物质的标准摩尔生成焓数据如表(单位:kJ·mol-1):
| CH3CH2CH3 | CH3CH=CH2 | H2 |
| -103.9 | 20.4 | 0 |
由此可求得△H=
(2)在一定条件下的体积为2L的密闭容器中投入1mol丙烷,体系的起始压强为P0kPa。反应过程中压强变化如表:
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 20 |
| 压强/kPa | P0 | 1.20P0 | 1.36P0 | 1.50P0 | 1.63P0 | 1.71P0 | 1.78P0 | 1.80P0 | 1.80P0 | 1.80P0 |
则反应前6分钟内用氢气的浓度表示的反应速率为
(3)如图中四条线对应的是(2)中在0.01kPa和0.1kPa下丙烷和丙烯在平衡体系中的体积分数随温度的变化情况。

某同学认为曲线b不可能表示丙烯的体积分数,请写出两条支持该观点的理由:①
(4)丙烷在有氧气参与的条件下也可以发生脱氢反应:2CH3CH2CH3(g)+O2(g)
 2CH3CH=CH2(g)+2H2O(g) △H=-235kJ·mol-1。相比丙烷的无氧脱氢反应,丙烷的有氧脱氢反应的优点可能有
2CH3CH=CH2(g)+2H2O(g) △H=-235kJ·mol-1。相比丙烷的无氧脱氢反应,丙烷的有氧脱氢反应的优点可能有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g) ⇌CH4(g)+2H2O(g)
水电解反应:2H2O(g)=2H2(g)+O2(g)
一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g) ⇌C(s)+2H2O(g) ΔH<0代替Sabatier反应,再电解水实现O2的循环利用。
回答下列问题:
(1)有关上述反应,下列说法正确的是_______ (填标号)。
A.室温下,2H2O(g) ⇌2H2(g)+O2(g)不能自发进行的原因为ΔS<0
B.可逆反应都有一定的限度,限度越大反应物的转化率一定越高
C.可逆反应中,若反应物的总能量>生成物的总能量,则ΔH<0
(2)在Sabatier反应[反应Ⅰ:CO2(g)+4H2(g) ⇌CH4(g)+2H2O(g) KⅠ]体系中,还会发生副反应(反应Ⅱ):CO2(g)+H2(g)⇌CO(g)+H2O(g) KⅡ;一定压强下,向某容积可变的密闭容器中通入CO2和H2的混合气体(其中CO2和H2的物质的量之比为1∶4),在某催化剂的作用下同时发生反应Ⅰ和反应Ⅱ,测得CO2的转化率、CH4的选择性、CO的选择性随反应温度的变化情况如图所示。
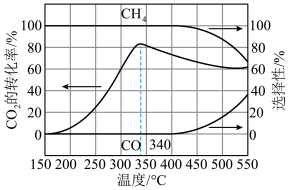
已知:CH4或CO的选择性指反应生成CH4或CO时所消耗的CO2的物质的量占参与反应的CO2总物质的量的百分比。相同温度下,反应2CO(g)+2H2(g)⇌CO2(g)+CH4(g)的平衡常数为_______ (用含KⅠ、KⅡ的式子表示);提高CH4的选择性的措施有_______ 。
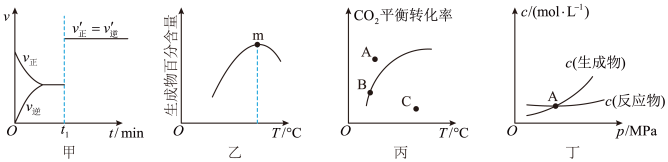
(3)对于Bosch反应CO2(g)+2H2(g)⇌C(s)+2H2O(g) ΔH<0,下列关于各图像的解释或得出的结论正确的是_______(填标号)。
(4)室温下,向体积为2L的恒容密闭容器中通入4molH2和1molCO2发生Sabatier反应:CO2(g)+4H2(g) CH4(g)+2H2O(g)(不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:
CH4(g)+2H2O(g)(不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:
①0~10min内,v(CO2)=_______ mol·L-1·min-1,该温度下Sabatier反应的Kp=_______ (Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)。
②Sabatier反应的速率方程:v正=k正c(CO2)c4(H2),v逆=k逆c(CH4)c2(H2O)(k是速率常数,只与温度有关)。反应达平衡时,升高温度,k正增大的倍数_______ k逆增大的倍数。(填“>”“<”或“=”)
Sabatier反应:CO2(g)+4H2(g) ⇌CH4(g)+2H2O(g)
水电解反应:2H2O(g)=2H2(g)+O2(g)
一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g) ⇌C(s)+2H2O(g) ΔH<0代替Sabatier反应,再电解水实现O2的循环利用。
回答下列问题:
(1)有关上述反应,下列说法正确的是
A.室温下,2H2O(g) ⇌2H2(g)+O2(g)不能自发进行的原因为ΔS<0
B.可逆反应都有一定的限度,限度越大反应物的转化率一定越高
C.可逆反应中,若反应物的总能量>生成物的总能量,则ΔH<0
(2)在Sabatier反应[反应Ⅰ:CO2(g)+4H2(g) ⇌CH4(g)+2H2O(g) KⅠ]体系中,还会发生副反应(反应Ⅱ):CO2(g)+H2(g)⇌CO(g)+H2O(g) KⅡ;一定压强下,向某容积可变的密闭容器中通入CO2和H2的混合气体(其中CO2和H2的物质的量之比为1∶4),在某催化剂的作用下同时发生反应Ⅰ和反应Ⅱ,测得CO2的转化率、CH4的选择性、CO的选择性随反应温度的变化情况如图所示。

已知:CH4或CO的选择性指反应生成CH4或CO时所消耗的CO2的物质的量占参与反应的CO2总物质的量的百分比。相同温度下,反应2CO(g)+2H2(g)⇌CO2(g)+CH4(g)的平衡常数为
(3)对于Bosch反应CO2(g)+2H2(g)⇌C(s)+2H2O(g) ΔH<0,下列关于各图像的解释或得出的结论正确的是_______(填标号)。

| A.由甲图可知,反应在t1min时可能改变了压强或使用了催化剂 |
| B.由乙图可知,反应在m点可能达到了平衡状态 |
| C.由丙图可知,反应过程中v正>v逆的点是C点 |
| D.由丁图可知,交点A表示的反应一定处于平衡状态 |
(4)室温下,向体积为2L的恒容密闭容器中通入4molH2和1molCO2发生Sabatier反应:CO2(g)+4H2(g)
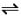 CH4(g)+2H2O(g)(不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:
CH4(g)+2H2O(g)(不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强 | 5.00p | 4.60p | 4.30p | 4.15p | 4.06p | 4.00p | 4.00p |
②Sabatier反应的速率方程:v正=k正c(CO2)c4(H2),v逆=k逆c(CH4)c2(H2O)(k是速率常数,只与温度有关)。反应达平衡时,升高温度,k正增大的倍数
您最近一年使用:0次



