名校
解题方法
1 . 甲烷和乙烯是重要的气体燃料和化工原料。回答下列问题:
(1)甲烷化反应即为氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。
已知涉及的反应如下:
反应Ⅰ: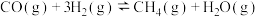
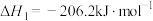
反应Ⅱ:

反应Ⅲ:
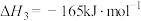
则
___________  。
。
(2)研究表明 和
和 在催化剂存在下可发生反应制得合成气
在催化剂存在下可发生反应制得合成气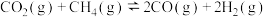
 。在其他条件相同,不同催化剂(A、B)作用下,使原料
。在其他条件相同,不同催化剂(A、B)作用下,使原料 和
和 反应相同的时间,CO(g)的产率随反应温度的变化如图所示:
反应相同的时间,CO(g)的产率随反应温度的变化如图所示:
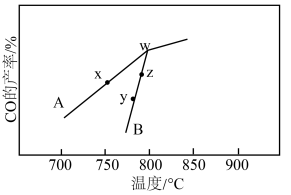
①在催化剂A.B作用下,它们正、逆反应活化能差值分别用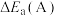 和
和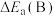 表示,则
表示,则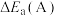
___________ 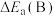 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②y点对应的逆反应速率v(逆)___________ z点对应的正反应速率v(正)(填“>”“<”或“=”)。
(3)西北工业大学的张健教授、德累斯顿工业大学的冯新亮院士等人报道了一种电催化半氢化策略,在室温条件下,水溶液介质中可选择性地将 还原为
还原为 ,其原理示意图如下:
,其原理示意图如下:

①阴极的电极反应式为___________ 。
②同温同压下,相同时间内,若进口处气体物质的量为amol,出口处气体的总体积为进口处的x倍,则 转化率为
转化率为___________ 。
(4)利用多晶铜高效催化电解 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。
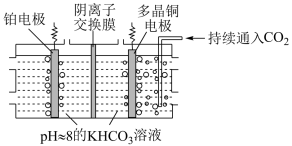
①电解过程中 向
向___________ (填“铂”或“多晶铜”)电极方向移动。
②多晶铜电极上的电极反应式为___________ 。
③理论上当生产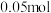 乙烯时,铂电极产生的气体在标况下体积为
乙烯时,铂电极产生的气体在标况下体积为___________ (不考虑气体的溶解)。
(1)甲烷化反应即为氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。
已知涉及的反应如下:
反应Ⅰ:
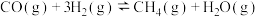
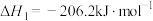
反应Ⅱ:


反应Ⅲ:

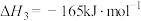
则

 。
。(2)研究表明
 和
和 在催化剂存在下可发生反应制得合成气
在催化剂存在下可发生反应制得合成气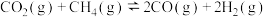
 。在其他条件相同,不同催化剂(A、B)作用下,使原料
。在其他条件相同,不同催化剂(A、B)作用下,使原料 和
和 反应相同的时间,CO(g)的产率随反应温度的变化如图所示:
反应相同的时间,CO(g)的产率随反应温度的变化如图所示:
①在催化剂A.B作用下,它们正、逆反应活化能差值分别用
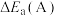 和
和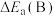 表示,则
表示,则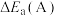
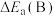 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②y点对应的逆反应速率v(逆)
(3)西北工业大学的张健教授、德累斯顿工业大学的冯新亮院士等人报道了一种电催化半氢化策略,在室温条件下,水溶液介质中可选择性地将
 还原为
还原为 ,其原理示意图如下:
,其原理示意图如下:
①阴极的电极反应式为
②同温同压下,相同时间内,若进口处气体物质的量为amol,出口处气体的总体积为进口处的x倍,则
 转化率为
转化率为(4)利用多晶铜高效催化电解
 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。
①电解过程中
 向
向②多晶铜电极上的电极反应式为
③理论上当生产
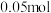 乙烯时,铂电极产生的气体在标况下体积为
乙烯时,铂电极产生的气体在标况下体积为
您最近一年使用:0次
2023-11-11更新
|
117次组卷
|
2卷引用:湖北省黄冈市蕲春县实验高级中学2024届高三一轮复习10月月考化学试题
名校
2 . 生产、生活中的化学反应都伴随能量的变化。回答下列问题:
(1) 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下:
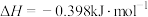 ,则常温下,
,则常温下, (单斜)与
(单斜)与 (斜方)中较稳定的是
(斜方)中较稳定的是___________ [填“ (单斜)”或“
(单斜)”或“ (斜方)”]。
(斜方)”]。
(2)下表中的数据表示断裂1mol化学键需消耗的能量(即键能,单位为kJ⋅mol ):
):
热化学方程式: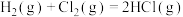
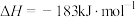 ,则
,则 键的键能为
键的键能为___________ kJ⋅mol 。
。
(3)标准状况下,6.72L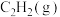 在
在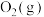 中完全燃烧生成
中完全燃烧生成 和
和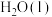 ,放出389.7kJ热量,请写出表示
,放出389.7kJ热量,请写出表示 标准燃烧热的热化学方程式:
标准燃烧热的热化学方程式:___________ 。
(4)已知: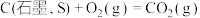
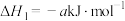 ;
;
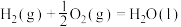
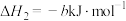 ;
;
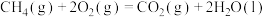
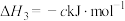 。
。
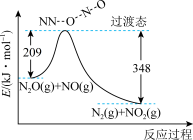
计算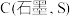 与
与 反应生成1mol
反应生成1mol 的
的 为
为___________ kJ·mol (用含
(用含 、
、 、
、 的式子表示)。
的式子表示)。
(5)由 和
和 反应生成
反应生成 和
和 的能量变化如图所示。则反应过程中,每生成2mol
的能量变化如图所示。则反应过程中,每生成2mol 理论上放出的热量为
理论上放出的热量为___________ 。
(6)由金红石( )制取单质
)制取单质 的步骤为
的步骤为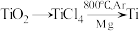 。
。
已知:Ⅰ.
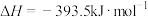
Ⅱ.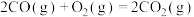
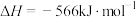
Ⅲ.
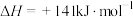
①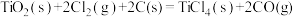 的
的
___________ 。
②反应 在
在 气氛中进行的理由是
气氛中进行的理由是___________ 。
(1)
 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下:
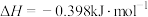 ,则常温下,
,则常温下, (单斜)与
(单斜)与 (斜方)中较稳定的是
(斜方)中较稳定的是 (单斜)”或“
(单斜)”或“ (斜方)”]。
(斜方)”]。(2)下表中的数据表示断裂1mol化学键需消耗的能量(即键能,单位为kJ⋅mol
 ):
):| 化学键 |  |  |
| 键能 | 436 | 431 |
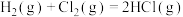
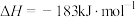 ,则
,则 键的键能为
键的键能为 。
。(3)标准状况下,6.72L
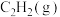 在
在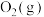 中完全燃烧生成
中完全燃烧生成 和
和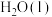 ,放出389.7kJ热量,请写出表示
,放出389.7kJ热量,请写出表示 标准燃烧热的热化学方程式:
标准燃烧热的热化学方程式:(4)已知:
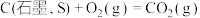
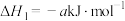 ;
;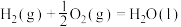
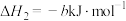 ;
;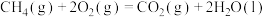
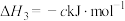 。
。计算
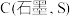 与
与 反应生成1mol
反应生成1mol 的
的 为
为 (用含
(用含 、
、 、
、 的式子表示)。
的式子表示)。(5)由
 和
和 反应生成
反应生成 和
和 的能量变化如图所示。则反应过程中,每生成2mol
的能量变化如图所示。则反应过程中,每生成2mol 理论上放出的热量为
理论上放出的热量为
(6)由金红石(
 )制取单质
)制取单质 的步骤为
的步骤为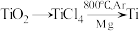 。
。已知:Ⅰ.

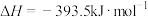
Ⅱ.
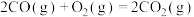
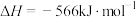
Ⅲ.

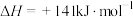
①
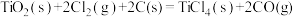 的
的
②反应
 在
在 气氛中进行的理由是
气氛中进行的理由是
您最近一年使用:0次
2023-11-02更新
|
151次组卷
|
4卷引用:湖北省鄂州市部分高中教科研协作体2023-2024学年高二上学期11月期中考试化学试题
名校
3 . 甲烷、甲醇(CH3OH)、甲醛(HCHO)等含有一个碳原子的物质称为“一碳”化合物,广泛应用于化工、医药、能源等方面,研究“一碳”化合物的化学称为“一碳”化学。
(1)已知:①CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41kJ/mol
CO(g)+H2O(g) △H1=+41kJ/mol
②CO(g)+2H2(g) CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
根据盖斯定律,反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的△H=
CH3OH(g)+H2O(g)的△H=________ kJ•mol-l。
(2)工业上合成甲醇的反应:CO(g)+2H2(g)
 CH3OH(g),在一个密闭容器中,充入1molCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图所示。
CH3OH(g),在一个密闭容器中,充入1molCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图所示。
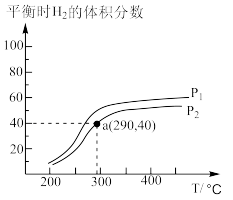
压强P1_____ P2(填“大于”或“小于”),290℃时Kp=________ 。(Kp用气体分压代替气体浓度进行计算,分压=总压×气体的物质的量分数)。
该反应达到平衡的标志是______ (填标号)。
a.反应速率v正(H2)=2v逆(CH3OH) b.容器内CO和H2物质的量之比为1:2
c.混合气体的质量不再变化 d.混合气体的平均摩尔质量不再变化
(3)我国科学家制备了一种ZnO-ZrO2催化剂,实现CO2高选择性合成CH3OH。气相催化合成过程中,CO2转化率(x)及CH3OH选择性(s)随温度的变化曲线如图。据此回答:
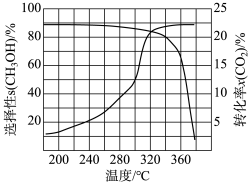
①生成CH3OH的最佳温度约为________ 。
②温度升高,CO2转化率升高,但产物CH3OH含量降低的原因:________ 。
(4)对于气体参与的反应如反应④[2CH3OH(g)
 C2H4(g)+2H2O(g) △H<0],可以用某组分的压强(Pa)变化来表示化学反应速率,在温度和体积不变的密闭容器中充入一定量的CH3OH气体发生反应④,该反应的速率方程式为v正=k正•p2(CH3OH),v逆=k逆•p2(H2O)p(C2H4),k正、k逆表示速率常数,与温度、活化能有关。升高温度,k正的变化程度
C2H4(g)+2H2O(g) △H<0],可以用某组分的压强(Pa)变化来表示化学反应速率,在温度和体积不变的密闭容器中充入一定量的CH3OH气体发生反应④,该反应的速率方程式为v正=k正•p2(CH3OH),v逆=k逆•p2(H2O)p(C2H4),k正、k逆表示速率常数,与温度、活化能有关。升高温度,k正的变化程度_______ (填“大于”、“小于”或“等于”)k逆的变化程度。
(1)已知:①CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41kJ/mol
CO(g)+H2O(g) △H1=+41kJ/mol②CO(g)+2H2(g)
 CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol根据盖斯定律,反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)的△H=
CH3OH(g)+H2O(g)的△H=(2)工业上合成甲醇的反应:CO(g)+2H2(g)
 CH3OH(g),在一个密闭容器中,充入1molCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图所示。
CH3OH(g),在一个密闭容器中,充入1molCO和2molH2发生反应,测得平衡时H2的体积分数与温度、压强的关系如图所示。
压强P1
该反应达到平衡的标志是
a.反应速率v正(H2)=2v逆(CH3OH) b.容器内CO和H2物质的量之比为1:2
c.混合气体的质量不再变化 d.混合气体的平均摩尔质量不再变化
(3)我国科学家制备了一种ZnO-ZrO2催化剂,实现CO2高选择性合成CH3OH。气相催化合成过程中,CO2转化率(x)及CH3OH选择性(s)随温度的变化曲线如图。据此回答:

①生成CH3OH的最佳温度约为
②温度升高,CO2转化率升高,但产物CH3OH含量降低的原因:
(4)对于气体参与的反应如反应④[2CH3OH(g)
 C2H4(g)+2H2O(g) △H<0],可以用某组分的压强(Pa)变化来表示化学反应速率,在温度和体积不变的密闭容器中充入一定量的CH3OH气体发生反应④,该反应的速率方程式为v正=k正•p2(CH3OH),v逆=k逆•p2(H2O)p(C2H4),k正、k逆表示速率常数,与温度、活化能有关。升高温度,k正的变化程度
C2H4(g)+2H2O(g) △H<0],可以用某组分的压强(Pa)变化来表示化学反应速率,在温度和体积不变的密闭容器中充入一定量的CH3OH气体发生反应④,该反应的速率方程式为v正=k正•p2(CH3OH),v逆=k逆•p2(H2O)p(C2H4),k正、k逆表示速率常数,与温度、活化能有关。升高温度,k正的变化程度
您最近一年使用:0次
名校
解题方法
4 . 处理、回收CO是环境科学家研究的热点课题。
(1)环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
已知:①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K= ,写出此反应的热化学方程式:
,写出此反应的热化学方程式:___________ 。
(2)CO用于处理大气污染物N2O所发生的反应为N2O(g)+CO(g) CO2(g)+N2(g) ΔH=-365 kJ·mol-1,几种物质的相对能量如下:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1,几种物质的相对能量如下:
①a=___________ kJ·mol-1,改变下列“量”,一定会引起ΔH发生变化的是___________ (填代号)
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
②有人提出上述反应可以用“Fe+”作催化剂。其总反应分两步进行:
第一步:___________ ;(写化学方程式)
第二步:FeO++CO=Fe++CO2。
(3)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5 (s)+5CO(g) 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。___________ 。
②在此温度下,该可逆反应的平衡常数K=___________ (用含x的代数式表示)。
(4)工业上,利用CO和H2合成CH3OH,在1 L恒容密闭容器中充入1 mol CO(g)和n mol H2,在250 ℃发生反应:CO(g)+2H2(g) CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是
CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___________ 。
(1)环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
已知:①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K=
 ,写出此反应的热化学方程式:
,写出此反应的热化学方程式:(2)CO用于处理大气污染物N2O所发生的反应为N2O(g)+CO(g)
 CO2(g)+N2(g) ΔH=-365 kJ·mol-1,几种物质的相对能量如下:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1,几种物质的相对能量如下:| 物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
| 相对能量/kJ·mol-1 | 475.5 | 283 | a | 393.5 |
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
②有人提出上述反应可以用“Fe+”作催化剂。其总反应分两步进行:
第一步:
第二步:FeO++CO=Fe++CO2。
(3)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5 (s)+5CO(g)
 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。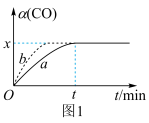
②在此温度下,该可逆反应的平衡常数K=
(4)工业上,利用CO和H2合成CH3OH,在1 L恒容密闭容器中充入1 mol CO(g)和n mol H2,在250 ℃发生反应:CO(g)+2H2(g)
 CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是
CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是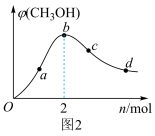
您最近一年使用:0次
2023-10-26更新
|
187次组卷
|
3卷引用:湖北省武汉市第四中学2023-2024学年高二上学期10月月考化学试题
解题方法
5 .  为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有
为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有 气体生。
气体生。 脱硫技术是当前的重点研究方向。回答下列问题:
脱硫技术是当前的重点研究方向。回答下列问题:
(1)1883年英国化学家Claus开发了 氧化制硫的方法,即:
氧化制硫的方法,即:
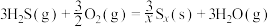
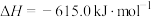
20世纪30年代,德国法本公司将 的氧化分两阶段完成。
的氧化分两阶段完成。
第一阶段反应为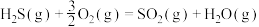
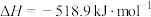
则第二阶段反应

___________  。
。
(2)氧化锌法也是一种传统的脱硫方法,其反应原理如下:
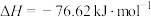
 。据此判断,该反应的△G
。据此判断,该反应的△G___________ 0(填“>”“<”或“=”)。文献资料显示,氧化锌法反应温度控制在300~400℃,工业上这么做的理由为___________ 。
(3)栲胶法是我国本土自主研发和发展起来的湿法氧化脱硫方法,其原理如下(其中,TQ为醌态栲胶;THQ为酚态栲胶):
脱硫过程:



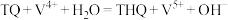
再生过程:
①基态钒原子的价电子排布式为___________ 。
②根据栲胶法原理,脱硫过程中起到催化作用的物质为___________ 。
(4)在密闭容器中, 气体分解生成
气体分解生成 和
和 (g)的平衡转化率与温度、压强的关系如下图所示:
(g)的平衡转化率与温度、压强的关系如下图所示:
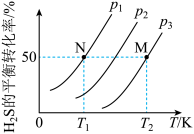
①图中压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ 。
②初始量相同的 分别在
分别在 和
和 、温度
、温度 和
和 下各自达到平衡,则N点和M点的压强平衡常数
下各自达到平衡,则N点和M点的压强平衡常数 之比
之比
___________ 。
 为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有
为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有 气体生。
气体生。 脱硫技术是当前的重点研究方向。回答下列问题:
脱硫技术是当前的重点研究方向。回答下列问题:(1)1883年英国化学家Claus开发了
 氧化制硫的方法,即:
氧化制硫的方法,即: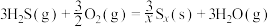
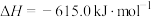
20世纪30年代,德国法本公司将
 的氧化分两阶段完成。
的氧化分两阶段完成。第一阶段反应为
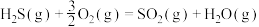
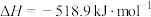
则第二阶段反应


 。
。(2)氧化锌法也是一种传统的脱硫方法,其反应原理如下:

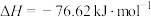
 。据此判断,该反应的△G
。据此判断,该反应的△G(3)栲胶法是我国本土自主研发和发展起来的湿法氧化脱硫方法,其原理如下(其中,TQ为醌态栲胶;THQ为酚态栲胶):
脱硫过程:



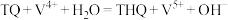
再生过程:

①基态钒原子的价电子排布式为
②根据栲胶法原理,脱硫过程中起到催化作用的物质为
(4)在密闭容器中,
 气体分解生成
气体分解生成 和
和 (g)的平衡转化率与温度、压强的关系如下图所示:
(g)的平衡转化率与温度、压强的关系如下图所示:
①图中压强
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②初始量相同的
 分别在
分别在 和
和 、温度
、温度 和
和 下各自达到平衡,则N点和M点的压强平衡常数
下各自达到平衡,则N点和M点的压强平衡常数 之比
之比
您最近一年使用:0次
2023-10-25更新
|
158次组卷
|
2卷引用:湖北省腾云联盟2023-2024学年高三上学期10月联考化学试题
6 . 宇宙中随时伴随能量变化,研究化学反应能量变化意义重大。
(1)杭州亚运会首次使用废碳( )绿色循环再生技术合成的零碳甲醇(
)绿色循环再生技术合成的零碳甲醇( )燃料作为主火炬燃料,是对绿色亚运的美好诠释。
)燃料作为主火炬燃料,是对绿色亚运的美好诠释。
①下列有关零碳甲醇作主火炬燃料的优势说法正确的是___________ ;
A.环保,燃烧高效,可实现循环内零排放
B.安全,不易爆炸,储存运输安全便捷
C.可靠,持续燃烧,极端天气不易熄灭
D.经济,废碳再生,燃料成本低
E.可视,火焰亮丽稳定
②已知:反应Ⅰ:
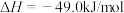
反应Ⅱ: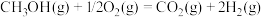
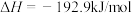
过程Ⅲ:
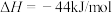
表示甲醇蒸汽燃烧热的热化学方程式为___________ 。
(2)取 的
的 溶液
溶液 与
与 硫酸溶液
硫酸溶液 置于如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
置于如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
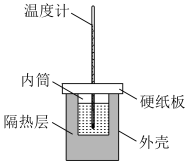
①从图中实验装置看,其中缺少的一种玻璃仪器是___________ ;
②四次实验数据如下,表中温差平均值为___________ ℃
若
 溶液和
溶液和 硫酸溶液的密度都是
硫酸溶液的密度都是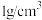 ,反应后生成的溶液比热容
,反应后生成的溶液比热容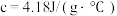 ,则中和反应反应热
,则中和反应反应热
___________ (结果保留小数点后1位)。
③实验中若分几次加入

 溶液,所测中和热
溶液,所测中和热
___________ (填“偏大”、“偏小”或“不变”)。
(3)在催化剂存在下,反应 可表示为如图所示:
可表示为如图所示:
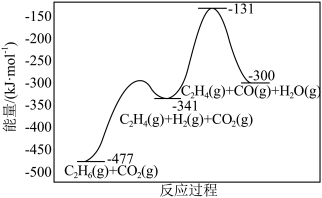
该反应的
___________ 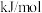 ,包含
,包含___________ 个基元反应。
(1)杭州亚运会首次使用废碳(
 )绿色循环再生技术合成的零碳甲醇(
)绿色循环再生技术合成的零碳甲醇( )燃料作为主火炬燃料,是对绿色亚运的美好诠释。
)燃料作为主火炬燃料,是对绿色亚运的美好诠释。①下列有关零碳甲醇作主火炬燃料的优势说法正确的是
A.环保,燃烧高效,可实现循环内零排放
B.安全,不易爆炸,储存运输安全便捷
C.可靠,持续燃烧,极端天气不易熄灭
D.经济,废碳再生,燃料成本低
E.可视,火焰亮丽稳定
②已知:反应Ⅰ:

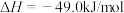
反应Ⅱ:
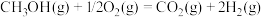
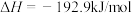
过程Ⅲ:

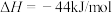
表示甲醇蒸汽燃烧热的热化学方程式为
(2)取
 的
的 溶液
溶液 与
与 硫酸溶液
硫酸溶液 置于如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
置于如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
①从图中实验装置看,其中缺少的一种玻璃仪器是
②四次实验数据如下,表中温差平均值为
| 实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温差平均值/℃ | ||
| 硫酸溶液 |  溶液 溶液 | 反应前温度 | |||
| 1 | 26.2 | 26.6 | 26.4 | 29.9 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.3 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.6 | |

 溶液和
溶液和 硫酸溶液的密度都是
硫酸溶液的密度都是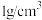 ,反应后生成的溶液比热容
,反应后生成的溶液比热容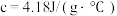 ,则中和反应反应热
,则中和反应反应热
③实验中若分几次加入


 溶液,所测中和热
溶液,所测中和热
(3)在催化剂存在下,反应
 可表示为如图所示:
可表示为如图所示:
该反应的

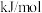 ,包含
,包含
您最近一年使用:0次
解题方法
7 .  转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将
转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将 转化为各种化工原料。
转化为各种化工原料。
Ⅰ.早在二十世纪初,工业上以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:①
为原料在一定温度和压强下合成尿素。反应分两步:① 和
和 生成
生成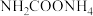 ;②
;②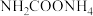 分解生成尿素。
分解生成尿素。
(1)活化能:反应①___________ 反应②(填“>”、“<” 或“二”);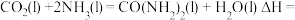
___________ (用含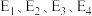 的式子表示)。
的式子表示)。
Ⅱ.我国科学家研究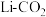 电池,取得了重大科研成果。
电池,取得了重大科研成果。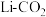 电池中,反应产物为
电池中,反应产物为 ;和单质碳,正极
;和单质碳,正极 电还原后与锂离子结合形成
电还原后与锂离子结合形成 按以下4个步骤进行,
按以下4个步骤进行,
①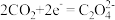 ;
;
②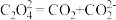 ;
;
③___________;
④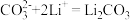
(2)写出步骤③中 与
与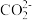 反应的离子方程式
反应的离子方程式___________ 。
Ⅲ.利用 和
和 重整技术可获得合成气(主要成分为
重整技术可获得合成气(主要成分为 ,
, ),重整过程中反应的热化学方程式如下:
),重整过程中反应的热化学方程式如下:
反应i:

反应ii: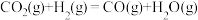
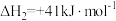
不同配比随温度变化对出口合成气中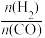 的影响如下图所示
的影响如下图所示
(3)对于反应i,试比较 点和
点和 点
点 的转化率:
的转化率:
___________  (填“>"、“<"或“=”下同);平衡常数
(填“>"、“<"或“=”下同);平衡常数
___________  ,当
,当 一定,有利于提高
一定,有利于提高 平衡转化率的反应条件是
平衡转化率的反应条件是___________ (填序号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(4)当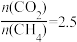 ,温度高于900℃,
,温度高于900℃,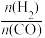 减小的原因可能是
减小的原因可能是___________ 。
(5)在930℃、101kPa时, 按投料比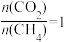 加入刚性密闭容器中,达平衡时,测得
加入刚性密闭容器中,达平衡时,测得 的转化率为90%,
的转化率为90%, 的转化率为95%,试计算反应ii的压强平衡常数
的转化率为95%,试计算反应ii的压强平衡常数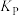 =
=___________ (计算结果保留3位有效数字,用平衡分压代替平衡浓度,分压=总压×物质的量分数)
 转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将
转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将 转化为各种化工原料。
转化为各种化工原料。Ⅰ.早在二十世纪初,工业上以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:①
为原料在一定温度和压强下合成尿素。反应分两步:① 和
和 生成
生成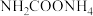 ;②
;②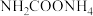 分解生成尿素。
分解生成尿素。
(1)活化能:反应①
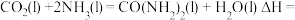
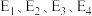 的式子表示)。
的式子表示)。Ⅱ.我国科学家研究
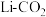 电池,取得了重大科研成果。
电池,取得了重大科研成果。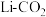 电池中,反应产物为
电池中,反应产物为 ;和单质碳,正极
;和单质碳,正极 电还原后与锂离子结合形成
电还原后与锂离子结合形成 按以下4个步骤进行,
按以下4个步骤进行,①
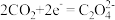 ;
;②
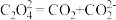 ;
;③___________;
④
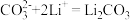
(2)写出步骤③中
 与
与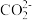 反应的离子方程式
反应的离子方程式Ⅲ.利用
 和
和 重整技术可获得合成气(主要成分为
重整技术可获得合成气(主要成分为 ,
, ),重整过程中反应的热化学方程式如下:
),重整过程中反应的热化学方程式如下:反应i:


反应ii:
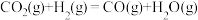
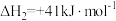
不同配比随温度变化对出口合成气中
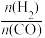 的影响如下图所示
的影响如下图所示
(3)对于反应i,试比较
 点和
点和 点
点 的转化率:
的转化率:
 (填“>"、“<"或“=”下同);平衡常数
(填“>"、“<"或“=”下同);平衡常数
 ,当
,当 一定,有利于提高
一定,有利于提高 平衡转化率的反应条件是
平衡转化率的反应条件是A.高温高压 B.高温低压 C.低温高压 D.低温低压
(4)当
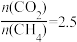 ,温度高于900℃,
,温度高于900℃,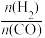 减小的原因可能是
减小的原因可能是(5)在930℃、101kPa时, 按投料比
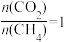 加入刚性密闭容器中,达平衡时,测得
加入刚性密闭容器中,达平衡时,测得 的转化率为90%,
的转化率为90%, 的转化率为95%,试计算反应ii的压强平衡常数
的转化率为95%,试计算反应ii的压强平衡常数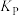 =
=
您最近一年使用:0次
解题方法
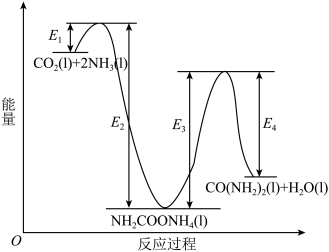
8 . 氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。
已知:Ⅰ.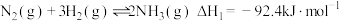
Ⅱ.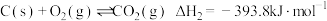
Ⅲ.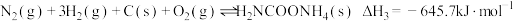
回答下列问题:
(1) 分子中含有键
分子中含有键___________ (填“极性”或“非极性”),写出二氧化碳的电子式___________ 。
(2)写出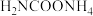 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:___________ 。
(3)在一定温度下,向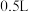 密闭容器中,加入
密闭容器中,加入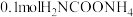 ,实验测得
,实验测得 物质的量变化如下表所示:
物质的量变化如下表所示:
从反应开始到2min,用 的浓度变化表示的化学反应速率为
的浓度变化表示的化学反应速率为___________ ;平衡后,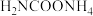 的转化率为
的转化率为___________ 。
(4)若在恒温恒压条件下进行反应,下列能够说明该反应已达到化学平衡状态的是___________。
(5)对该反应,改变某一条件,对化学反应速率的影响及解释不正确的是___________ 。
A.升高温度,使单位体积内活化分子百分数增加,反应速率加快
B.增加反应物的量,使活化分子百分数增加,有效碰撞增多,反应速率加快
C.使用催化剂能降低反应活化能,使单位体积内活化分子百分数增加,反应速率加快
已知:Ⅰ.
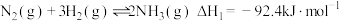
Ⅱ.
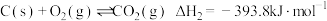
Ⅲ.
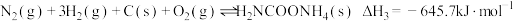
回答下列问题:
(1)
 分子中含有键
分子中含有键(2)写出
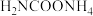 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:(3)在一定温度下,向
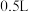 密闭容器中,加入
密闭容器中,加入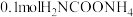 ,实验测得
,实验测得 物质的量变化如下表所示:
物质的量变化如下表所示: | 0 | 1 | 2 | 3 | 4 |
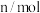 | 0 | a | b | c | c |
 的浓度变化表示的化学反应速率为
的浓度变化表示的化学反应速率为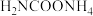 的转化率为
的转化率为(4)若在恒温恒压条件下进行反应,下列能够说明该反应已达到化学平衡状态的是___________。
A. 的浓度不再改变 的浓度不再改变 | B.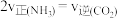 |
| C.容器体积不再改变 | D.容器内密度不再改变 |
A.升高温度,使单位体积内活化分子百分数增加,反应速率加快
B.增加反应物的量,使活化分子百分数增加,有效碰撞增多,反应速率加快
C.使用催化剂能降低反应活化能,使单位体积内活化分子百分数增加,反应速率加快
您最近一年使用:0次
名校
解题方法
9 . 已知存在下列热化学方程式:
①氢气燃烧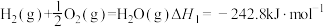
②太阳光分解水制氢气2H2O(l)=2H2(g)+O2(g) ΔH2=+571.6kJ·mol−1
③液态水转化为水蒸气H2O(l)=H2O(g) ΔH3=_____kJ·mol−1
回答下列问题:
(1)从能量转化角度分析,反应①为_____ 反应(填“吸热”或“放热”)。
(2)若在反应②中使用催化剂,ΔH2_____ (填“增大”“减小”或“不变”)。
(3)写出反应③的热化学方程式_____ 。
(4)有机物M经过太阳光光照可转化成N,转化过程如下。
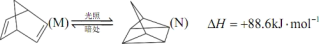
则M的化学式为_____ ,M、N相比,较稳定的是_____ (填“M”或“N”)。
(5)已知CH3OH(l)的燃烧热为238.6kJmol1,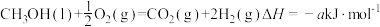 ,则a
,则a_____ 238.6(填“>”“<”或“=”)。
(6)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:_____ 。
(7)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,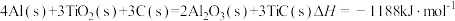 ,则反应过程中,每转移1mol电子时放出的热量为
,则反应过程中,每转移1mol电子时放出的热量为_____ 。
(8)已知:
①
②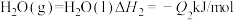
③ (
(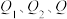 均大于0)
均大于0)
若要使32g液态甲醇完全燃烧,则最后恢复到室温,放出的热量为_____ kJ。
①氢气燃烧
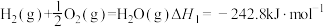
②太阳光分解水制氢气2H2O(l)=2H2(g)+O2(g) ΔH2=+571.6kJ·mol−1
③液态水转化为水蒸气H2O(l)=H2O(g) ΔH3=_____kJ·mol−1
回答下列问题:
(1)从能量转化角度分析,反应①为
(2)若在反应②中使用催化剂,ΔH2
(3)写出反应③的热化学方程式
(4)有机物M经过太阳光光照可转化成N,转化过程如下。

则M的化学式为
(5)已知CH3OH(l)的燃烧热为238.6kJmol1,
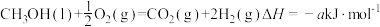 ,则a
,则a(6)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:
(7)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
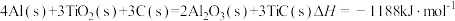 ,则反应过程中,每转移1mol电子时放出的热量为
,则反应过程中,每转移1mol电子时放出的热量为(8)已知:
①

②
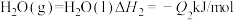
③
 (
( 均大于0)
均大于0)若要使32g液态甲醇完全燃烧,则最后恢复到室温,放出的热量为
您最近一年使用:0次
名校
10 . 2021年以来,全国十六个省市将氢能源写入“十四五”规划中,氢能是助力“碳达峰、碳中和”战略目标实现的重要新能源,以CH4为原料制H2具有广阔的应用前景。在一定条件下CH4与CO2催化重整制 涉及以下反应:
涉及以下反应:
主反应:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1=+248 kJ·mol-1
2CO(g)+2H2(g) △H1=+248 kJ·mol-1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41 kJ·mol-1
CO(g)+H2O(g) △H2=+41 kJ·mol-1
(1)写出CH4与H2O反应生成CO和H2的热化学方程式___________ 。
(2)我国学者模拟主反应重整制H2,研究在Pt-Ni合金和Sn-Ni合金催化下。甲烷逐级脱氢的反应。不同催化剂的甲烷脱氢反应历程与相对能量关系如图所示(*表示吸附在催化剂表面的物质,吸附过程产生的能量称为吸附能)。
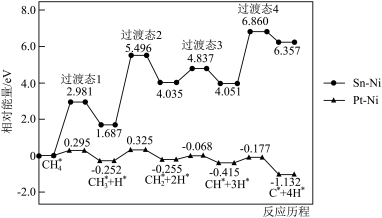
使用Sn-Ni合金作为催化剂的历程中最大能垒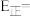
___________ eV;脱氢反应阶段选择Pt-Ni合金作为催化剂效果更好,理由是___________ 。
(3)恒压P0条件下,CO2与CH4以等物质的量投料进行催化重整实验,CO2和CH4的平衡转化率随温度的变化曲线如图所示。

①曲线___________ (填“A”或“B”)表示CO2的平衡转化率。
②X点的速率:v(正)___________ v(逆)(填“>”“<”或“=”)。
③800 K时,主反应的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)科学家研发出一种新系统,通过“溶解”水中的CO2触发电化学反应,该装置可有效减少碳的排放,并得到氢能源,其工作原理如图所示。则生成H2的电极反应式为___________ 。
 涉及以下反应:
涉及以下反应:主反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1=+248 kJ·mol-1
2CO(g)+2H2(g) △H1=+248 kJ·mol-1副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41 kJ·mol-1
CO(g)+H2O(g) △H2=+41 kJ·mol-1(1)写出CH4与H2O反应生成CO和H2的热化学方程式
(2)我国学者模拟主反应重整制H2,研究在Pt-Ni合金和Sn-Ni合金催化下。甲烷逐级脱氢的反应。不同催化剂的甲烷脱氢反应历程与相对能量关系如图所示(*表示吸附在催化剂表面的物质,吸附过程产生的能量称为吸附能)。

使用Sn-Ni合金作为催化剂的历程中最大能垒
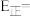
(3)恒压P0条件下,CO2与CH4以等物质的量投料进行催化重整实验,CO2和CH4的平衡转化率随温度的变化曲线如图所示。

①曲线
②X点的速率:v(正)
③800 K时,主反应的平衡常数Kp=
(4)科学家研发出一种新系统,通过“溶解”水中的CO2触发电化学反应,该装置可有效减少碳的排放,并得到氢能源,其工作原理如图所示。则生成H2的电极反应式为

您最近一年使用:0次



