名校
1 . (Ⅰ)铬及其化合物在催化、金属防腐等方面具有重要应用。 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为___ (列式表示)。
(2)该反应
_______ 0(填“>”或“=”或“<”)。
(Ⅱ)2022年11月29日23时08分,我国在酒泉卫星发射中心使用长征二号F遥十五火箭,成功将神舟十五号载人飞船发射升空,是空间站建造阶段最后一次载人飞行任务。
(3)火箭发射时可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。已知:①
和水蒸气。已知:①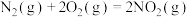
 kJ/mol②
kJ/mol②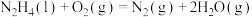
 kJ/mol请写出
kJ/mol请写出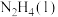 与
与 反应的热化学方程式
反应的热化学方程式_______ 。③
 ,
, 与
与 进行大小比较:
进行大小比较:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)二甲醚( )是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和
)是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和 合成二甲醚的反应为:
合成二甲醚的反应为:
 kJ/mol。
kJ/mol。
①改变下列“量”,一定会引起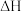 发生变化的是
发生变化的是_______ (填代号)。
a.化学计量数 b.反应物浓度 c.催化剂
②采用新型催化剂(主要成分是Cu-Mn的合金)制备二甲醚。催化剂中 对合成二甲醚的影响情况如下图所示。当
对合成二甲醚的影响情况如下图所示。当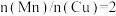 时,二甲醚的选择性(选择性
时,二甲醚的选择性(选择性 )为85.8%,此时二甲醚的产率为
)为85.8%,此时二甲醚的产率为_______ 。(保留3位有效数字)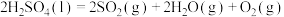
 kJ·mol
kJ·mol
反应III:
 kJ·mol
kJ·mol
在反应Ⅱ中,若标准状况下有33.6 L 气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为
气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为______ kJ。
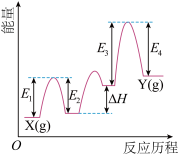
 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为(2)该反应

(Ⅱ)2022年11月29日23时08分,我国在酒泉卫星发射中心使用长征二号F遥十五火箭,成功将神舟十五号载人飞船发射升空,是空间站建造阶段最后一次载人飞行任务。
(3)火箭发射时可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。已知:①
和水蒸气。已知:①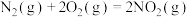
 kJ/mol②
kJ/mol②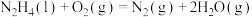
 kJ/mol请写出
kJ/mol请写出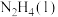 与
与 反应的热化学方程式
反应的热化学方程式
 ,
, 与
与 进行大小比较:
进行大小比较:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)二甲醚(
 )是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和
)是一种新型能源,被誉为“21世纪的清洁燃料”。用CO和 合成二甲醚的反应为:
合成二甲醚的反应为:
 kJ/mol。
kJ/mol。①改变下列“量”,一定会引起
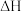 发生变化的是
发生变化的是a.化学计量数 b.反应物浓度 c.催化剂
②采用新型催化剂(主要成分是Cu-Mn的合金)制备二甲醚。催化剂中
 对合成二甲醚的影响情况如下图所示。当
对合成二甲醚的影响情况如下图所示。当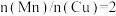 时,二甲醚的选择性(选择性
时,二甲醚的选择性(选择性 )为85.8%,此时二甲醚的产率为
)为85.8%,此时二甲醚的产率为 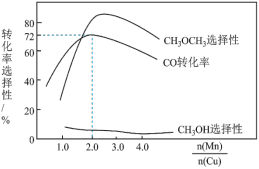
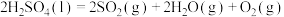
 kJ·mol
kJ·mol
反应III:

 kJ·mol
kJ·mol
在反应Ⅱ中,若标准状况下有33.6 L
 气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为
气体与水蒸气完全反应生成液态硫酸和固态硫单质,则放出的热量为
您最近一年使用:0次
名校
解题方法
2 . 完成下列问题
Ⅰ.氨是重要的化工原料,已知NH3(g)在纯氧中燃烧的能量变化如图。

(1)已知: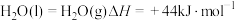 ,则NH3(g)的燃烧热的热化学方程式为
,则NH3(g)的燃烧热的热化学方程式为_______ 。
Ⅱ.火箭推进器中装有肼(N2H4)和过氧化氢。已知下列各物质反应的热化学方程式:
①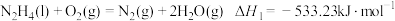
②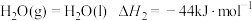
③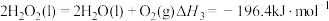
(2)以下选项中,是氮原子激发态的电子排布式,且其中能量较高的是_______ 。(填标号)
a.1s22s22p23s1 b.ls22s22p43d2 c.1s22s12p5 d.1s22s22p13p2
(3)N2H4晶体的晶胞结构_______ (填“是”或者“不”)符合分子密堆积,原因是_______ 。
(4)16g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出热量为:_______ (保留小数点后一位有效数字)。
(5)在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量之比为3∶2,则该分解反应的化学方程式为_______ 。
(6)有以下物质:①碘、②金刚砂、③氨气、④氯化钠、⑤水晶、⑥肼,它们的熔点由高到低的顺序为_______ (用序号表示)。
Ⅰ.氨是重要的化工原料,已知NH3(g)在纯氧中燃烧的能量变化如图。

(1)已知:
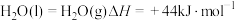 ,则NH3(g)的燃烧热的热化学方程式为
,则NH3(g)的燃烧热的热化学方程式为Ⅱ.火箭推进器中装有肼(N2H4)和过氧化氢。已知下列各物质反应的热化学方程式:
①
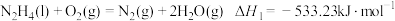
②
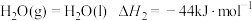
③
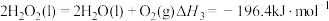
(2)以下选项中,是氮原子激发态的电子排布式,且其中能量较高的是
a.1s22s22p23s1 b.ls22s22p43d2 c.1s22s12p5 d.1s22s22p13p2
(3)N2H4晶体的晶胞结构
(4)16g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出热量为:
(5)在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量之比为3∶2,则该分解反应的化学方程式为
(6)有以下物质:①碘、②金刚砂、③氨气、④氯化钠、⑤水晶、⑥肼,它们的熔点由高到低的顺序为
您最近一年使用:0次
3 . 乙醇汽油是一种由粮食及各种植物纤维加工成的燃料乙醇和普通汽油按一定比例混配形成的替代能源。在汽油中加入适量乙醇作为汽车燃料,可节省石油资源,减少汽车尾气对空气的污染,还可促进农业的生产。
(1)已知:①某些常见化学键的键能(常温常压下,1 mol理想气体分子AB断裂为中性气态原子A和B所需要的能量或A、B合成理想气体分子所放出的能量)数据如下:
②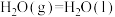
 ;
;
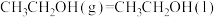
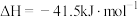 。
。
则表示乙醇燃烧热的热化学方程式为__________ 。
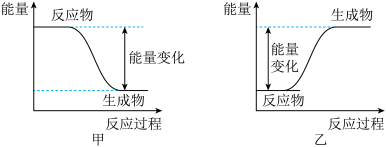
(2)下列能正确表示乙醇燃烧的能量变化图为图__________ (填“甲”或“乙”)。
(3) 加氢也可以制备乙醇,反应的化学方程式为
加氢也可以制备乙醇,反应的化学方程式为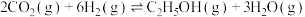 。在一定温度下,将
。在一定温度下,将 和
和 放入2 L恒容密闭容器中,5min时反应达到平衡,此时
放入2 L恒容密闭容器中,5min时反应达到平衡,此时 的体积分数为
的体积分数为 。
。
①下列条件能判断该反应达到化学平衡状态的是______ (填标号)。
a. b.
b. 的消耗速率是
的消耗速率是 的生成速率的3倍
的生成速率的3倍
c.容器中气体的平均摩尔质量不变 d. 的百分含量保持不变
的百分含量保持不变
②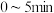 内,
内, 为
为__________  ,
, 为
为__________  。
。
③平衡时, 的转化率为
的转化率为__________  。
。
④平衡时的压强为起始压强的__________ 倍。
(4)汽油的主要成分为 脂肪烃和环烷烃类,以及一定量芳香烃,汽油具有较高的辛烷值(抗爆震燃烧性能),并按辛烷值的高低分为90号、93号、95号、97号等标号。已知辛烷的燃烧热
脂肪烃和环烷烃类,以及一定量芳香烃,汽油具有较高的辛烷值(抗爆震燃烧性能),并按辛烷值的高低分为90号、93号、95号、97号等标号。已知辛烷的燃烧热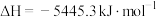 ,则燃烧相同质量的乙醇和辛烷,放热多的是
,则燃烧相同质量的乙醇和辛烷,放热多的是__________ (填名称)。
(1)已知:①某些常见化学键的键能(常温常压下,1 mol理想气体分子AB断裂为中性气态原子A和B所需要的能量或A、B合成理想气体分子所放出的能量)数据如下:
| 化学键 | 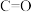 | H—O | C—O | C—H | 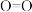 | C—C |
键能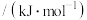 | 803 | 463 | 351 | 414 | 498 | 348 |
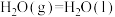
 ;
;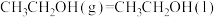
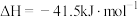 。
。则表示乙醇燃烧热的热化学方程式为
(2)下列能正确表示乙醇燃烧的能量变化图为图

(3)
 加氢也可以制备乙醇,反应的化学方程式为
加氢也可以制备乙醇,反应的化学方程式为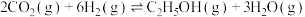 。在一定温度下,将
。在一定温度下,将 和
和 放入2 L恒容密闭容器中,5min时反应达到平衡,此时
放入2 L恒容密闭容器中,5min时反应达到平衡,此时 的体积分数为
的体积分数为 。
。①下列条件能判断该反应达到化学平衡状态的是
a.
 b.
b. 的消耗速率是
的消耗速率是 的生成速率的3倍
的生成速率的3倍c.容器中气体的平均摩尔质量不变 d.
 的百分含量保持不变
的百分含量保持不变②
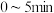 内,
内, 为
为 ,
, 为
为 。
。③平衡时,
 的转化率为
的转化率为 。
。④平衡时的压强为起始压强的
(4)汽油的主要成分为
 脂肪烃和环烷烃类,以及一定量芳香烃,汽油具有较高的辛烷值(抗爆震燃烧性能),并按辛烷值的高低分为90号、93号、95号、97号等标号。已知辛烷的燃烧热
脂肪烃和环烷烃类,以及一定量芳香烃,汽油具有较高的辛烷值(抗爆震燃烧性能),并按辛烷值的高低分为90号、93号、95号、97号等标号。已知辛烷的燃烧热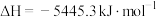 ,则燃烧相同质量的乙醇和辛烷,放热多的是
,则燃烧相同质量的乙醇和辛烷,放热多的是
您最近一年使用:0次
解题方法
4 . 硫及其化合物之间的转化具有重要意义。回答下列问题:
(1)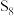 分子可形成单斜硫和斜方硫,其转化过程为
分子可形成单斜硫和斜方硫,其转化过程为 ,这是一个正反应放热的可逆反应。则
,这是一个正反应放热的可逆反应。则 、
、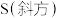 相比,较稳定的是
相比,较稳定的是___________ [填“ ”或“
”或“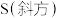 ”]。
”]。
(2)硫酸工业的一步重要反应是 的催化氧化
的催化氧化 。向一恒压密闭容器中充入一定量的
。向一恒压密闭容器中充入一定量的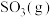 发生上述反应,能判断反应已达平衡状态的叙述是___________(填标号)。
发生上述反应,能判断反应已达平衡状态的叙述是___________(填标号)。
(3)某实验小组通过铁块与稀硫酸反应的实验,研究化学反应速率的影响因素,并绘制出如下图示:
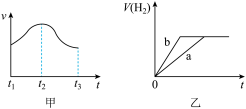
①图甲中, 到
到 速率明显加快的主要原因是
速率明显加快的主要原因是___________ 。
②图乙中,曲线a为铁块与足量稀硫酸反应生成 的体积随时间变化关系。能将曲线a转化为b的实验措施有
的体积随时间变化关系。能将曲线a转化为b的实验措施有___________ (填标号)。
A.将铁块换成铁粉
B.加 固体
固体
C.加 固体
固体
D.将稀硫酸换成98%的硫酸溶液
E.滴入几滴硫酸铜溶液
(4)硫氧化菌电池在废水处理和新能源开发域有广阔的应用前景,其工作原理如图所示。
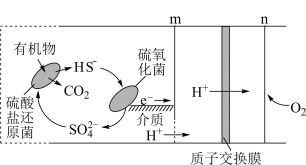
① 在硫氧化菌作用下转化为
在硫氧化菌作用下转化为 的电极反应式为
的电极反应式为___________ 。
②处理0.05mol 时,从质子交换膜左侧迁移至右侧的
时,从质子交换膜左侧迁移至右侧的
___________ mol。
(5)将 与空气的混合气体通入到
与空气的混合气体通入到 、
、 和
和 的混合溶液中,转化过程如图所示:
的混合溶液中,转化过程如图所示:
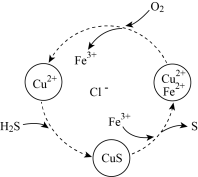
总过程的化学方程式为___________ 。
(1)
 分子可形成单斜硫和斜方硫,其转化过程为
分子可形成单斜硫和斜方硫,其转化过程为 ,这是一个正反应放热的可逆反应。则
,这是一个正反应放热的可逆反应。则 、
、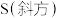 相比,较稳定的是
相比,较稳定的是 ”或“
”或“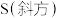 ”]。
”]。(2)硫酸工业的一步重要反应是
 的催化氧化
的催化氧化 。向一恒压密闭容器中充入一定量的
。向一恒压密闭容器中充入一定量的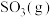 发生上述反应,能判断反应已达平衡状态的叙述是___________(填标号)。
发生上述反应,能判断反应已达平衡状态的叙述是___________(填标号)。| A.混合气体的密度不再改变 |
B.混合气体中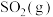 和 和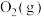 的分压之比不再改变 的分压之比不再改变 |
C. |
| D.混合气体的平均相对分子质量不再改变 |

①图甲中,
 到
到 速率明显加快的主要原因是
速率明显加快的主要原因是②图乙中,曲线a为铁块与足量稀硫酸反应生成
 的体积随时间变化关系。能将曲线a转化为b的实验措施有
的体积随时间变化关系。能将曲线a转化为b的实验措施有A.将铁块换成铁粉
B.加
 固体
固体C.加
 固体
固体D.将稀硫酸换成98%的硫酸溶液
E.滴入几滴硫酸铜溶液
(4)硫氧化菌电池在废水处理和新能源开发域有广阔的应用前景,其工作原理如图所示。

①
 在硫氧化菌作用下转化为
在硫氧化菌作用下转化为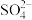 的电极反应式为
的电极反应式为②处理0.05mol
 时,从质子交换膜左侧迁移至右侧的
时,从质子交换膜左侧迁移至右侧的
(5)将
 与空气的混合气体通入到
与空气的混合气体通入到 、
、 和
和 的混合溶液中,转化过程如图所示:
的混合溶液中,转化过程如图所示:
总过程的化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)下列变化过程,属于放热反应的是_______ (填写序号)。
①浓H2SO4稀释 ②酸碱中和反应 ③食物因氧化而腐败
④固体NaOH溶于水 ⑤液态水变成水蒸气 ⑥碳在高温条件下还原CO2
(2)标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,写出表示甲烷燃烧的热化学方程式_______ 。
(3)已知:C(石墨,s)+ O2(g)=CO2(g) ΔH1=-a kJ·mol-1
H2(g)+ O2(g)=H2O(l) ΔH2=-b kJ·mol-1
O2(g)=H2O(l) ΔH2=-b kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3=-c kJ·mol-1
写出C(石墨,s)与H2(g)反应生成CH4(g)的热化学方程式_______ 。
(4)某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。
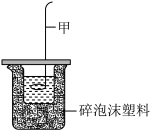
I.实验步骤:
①量取50mL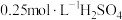 溶液,倒入小烧杯中,测量温度;
溶液,倒入小烧杯中,测量温度;
②量取50mL NaOH溶液,测量温度;
NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,测量混合液的最高温度。
II.实验数据如下:
请回答下列问题:
①仪器甲的名称为_______ ,进行该实验还缺少的仪器为_______ (填仪器名称)。仪器甲不能用铁制材料的原因是_______ 。
②设实验所用的酸、碱溶液的密度均为 ,且酸、碱中和后的溶液的比热容
,且酸、碱中和后的溶液的比热容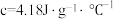 。计算该实验中生成 1mol 水时的反应热
。计算该实验中生成 1mol 水时的反应热
_______  (保留一位小数)
(保留一位小数)
③若改用60mL0.50mol•L-1盐酸与60mL0.55mol•L-1NaOH溶液进行反应,与(1)中实验相比,所放出的热量_______ (填写“相等”或“不相等”);若用50mL0.50mol•L-1CH3COOH溶液代替盐酸进行(1)中实验,测得反应前后温度的变化值_______ (填写“偏大”、“偏小”或“不变”)。
(1)下列变化过程,属于放热反应的是
①浓H2SO4稀释 ②酸碱中和反应 ③食物因氧化而腐败
④固体NaOH溶于水 ⑤液态水变成水蒸气 ⑥碳在高温条件下还原CO2
(2)标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,写出表示甲烷燃烧的热化学方程式
(3)已知:C(石墨,s)+ O2(g)=CO2(g) ΔH1=-a kJ·mol-1
H2(g)+
 O2(g)=H2O(l) ΔH2=-b kJ·mol-1
O2(g)=H2O(l) ΔH2=-b kJ·mol-1CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3=-c kJ·mol-1
写出C(石墨,s)与H2(g)反应生成CH4(g)的热化学方程式
(4)某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。

I.实验步骤:
①量取50mL
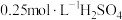 溶液,倒入小烧杯中,测量温度;
溶液,倒入小烧杯中,测量温度;②量取50mL
 NaOH溶液,测量温度;
NaOH溶液,测量温度;③将NaOH溶液倒入小烧杯中,测量混合液的最高温度。
II.实验数据如下:
| 实验序号 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | ||
 溶液 溶液 | NaOH溶液 | 平均值 | ||
| 1 | 25.0 | 25.2 | 28.5 | |
| 2 | 24.9 | 25.1 | 28.4 | |
| 3 | 25.5 | 26.5 | 31.8 | |
①仪器甲的名称为
②设实验所用的酸、碱溶液的密度均为
 ,且酸、碱中和后的溶液的比热容
,且酸、碱中和后的溶液的比热容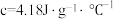 。计算该实验中生成 1mol 水时的反应热
。计算该实验中生成 1mol 水时的反应热
 (保留一位小数)
(保留一位小数)③若改用60mL0.50mol•L-1盐酸与60mL0.55mol•L-1NaOH溶液进行反应,与(1)中实验相比,所放出的热量
您最近一年使用:0次
2023-03-19更新
|
421次组卷
|
2卷引用:湖北省武汉市武钢三中2022-2023学年高一下学期3月月考化学试题
6 . I.钛(Ti)因具有硬度大、熔点高、耐酸腐蚀等优点而被应用于航空、电子等领域,由金红石(TiO2)制取单质Ti的步骤如下:
TiO2→TiCl4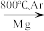 Ti
Ti
已知:i. C(s)+O2(g)=CO2(g) ΔH=−393.5 kJ∙mol−1
ii. 2CO(g)+O2(g)=2CO2(g) ΔH=−566 kJ∙mol−1
ⅲ. TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) ΔH=+141 kJ∙mol−1
(1)TiO2(s)+2Cl2(g)+2 C(s)=TiCl(s)+2CO(g)的ΔH=_______
(2)反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是
2MgCl2+Ti在Ar气氛中进行的理由是_______
Ⅱ. 50mL 0.50 mol∙L−1盐酸与50mL 0.55 mol∙L−1 NaOH溶液在简易量热计中进行中和反应,假设盐酸和氢氧化钠溶液的密度都是1g·cm−3,又知中和反应后生成溶液的比热容c=4.18J·g−1·℃−1。为了计算中和热,某学生实验记录的数据如下:
(3)依据该学生的实验数据计算,该实验测得的中和热ΔH=_______ (结果保留一位小数)。如用0.5 mol∙L−1的盐酸与NaOH固体进行实验,则实验中测得的中和热数值将_______ (填“偏大”、“偏小”或“不变”)。
Ⅲ.25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。
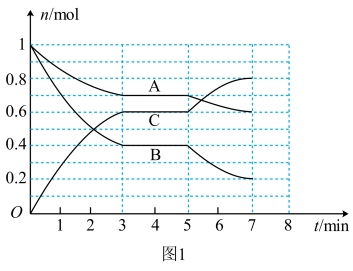
(4)根据图1数据,写出该反应的化学方程式:_______ 。此反应的平衡常数表达式K=_______ 。
(5)在5~7min内,若K不变,则此处曲线变化的原因是_______ 。
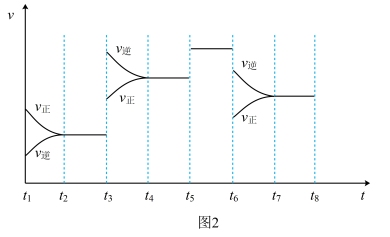
(6)此反应的反应速率v和时间t的关系如图2,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为_______ (用“>”、“<”或“=”连接)
TiO2→TiCl4
 Ti
Ti已知:i. C(s)+O2(g)=CO2(g) ΔH=−393.5 kJ∙mol−1
ii. 2CO(g)+O2(g)=2CO2(g) ΔH=−566 kJ∙mol−1
ⅲ. TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) ΔH=+141 kJ∙mol−1
(1)TiO2(s)+2Cl2(g)+2 C(s)=TiCl(s)+2CO(g)的ΔH=
(2)反应TiCl4+2Mg
 2MgCl2+Ti在Ar气氛中进行的理由是
2MgCl2+Ti在Ar气氛中进行的理由是Ⅱ. 50mL 0.50 mol∙L−1盐酸与50mL 0.55 mol∙L−1 NaOH溶液在简易量热计中进行中和反应,假设盐酸和氢氧化钠溶液的密度都是1g·cm−3,又知中和反应后生成溶液的比热容c=4.18J·g−1·℃−1。为了计算中和热,某学生实验记录的数据如下:
| 试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
Ⅲ.25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。

(4)根据图1数据,写出该反应的化学方程式:
(5)在5~7min内,若K不变,则此处曲线变化的原因是
(6)此反应的反应速率v和时间t的关系如图2,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为

| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
您最近一年使用:0次
解题方法
7 . “绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)汽车是近代重要的交通运输工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重。汽车尾气中的有害成分主要有CO、NO、SO2、颗粒物和臭氧等。
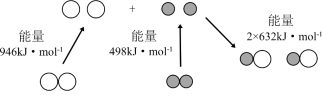
①汽车尾气中NO生成过程中的能量变化如图所示。1 mol N2和1 mol O2完全反应生成NO会_______ (填“吸收”或“放出”)_______ kJ能量。
②一种新型催化剂用于NO和CO的反应:NO+2CO2 CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
前2 s内的平均反应速率v(N2)=_______ 。(保留小数点后一位)
③在容积固定的绝热容器中发生反应2NO+2CO 2CO2+N2,下列能说明该反应已达到平衡状态的是
2CO2+N2,下列能说明该反应已达到平衡状态的是_______ (填标号)
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
(2)煤燃烧排放的烟气中含有SO2和NO2,会形成酸雨,污染大气。
①NaClO2溶液在碱性条件下可对烟气进行脱硫、脱硝,效果非常好。完成下列对烟气脱氮过程的离子方程式:_______
_______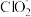 +_______NO+__________=_______Cl-+_______
+_______NO+__________=_______Cl-+_______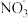 +______________。
+______________。
②针对含SO2的工业废气可以采用“钙基固硫法”。例如将生石灰与含硫的煤混合后再燃烧,可以将SO2最终转化为CaSO4,请写出生石灰将SO2转化为CaSO4的反应的化学方程式:_______
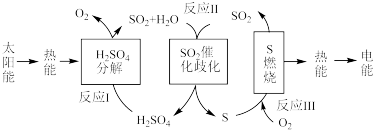
③将SO2转化为重要的化工原料H2SO4的原理示意图如图。
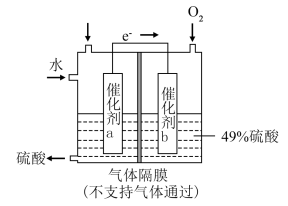
催化剂a表面的电极反应式为_______ 。若得到的硫酸质量分数仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为_______ 。
(1)汽车是近代重要的交通运输工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重。汽车尾气中的有害成分主要有CO、NO、SO2、颗粒物和臭氧等。
①汽车尾气中NO生成过程中的能量变化如图所示。1 mol N2和1 mol O2完全反应生成NO会

②一种新型催化剂用于NO和CO的反应:NO+2CO2
 CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4 mol·L-1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
| c(CO)/(10-3 mol·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
前2 s内的平均反应速率v(N2)=
③在容积固定的绝热容器中发生反应2NO+2CO
 2CO2+N2,下列能说明该反应已达到平衡状态的是
2CO2+N2,下列能说明该反应已达到平衡状态的是A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
(2)煤燃烧排放的烟气中含有SO2和NO2,会形成酸雨,污染大气。
①NaClO2溶液在碱性条件下可对烟气进行脱硫、脱硝,效果非常好。完成下列对烟气脱氮过程的离子方程式:
_______
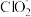 +_______NO+__________=_______Cl-+_______
+_______NO+__________=_______Cl-+_______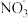 +______________。
+______________。②针对含SO2的工业废气可以采用“钙基固硫法”。例如将生石灰与含硫的煤混合后再燃烧,可以将SO2最终转化为CaSO4,请写出生石灰将SO2转化为CaSO4的反应的化学方程式:
③将SO2转化为重要的化工原料H2SO4的原理示意图如图。

催化剂a表面的电极反应式为
您最近一年使用:0次
8 . 合成氨的反应对人类解决粮食问题贡献巨大,德国化学家F.Haber因合成氨而获得诺贝尔奖。合成氨反应热化学方程式如下:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
(1)已知N2(g)+3H2(g) 2NH3(g)不加入催化剂时正反应的活化能为326kJ/mol,则该反应逆反应的活化能为
2NH3(g)不加入催化剂时正反应的活化能为326kJ/mol,则该反应逆反应的活化能为_______ kJ/mol。
(2)已知N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
H2的燃烧热△H=-285.8kJ/mol
则NH3(g)+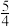 O2(g)=NO(g)+
O2(g)=NO(g)+ H2O(l) △H=
H2O(l) △H=_______ kJ/mol。
(3)一定温度下,向恒容的密闭容器中充入一定量的N2和H2发生反应,测得各组分浓度随时间变化如图所示。
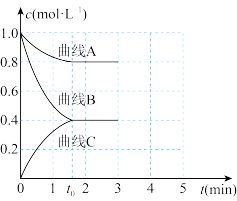
①表示c(H2)变化的曲线是_______ (填“曲线A”“曲线B”或“曲线C”)。
②0~t0时用NH3表示的化学反应速率为v(NH3)=_______ mol·L-1·min-1。
③下列能说明该反应达到平衡状态的是_______ (填标号)。
A.容器中混合气体的密度不随时间变化
B.容器中的n(N2)与n(H2)的比值不随时间变化
C.断裂3molH-H的同时断裂6molN-H键
D.3v正(H2)=2v逆(NH3)
(4)合成氨反应在某催化剂条件下的相对能量-反应历程如图所示(ad为吸附态):
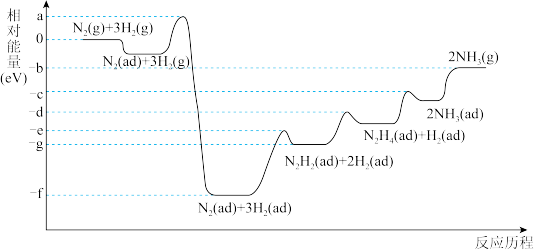
①该过程中含氮的中间产物有_______ 种(填数字)。
②活化能最大的那一步基元反应方程式为_______ 。
③下列说法正确的是_______ (填标号)。
A.最后一步NH3(ad)变为NH3(g)为吸热过程。
B.催化剂参与反应,但不改变合成氨反应的△H
C.催化剂和升温都能降低反应的活化能,加快合成氨的反应速率
D.使用催化剂和压缩容器体积加压都能增大活化分子百分数,加快合成氨反应速率
 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol(1)已知N2(g)+3H2(g)
 2NH3(g)不加入催化剂时正反应的活化能为326kJ/mol,则该反应逆反应的活化能为
2NH3(g)不加入催化剂时正反应的活化能为326kJ/mol,则该反应逆反应的活化能为(2)已知N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
H2的燃烧热△H=-285.8kJ/mol
则NH3(g)+
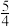 O2(g)=NO(g)+
O2(g)=NO(g)+ H2O(l) △H=
H2O(l) △H=(3)一定温度下,向恒容的密闭容器中充入一定量的N2和H2发生反应,测得各组分浓度随时间变化如图所示。

①表示c(H2)变化的曲线是
②0~t0时用NH3表示的化学反应速率为v(NH3)=
③下列能说明该反应达到平衡状态的是
A.容器中混合气体的密度不随时间变化
B.容器中的n(N2)与n(H2)的比值不随时间变化
C.断裂3molH-H的同时断裂6molN-H键
D.3v正(H2)=2v逆(NH3)
(4)合成氨反应在某催化剂条件下的相对能量-反应历程如图所示(ad为吸附态):

①该过程中含氮的中间产物有
②活化能最大的那一步基元反应方程式为
③下列说法正确的是
A.最后一步NH3(ad)变为NH3(g)为吸热过程。
B.催化剂参与反应,但不改变合成氨反应的△H
C.催化剂和升温都能降低反应的活化能,加快合成氨的反应速率
D.使用催化剂和压缩容器体积加压都能增大活化分子百分数,加快合成氨反应速率
您最近一年使用:0次
9 . 2021年10月27日,以“探索与展望第五次工业革命中时尚产业的方向和绿色共识”为主题的2021气候创新·时尚峰会在柯桥举行。大会倡导绿色、低碳、循环、可持续的发展方式,共同构建新型世界纺织产业命运共同体。
(1)已知下列热化学方程式:
ⅰ.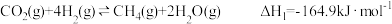
ⅱ.
已知在某种催化剂的作用下,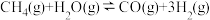 的正反应的活化能Ea(正)为
的正反应的活化能Ea(正)为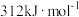 ,则该反应逆反应的活化能Ea(逆)为
,则该反应逆反应的活化能Ea(逆)为___________ kJ/mol。
(2)将 的混合气体充入反应器中,气体总压强为
的混合气体充入反应器中,气体总压强为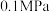 ,平衡时
,平衡时 、
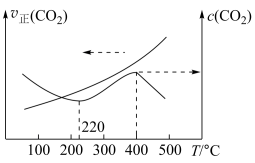
、 正(CO2)与温度的关系如图所示。
正(CO2)与温度的关系如图所示。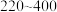 ℃时,
℃时, 的物质的量浓度随温度升高而增大的原因是
的物质的量浓度随温度升高而增大的原因是___________ 。
(3)在使用某种催化剂催化CO2加氢合成乙烯的反应时,所得产物含 、
、 、
、 等副产物。若在催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
等副产物。若在催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
欲提高单位时间内乙烯的产量,在催化剂中添加___________ 助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是___________ 。
(4)在T℃时,向容积为2L的恒容密闭容器中充入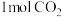 和一定量的
和一定量的 发生反应:
发生反应: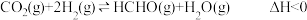 。达到平衡时,HCHO的分压与起始的
。达到平衡时,HCHO的分压与起始的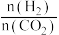 关系如图所示:
关系如图所示:
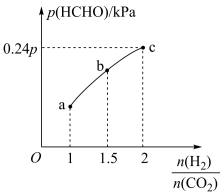
①起始时容器内气体总压强为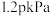 ,若5min时反应到达c点,则
,若5min时反应到达c点,则
___________ 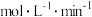 。
。
②b点时反应的化学平衡常数
___________ (保留三位有效数字)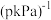 。
。
③c点时,再加入 和
和 ,使二者分压均增大
,使二者分压均增大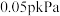 ,则
,则 的转化率
的转化率___________ (填“增大”、“不变”或“减小”)。
(1)已知下列热化学方程式:
ⅰ.
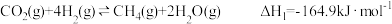
ⅱ.

已知在某种催化剂的作用下,
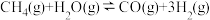 的正反应的活化能Ea(正)为
的正反应的活化能Ea(正)为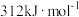 ,则该反应逆反应的活化能Ea(逆)为
,则该反应逆反应的活化能Ea(逆)为(2)将
 的混合气体充入反应器中,气体总压强为
的混合气体充入反应器中,气体总压强为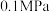 ,平衡时
,平衡时 、
、 正(CO2)与温度的关系如图所示。
正(CO2)与温度的关系如图所示。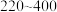 ℃时,
℃时, 的物质的量浓度随温度升高而增大的原因是
的物质的量浓度随温度升高而增大的原因是
(3)在使用某种催化剂催化CO2加氢合成乙烯的反应时,所得产物含
 、
、 、
、 等副产物。若在催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
等副产物。若在催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。| 助剂 | CO2转化率/% | 各产物在所有产物中的占比/% | ||
 |  | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
(4)在T℃时,向容积为2L的恒容密闭容器中充入
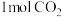 和一定量的
和一定量的 发生反应:
发生反应: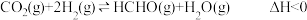 。达到平衡时,HCHO的分压与起始的
。达到平衡时,HCHO的分压与起始的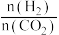 关系如图所示:
关系如图所示:
①起始时容器内气体总压强为
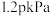 ,若5min时反应到达c点,则
,若5min时反应到达c点,则
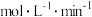 。
。②b点时反应的化学平衡常数

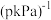 。
。③c点时,再加入
 和
和 ,使二者分压均增大
,使二者分压均增大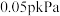 ,则
,则 的转化率
的转化率
您最近一年使用:0次
2021-12-21更新
|
1197次组卷
|
11卷引用:湖北省天门中学、仙桃中学2021-2022学年高一下学期2月联考化学试题
湖北省天门中学、仙桃中学2021-2022学年高一下学期2月联考化学试题湖北省重点校联考2021-2022学年高三上学期12月月考化学试题河南省部分重点高中2021-2022学年高三上学期12月调研考试化学试题河北省保定市2021-2022学年高三上学期期末考试化学试题(已下线)2022年新高考化学时事热点情境化考题---原理综合题(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)黑龙江省大庆市2021-2022学年高三上学期第二次教学质量检测理科综合化学试题(已下线)2022年全国甲卷高考真题变式题(非选择题)湖南省郴州市第二中学2022届高三下学期期中考试化学试题湖南省株洲市九方中学2022-2023学年高三上学期第一次月考化学试题 山东省青岛第二中学2022-2023学年高三上学期第二次月考化学试题
名校
10 . 据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及一氧化碳是许多城市大气污染的主要污染物。氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(一): (1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s); ΔH1=-159 kJ·mol−1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g); ΔH2=a kJ·mol−1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g); ΔH3=-87kJ·mol−1
则a为___________ 。
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=___________ (假设空气中氧气的体积含量为20%)。
(3)下图表示使用新型电极材料,以N2、H2为电极反应物,以HCl - NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式___________ ,生产中可分离出的物质A的化学式为___________ 。
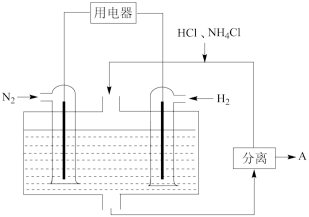
(二): 向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应:C(s) + 2NO(g) N2(g) + CO2(g) △H<0,NO和N2的物质的量变化如下表所示。
(1)T1℃温度下,反应进行了5min,用二氧化碳表示该反应的平均反应速率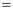
___________ 。
(2)已知:气体分压(P分)=气体总压(P总)×体积分数。T1时用平衡分压代替平衡浓度计算平衡常数KP=___________ 。
(3)第15min后,温度调整到T2,数据变化如上表所示,则T1___________ T2(填“>”、“<”或“=”)。
(4)若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,则此时反应___________ 移动(填“正向”、“逆向”或“不”)。
(一): (1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s); ΔH1=-159 kJ·mol−1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g); ΔH2=a kJ·mol−1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g); ΔH3=-87kJ·mol−1
则a为
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=
(3)下图表示使用新型电极材料,以N2、H2为电极反应物,以HCl - NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式

(二): 向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应:C(s) + 2NO(g) N2(g) + CO2(g) △H<0,NO和N2的物质的量变化如下表所示。
| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
(1)T1℃温度下,反应进行了5min,用二氧化碳表示该反应的平均反应速率
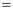
(2)已知:气体分压(P分)=气体总压(P总)×体积分数。T1时用平衡分压代替平衡浓度计算平衡常数KP=
(3)第15min后,温度调整到T2,数据变化如上表所示,则T1
(4)若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,则此时反应
您最近一年使用:0次



