I.钛(Ti)因具有硬度大、熔点高、耐酸腐蚀等优点而被应用于航空、电子等领域,由金红石(TiO2)制取单质Ti的步骤如下:
TiO2→TiCl4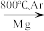 Ti
Ti
已知:i. C(s)+O2(g)=CO2(g) ΔH=−393.5 kJ∙mol−1
ii. 2CO(g)+O2(g)=2CO2(g) ΔH=−566 kJ∙mol−1
ⅲ. TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) ΔH=+141 kJ∙mol−1
(1)TiO2(s)+2Cl2(g)+2 C(s)=TiCl(s)+2CO(g)的ΔH=_______
(2)反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是
2MgCl2+Ti在Ar气氛中进行的理由是_______
Ⅱ. 50mL 0.50 mol∙L−1盐酸与50mL 0.55 mol∙L−1 NaOH溶液在简易量热计中进行中和反应,假设盐酸和氢氧化钠溶液的密度都是1g·cm−3,又知中和反应后生成溶液的比热容c=4.18J·g−1·℃−1。为了计算中和热,某学生实验记录的数据如下:
(3)依据该学生的实验数据计算,该实验测得的中和热ΔH=_______ (结果保留一位小数)。如用0.5 mol∙L−1的盐酸与NaOH固体进行实验,则实验中测得的中和热数值将_______ (填“偏大”、“偏小”或“不变”)。
Ⅲ.25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。
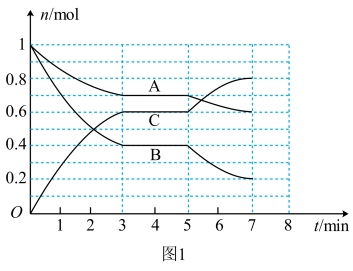
(4)根据图1数据,写出该反应的化学方程式:_______ 。此反应的平衡常数表达式K=_______ 。
(5)在5~7min内,若K不变,则此处曲线变化的原因是_______ 。
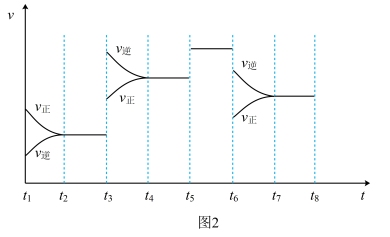
(6)此反应的反应速率v和时间t的关系如图2,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为_______ (用“>”、“<”或“=”连接)
TiO2→TiCl4
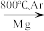 Ti
Ti已知:i. C(s)+O2(g)=CO2(g) ΔH=−393.5 kJ∙mol−1
ii. 2CO(g)+O2(g)=2CO2(g) ΔH=−566 kJ∙mol−1
ⅲ. TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) ΔH=+141 kJ∙mol−1
(1)TiO2(s)+2Cl2(g)+2 C(s)=TiCl(s)+2CO(g)的ΔH=
(2)反应TiCl4+2Mg
 2MgCl2+Ti在Ar气氛中进行的理由是
2MgCl2+Ti在Ar气氛中进行的理由是Ⅱ. 50mL 0.50 mol∙L−1盐酸与50mL 0.55 mol∙L−1 NaOH溶液在简易量热计中进行中和反应,假设盐酸和氢氧化钠溶液的密度都是1g·cm−3,又知中和反应后生成溶液的比热容c=4.18J·g−1·℃−1。为了计算中和热,某学生实验记录的数据如下:
| 试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
Ⅲ.25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。

(4)根据图1数据,写出该反应的化学方程式:
(5)在5~7min内,若K不变,则此处曲线变化的原因是
(6)此反应的反应速率v和时间t的关系如图2,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为

| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
更新时间:2022-09-10 22:38:54
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
【推荐1】Ⅰ、用如图仪器组装成一套简易量热计测定室温下中和反应的反应热。
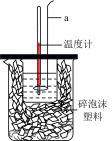
(1)碎泡沫塑料的作用是__________ ;图中仪器a的名称是____________ ;
(2)中和反应的实质是_______________ (用离子方程式表示)。
Ⅱ、.某研究性学习小组的同学对Zn、Cu、稀硫酸组成的原电池进行了探究,其中甲同学利用下图I装置进行探究,乙同学经过查阅资料后设计了图II装置进行探究( 盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
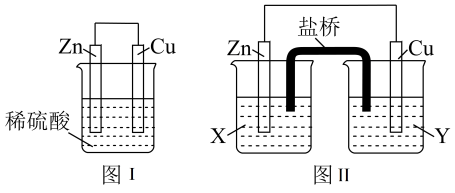
(3)实验表明,图I中两个电极上均有气泡产生,锌电极上有气泡产生,说明反应中有一部分化学能转化为_____ 能;铜电极上有气泡产生,说明反应中有一部分化学能转化为____ 能。
(4)图II中的X、Y 是ZnSO4溶液及稀硫酸中的一种,实验过程中只有正极上产生气泡,则X 是_________ ,正极上的电极反应式为__________ 。
(5)当图I装置的溶液质量增加63 g时,生成的氢气共有______ L( 标准状况;当图II 中锌电极质量减少65g时,电路中转移的电子数为______ NA。
Ⅲ、在一定条件下甲烷也可用于燃料电池。下图是甲烷燃料电池的原理示意图:
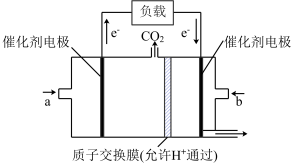
(6)若正极的反应式为O2+4e-+4H+=2H2O,则负极反应式为___________________ ;

(1)碎泡沫塑料的作用是
(2)中和反应的实质是
Ⅱ、.某研究性学习小组的同学对Zn、Cu、稀硫酸组成的原电池进行了探究,其中甲同学利用下图I装置进行探究,乙同学经过查阅资料后设计了图II装置进行探究( 盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。

(3)实验表明,图I中两个电极上均有气泡产生,锌电极上有气泡产生,说明反应中有一部分化学能转化为
(4)图II中的X、Y 是ZnSO4溶液及稀硫酸中的一种,实验过程中只有正极上产生气泡,则X 是
(5)当图I装置的溶液质量增加63 g时,生成的氢气共有
Ⅲ、在一定条件下甲烷也可用于燃料电池。下图是甲烷燃料电池的原理示意图:

(6)若正极的反应式为O2+4e-+4H+=2H2O,则负极反应式为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】某实验小组用0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol·L-1NaOH溶液。若实验中大约要使用470mLNaOH溶液,至少需要称量NaOH固体___ g。
Ⅱ.测定稀H2SO4和NaOH稀溶液中和热的实验装置如图所示。
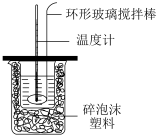
(1)能不能用铜丝代替环形玻璃搅拌棒___ (填“能”或“不能”)
(2)大烧杯如不盖硬纸板,求得的中和热△H将___ (填“偏大”、“偏小”或“无影响”)
(3)取50mLNaOH溶液和30mL硫酸溶液进行实验。经数据处理,实验测得中和热ΔH=-53.5kJ•mol-1,该结果数值上与57.3kJ·mol-1有偏差,产生该偏差的原因可能是___ (填字母)。
A.实验装置保温、隔热效果差
B.量取H2SO4溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
Ⅰ.配制0.50mol·L-1NaOH溶液。若实验中大约要使用470mLNaOH溶液,至少需要称量NaOH固体
Ⅱ.测定稀H2SO4和NaOH稀溶液中和热的实验装置如图所示。

(1)能不能用铜丝代替环形玻璃搅拌棒
(2)大烧杯如不盖硬纸板,求得的中和热△H将
(3)取50mLNaOH溶液和30mL硫酸溶液进行实验。经数据处理,实验测得中和热ΔH=-53.5kJ•mol-1,该结果数值上与57.3kJ·mol-1有偏差,产生该偏差的原因可能是
A.实验装置保温、隔热效果差
B.量取H2SO4溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】醋是一种酸味调味品。一般来说,醋也是分等级的,等级越高,醋的品质越好。企业一般是按总酸来对醋进行标注,已知食醋的等级如表,利用NaOH溶液滴定食醋测定食醋中的醋酸含量。请回答下列问题:
(1)醋酸(CH3COOH)的电离方程式为_______ 。
(2)室温下,取50.0mL某食醋样品溶于水,加水稀释,配成500mL溶液。用_______ (填“酸式”或“碱式”)滴定管准确量取25.00mL所配食醋溶液加入锥形瓶中,滴加2~3滴酚酞试液作指示剂,用0.10mol⋅L-1NaOH标准溶液滴定。
(3)达到滴定终点的现象是_______ ;当溶液中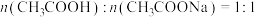 时,溶液呈
时,溶液呈_______ (填“酸”或“碱”)性。[已知常温下,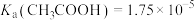 ]
]
(4)重复滴定实验三次,测得的数据如下表所示:
通过计算,该食醋样品中醋酸的含量为_______ (保留两位有效数字)g/100mL,该食醋的级别为_______ 。
(5)下列操作中会使所测食醋的浓度偏低的是_______(填标号)。
(6)若用NaOH溶液和醋酸溶液测定中和反应反应热,则测得的
_______ (填“>”“<”或“=”)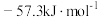 。
。
| 级别 | 特级醋 | 一级醋 | 二级醋 |
| 醋酸含量(g/100mL) | >6.0 | >4.5 | >3.5 |
(2)室温下,取50.0mL某食醋样品溶于水,加水稀释,配成500mL溶液。用
(3)达到滴定终点的现象是
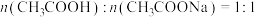 时,溶液呈
时,溶液呈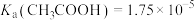 ]
](4)重复滴定实验三次,测得的数据如下表所示:
| 实验次数 | NaOH标准溶液 | |
| 滴定前读数/mL | 滴定终点读数/mL | |
| 1 | 1.50 | 20.95 |
| 2 | 2.10 | 21.60 |
| 3 | 1.20 | 20.75 |
(5)下列操作中会使所测食醋的浓度偏低的是_______(填标号)。
| A.使用甲基橙作指示剂 |
| B.盛放食醋溶液的锥形瓶使用前未进行干燥 |
| C.碱式滴定管在滴定前尖嘴处无气泡,滴定后有气泡 |
| D.滴定结束读取NaOH标准溶液的体积时,仰视读数 |

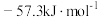 。
。
您最近一年使用:0次
【推荐1】学习化学反应速率和限度能够指导促进工业生产。
Ⅰ.汽车发动机工作时会引发 和
和 反应,生成
反应,生成 等污染大气,其中生成NO的能量变化如图所示,
等污染大气,其中生成NO的能量变化如图所示,_______ ;若反应生成2molNO气体应_______ (填“释放”或“吸收”)_______ kJ能量。
Ⅱ.某研究小组用CO和H2模拟工业合成甲醇,发生反应: 在1L的恒容密闭容器内充入1molCO和2mol
在1L的恒容密闭容器内充入1molCO和2mol ,加入合适催化剂后保持某温度不变发生上述反应,并用压力计监测容器内压强的变化如下:
,加入合适催化剂后保持某温度不变发生上述反应,并用压力计监测容器内压强的变化如下:
(2)①下列说法正确的是_______ (填标号)。
a.容器内气体的密度不变,则反应达到平衡
b.容器内气体的平均相对分子质量不变,则反应达到平衡
c.若向平衡体系中充入Ar后,甲醇的生成速率降低
d.容器内CO和 物质的量之比不变,则反应达到平衡
物质的量之比不变,则反应达到平衡
e.CO的转化率不再变化,则反应达到平衡
②从反应开始到20min时, 的平均反应速率为
的平均反应速率为_______ 。
③该条件下,反应 达到平衡时CO的转化率为
达到平衡时CO的转化率为_______ 。
(3)从断键和成键角度分析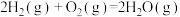 反应中能量的变化。部分化学键的键能如下表:
反应中能量的变化。部分化学键的键能如下表:
则生成 放出热量
放出热量_______ kJ。
(4)NaClO溶液在不同温度下可对烟气中的硫、硝脱除,一定时间内,其脱除率如图所示: 脱除率高于NO,可能的原因是
脱除率高于NO,可能的原因是_______ 。
②烟气中 和NO体积比为4:1,烟气与50℃时的吸收液转化生成的
和NO体积比为4:1,烟气与50℃时的吸收液转化生成的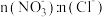 =
=_______ 。
Ⅰ.汽车发动机工作时会引发
 和
和 反应,生成
反应,生成 等污染大气,其中生成NO的能量变化如图所示,
等污染大气,其中生成NO的能量变化如图所示,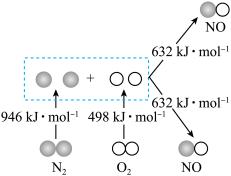
Ⅱ.某研究小组用CO和H2模拟工业合成甲醇,发生反应:
 在1L的恒容密闭容器内充入1molCO和2mol
在1L的恒容密闭容器内充入1molCO和2mol ,加入合适催化剂后保持某温度不变发生上述反应,并用压力计监测容器内压强的变化如下:
,加入合适催化剂后保持某温度不变发生上述反应,并用压力计监测容器内压强的变化如下:| 反应时间/min0 | 0 | 5 | 10 | 15 | 20 | 30 |
| 压强/MPa | 25.2 | 21.6 | 18.9 | 17.4 | 16.8 | 16.8 |
(2)①下列说法正确的是
a.容器内气体的密度不变,则反应达到平衡
b.容器内气体的平均相对分子质量不变,则反应达到平衡
c.若向平衡体系中充入Ar后,甲醇的生成速率降低
d.容器内CO和
 物质的量之比不变,则反应达到平衡
物质的量之比不变,则反应达到平衡e.CO的转化率不再变化,则反应达到平衡
②从反应开始到20min时,
 的平均反应速率为
的平均反应速率为③该条件下,反应
 达到平衡时CO的转化率为
达到平衡时CO的转化率为(3)从断键和成键角度分析
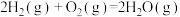 反应中能量的变化。部分化学键的键能如下表:
反应中能量的变化。部分化学键的键能如下表:| 化学键 |  |  |  |
| 键能(kJ/mol) | 436 | 496 | 463 |
 放出热量
放出热量(4)NaClO溶液在不同温度下可对烟气中的硫、硝脱除,一定时间内,其脱除率如图所示:
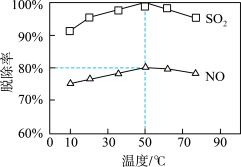
 脱除率高于NO,可能的原因是
脱除率高于NO,可能的原因是②烟气中
 和NO体积比为4:1,烟气与50℃时的吸收液转化生成的
和NO体积比为4:1,烟气与50℃时的吸收液转化生成的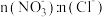 =
=
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________ 。
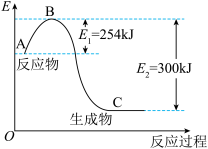
(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
试根据表中及(1)的图中数据计算N—H键的键能为________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________ 。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:

(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
| 化学键 | H—H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
您最近一年使用:0次
【推荐3】硫化氢是一种“臭名昭著”的气体,有难闻的气味而且对人体有毒。脱除、回收和利用废气中的硫化氢是人们研究的重要课题。
Ⅰ.硫化氢的脱除
(1)下列溶液中,不能吸收硫化氢的是___________。
(2)含H2S的气体与饱和Na2CO3溶液在吸收塔内逆流接触,生成两种酸式盐,该反应的离子方程式为___________ 。
(3)乙醇胺(HOCH2CH2NH2)可脱除沼气中的H2S,加热产物,乙醇胺实现再生。从乙醇胺的结构上分析上述过程的原理___________ 。
Ⅱ.硫化氢的回收与利用
已知下列反应的热化学方程式:
①
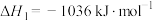
②
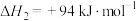
③
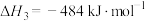
(4)计算H2S热分解反应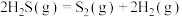 的
的
___________  。从
。从 的角度分析该反应高温下能自发发生的原因是
的角度分析该反应高温下能自发发生的原因是___________ 。
Ⅰ.硫化氢的脱除
(1)下列溶液中,不能吸收硫化氢的是___________。
| A.CuCl2溶液 | B.NaOH溶液 | C.FeSO4溶液 | D.KMnO4溶液 |
(3)乙醇胺(HOCH2CH2NH2)可脱除沼气中的H2S,加热产物,乙醇胺实现再生。从乙醇胺的结构上分析上述过程的原理
Ⅱ.硫化氢的回收与利用
已知下列反应的热化学方程式:
①

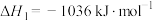
②

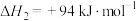
③

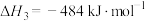
(4)计算H2S热分解反应
 的
的
 。从
。从 的角度分析该反应高温下能自发发生的原因是
的角度分析该反应高温下能自发发生的原因是
您最近一年使用:0次
【推荐1】我国提出争取在2060年实现碳中和,这对于改善环境,实现绿色发展至关重要。碳中和是指CO2的排放总量和减少总量相当。
(1)以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
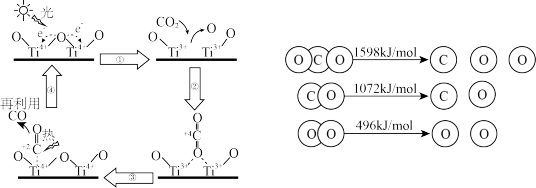
①上述过程中,能量的变化形式是由____ 转化为____ 。
②根据数据计算,将1molCO2分解为CO和O2需____ (填“吸收”或“放出”)____ kJ的能量。
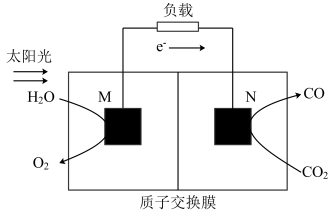
(2)近年科学家提出“绿色自由”构想。利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N极为____ 极,其电极反应方程式为____ 。
(3)在催化剂存在下,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),既能保护环境,又能利用资源。在容积为2L的恒温密闭容器中,充入lmolCO2和3molH2,一定条件下测得CO2和CH3OH(g)的物质的量随时间的变化情况如表。
CH3OH(g)+H2O(g),既能保护环境,又能利用资源。在容积为2L的恒温密闭容器中,充入lmolCO2和3molH2,一定条件下测得CO2和CH3OH(g)的物质的量随时间的变化情况如表。
①下列说法正确的是____ 。
a.反应达到平衡后,反应不再进行
b.使用催化剂是可以增大反应速率,提高生产效率
c.改变条件,CO2可以100%地转化为CH3OH
d.反应达平衡时断裂C-H键的数目与断裂H-H键的数目比为1∶1
e.混合气体的密度和平均相对分子量不再改变,均可以说明反应已达平衡状态
②a=____ ;3~6min内,v(CO2)=____ ;第3min时v正(CH3OH)_____ (填“>”、“<”或“=”)第9min时v逆(CH3OH)。
(1)以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。

①上述过程中,能量的变化形式是由
②根据数据计算,将1molCO2分解为CO和O2需
(2)近年科学家提出“绿色自由”构想。利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N极为

(3)在催化剂存在下,发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),既能保护环境,又能利用资源。在容积为2L的恒温密闭容器中,充入lmolCO2和3molH2,一定条件下测得CO2和CH3OH(g)的物质的量随时间的变化情况如表。
CH3OH(g)+H2O(g),既能保护环境,又能利用资源。在容积为2L的恒温密闭容器中,充入lmolCO2和3molH2,一定条件下测得CO2和CH3OH(g)的物质的量随时间的变化情况如表。| 时间 | 0min | 3min | 6min | 9min | 12min |
| n(CH3OH)/mol | 0 | 0.50 | 0.65 | 0.75 | 0.75 |
| n(CO2)/mol | 1 | 0.50 | 0.35 | a | 0.25 |
a.反应达到平衡后,反应不再进行
b.使用催化剂是可以增大反应速率,提高生产效率
c.改变条件,CO2可以100%地转化为CH3OH
d.反应达平衡时断裂C-H键的数目与断裂H-H键的数目比为1∶1
e.混合气体的密度和平均相对分子量不再改变,均可以说明反应已达平衡状态
②a=
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐2】高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64%(均为体积分数)。某科研小组对尾气的应用展开研究:
(1)直接作燃料
已知:C(s)+O2(g)=CO2 (g) ΔH=-393.5kJ/mol
2C(s)+O2(g)=2CO (g) ΔH=-221kJ/mol
CO燃烧热的热化学方程式为__________ 。
(2)生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:

在脱氧过程中仅吸收了O2,交换过程中发生的反应如下,这两个反应均为吸热反应:
CO2+CH4 CO+H2(未配平) CO+H2O
CO+H2(未配平) CO+H2O CO2+ H2
CO2+ H2
①气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原因____________________________________________ 。
②通过铜催化交换炉后,所得气体中V(H2):V(N2)=__________ 。
(3)合成氨后的气体应用研究
①氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该科研小组在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,发生如下反应:2NO(g)+Cl2(g) 2ClNO(g) ΔH<0。10min时反应达平衡,测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=
2ClNO(g) ΔH<0。10min时反应达平衡,测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=__________ mol。设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为α2,则α1__________ α2 (填“>”、“<”或“=”);平衡常数K__________ (填增大”“减小 ”或“不变”)
②氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为__________ 。
(1)直接作燃料
已知:C(s)+O2(g)=CO2 (g) ΔH=-393.5kJ/mol
2C(s)+O2(g)=2CO (g) ΔH=-221kJ/mol
CO燃烧热的热化学方程式为
(2)生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:

在脱氧过程中仅吸收了O2,交换过程中发生的反应如下,这两个反应均为吸热反应:
CO2+CH4
 CO+H2(未配平) CO+H2O
CO+H2(未配平) CO+H2O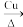 CO2+ H2
CO2+ H2①气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原因
②通过铜催化交换炉后,所得气体中V(H2):V(N2)=
(3)合成氨后的气体应用研究
①氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该科研小组在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,发生如下反应:2NO(g)+Cl2(g)
 2ClNO(g) ΔH<0。10min时反应达平衡,测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=
2ClNO(g) ΔH<0。10min时反应达平衡,测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=②氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】(一)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
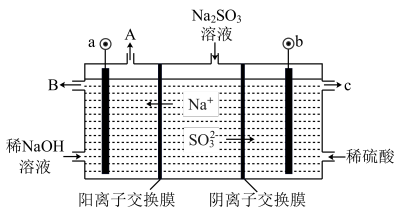
(1)写出用过量的NaOH溶液吸收烟气中的SO2的方程式___ 。
(2)图中a极要连接电源的(填“正”或“负”)___ 极,C口流出的物质是___ 。
(3)SO32−放电的电极反应式为___ 。
(4)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因___ 。
(二)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)⇌SO3(g)+NO(g),将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO2的同时生成1molNO

(1)写出用过量的NaOH溶液吸收烟气中的SO2的方程式
(2)图中a极要连接电源的(填“正”或“负”)
(3)SO32−放电的电极反应式为
(4)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因
(二)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)⇌SO3(g)+NO(g),将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO2的同时生成1molNO
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】完成下列问题。
(1)研究NO2、SO2、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义
①已知:2SO2 (g)+O2(g) 2SO3 (g) △H = -196.6kJ/mol
2SO3 (g) △H = -196.6kJ/mol
2NO (g)+O2(g) 2NO2 (g) △H = -113.0kJ/mol
2NO2 (g) △H = -113.0kJ/mol
则反应NO2(g)+ SO2 (g) NO(g)+ SO3 (g) 的 △H =
NO(g)+ SO3 (g) 的 △H = _______ 
②在一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应。下列不能说明反应达到平衡状态的是_______ (填字母)。
a.混合气体密度保持不变 b.混合气体的颜色保持不变
c.NO2和SO2的体积比保持不变 d.每生成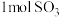 消耗
消耗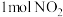
(2)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
CH3OH(g) ΔH,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
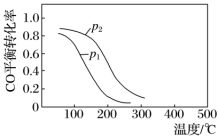
①ΔH_______ (填“>”“<”或“= ”)0。
②写出一条可同时提高反应速率和CO转化率的措施:_______ 。
③下列说法正确的是_______ (填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④ 0~3 min内用CH3OH表示的反应速率v(CH3OH)=_______ 。
⑤ 200 ℃时,该反应的平衡常数K=_______ 。向上述200 ℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则此时该反应的平衡移动方向为_______ (填“正反应方向”“逆反应方向”或“不移动”)。
(1)研究NO2、SO2、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义
①已知:2SO2 (g)+O2(g)
 2SO3 (g) △H = -196.6kJ/mol
2SO3 (g) △H = -196.6kJ/mol2NO (g)+O2(g)
 2NO2 (g) △H = -113.0kJ/mol
2NO2 (g) △H = -113.0kJ/mol则反应NO2(g)+ SO2 (g)
 NO(g)+ SO3 (g) 的 △H =
NO(g)+ SO3 (g) 的 △H = 
②在一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应。下列不能说明反应达到平衡状态的是
a.混合气体密度保持不变 b.混合气体的颜色保持不变
c.NO2和SO2的体积比保持不变 d.每生成
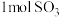 消耗
消耗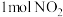
(2)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)
 CH3OH(g) ΔH,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
CH3OH(g) ΔH,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
②写出一条可同时提高反应速率和CO转化率的措施:
③下列说法正确的是
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④ 0~3 min内用CH3OH表示的反应速率v(CH3OH)=
⑤ 200 ℃时,该反应的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐2】硫化氢(H2S)为易燃危化品,与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸,并且硫化氢有剧毒。石油与天然气开采、石油化工、煤化工等行业废气中普遍含有硫化氢,需要回收处理并加以利用。根据所学知识回答下列问题:
(1)已知:Ⅰ.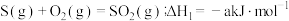 (a>0)
(a>0)
Ⅱ.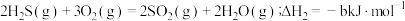 (b>0)
(b>0)
Ⅲ.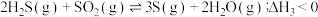
若反应Ⅲ中正反应的活化能为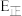 ,逆反应的活化能为
,逆反应的活化能为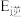 ,则
,则 =
=___________ (填含a、b的代数式) ;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是
;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是___________ (填标号)。
A.体系压强不再变化
B.断裂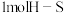 键的同时断裂
键的同时断裂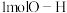 键
键
C.混合气体的密度不再变化
D.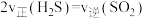
(2)利用工业废气 生产
生产 的反应为
的反应为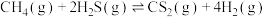 。向某容器中充入
。向某容器中充入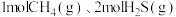 ,体系起始总压强为
,体系起始总压强为 ,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图。
,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图。
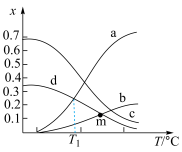
①图中表示 的曲线是
的曲线是___________ (填标号,下同),表示 的曲线是
的曲线是___________ 。
②T1℃时,该反应的
___________ (列出表达式即可,用平衡分压代替平衡浓度,分压 总压×物质的量分数)。
总压×物质的量分数)。
(1)已知:Ⅰ.
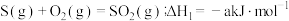 (a>0)
(a>0)Ⅱ.
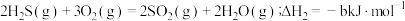 (b>0)
(b>0)Ⅲ.
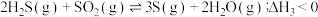
若反应Ⅲ中正反应的活化能为
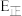 ,逆反应的活化能为
,逆反应的活化能为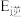 ,则
,则 =
= ;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是
;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是A.体系压强不再变化
B.断裂
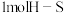 键的同时断裂
键的同时断裂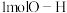 键
键C.混合气体的密度不再变化
D.
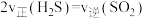
(2)利用工业废气
 生产
生产 的反应为
的反应为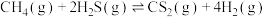 。向某容器中充入
。向某容器中充入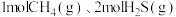 ,体系起始总压强为
,体系起始总压强为 ,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图。
,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图。
①图中表示
 的曲线是
的曲线是 的曲线是
的曲线是②T1℃时,该反应的

 总压×物质的量分数)。
总压×物质的量分数)。
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】碳中和作为一种新型环保形式可推动全社会绿色发展,科学家正在研究建立如下图所示的二氧化碳新循环体系。回答下列问题:
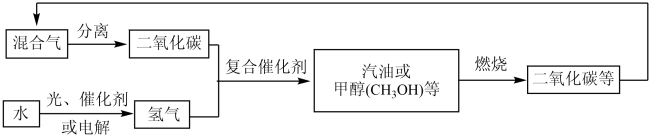
(1)结合图示,下列说法不正确的是_______(填字母)。
(2)300℃时,向2L的恒容密闭容器中,充入2mol  (g)和2mol
(g)和2mol  (g)使之发生反应:
(g)使之发生反应:
 ,测得各物质的物质的量浓度随时间的变化如图所示:
,测得各物质的物质的量浓度随时间的变化如图所示:
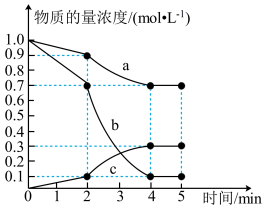
①由图可知,曲线_______ (填“a”、“b”或“c”)表示 浓度随时间的变化;0~2min内,
浓度随时间的变化;0~2min内,
_______  。
。
②已知:反应至2min时,改变了某一反应条件。由图可知,0~2min内 (g)的生成速率小于2~4min内。据图判断,2min时改变的反应条件可能是
(g)的生成速率小于2~4min内。据图判断,2min时改变的反应条件可能是_______ (填字母)。
A.加入催化剂 B.升高温度 C.降低温度 D.增加 的物质的量
的物质的量
③下列能判断该反应已达到化学平衡的标志是_______ (填字母)。
A.容器中混合气体的密度保持不变
B.容器中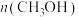 不再发生变化
不再发生变化
C.容器中混合气体的平均摩尔质量保持不变
D.单位时间内消耗1mol 的同时生成1mol
的同时生成1mol 

(1)结合图示,下列说法不正确的是_______(填字母)。
| A.甲醇燃烧时化学能全部转化为热能 | B.光能(或电能)可以转化为化学能 |
| C.减少碳排放有利于缓解全球变暖 | D.无机物和有机物可以相互转化 |
 (g)和2mol
(g)和2mol  (g)使之发生反应:
(g)使之发生反应:
 ,测得各物质的物质的量浓度随时间的变化如图所示:
,测得各物质的物质的量浓度随时间的变化如图所示:
①由图可知,曲线
 浓度随时间的变化;0~2min内,
浓度随时间的变化;0~2min内,
 。
。②已知:反应至2min时,改变了某一反应条件。由图可知,0~2min内
 (g)的生成速率小于2~4min内。据图判断,2min时改变的反应条件可能是
(g)的生成速率小于2~4min内。据图判断,2min时改变的反应条件可能是A.加入催化剂 B.升高温度 C.降低温度 D.增加
 的物质的量
的物质的量③下列能判断该反应已达到化学平衡的标志是
A.容器中混合气体的密度保持不变
B.容器中
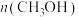 不再发生变化
不再发生变化C.容器中混合气体的平均摩尔质量保持不变
D.单位时间内消耗1mol
 的同时生成1mol
的同时生成1mol 
您最近一年使用:0次



