解题方法
1 . (1)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
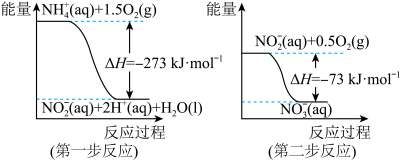
①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是_______ 。
②1mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_________________________ 。
(2) 已知红磷比白磷稳定,则反应:
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1_____ ΔH2(填“>”“<”或“=”)。
(3) 已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ•mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ•mol-1 ②
O2(g) ΔH=-226 kJ•mol-1 ②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为__________________ 。
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ•mol-1,蒸发1mol Br2(l)需要吸收的能量为30kJ,其他相关数据如下表:
则表中a=__________________ 。
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②1mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(2) 已知红磷比白磷稳定,则反应:
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1
(3) 已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ•mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g) ΔH=-226 kJ•mol-1 ②
O2(g) ΔH=-226 kJ•mol-1 ②则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ•mol-1,蒸发1mol Br2(l)需要吸收的能量为30kJ,其他相关数据如下表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
您最近一年使用:0次
2020-10-27更新
|
221次组卷
|
2卷引用:湖北省随州市2020-2021学年高二上学期9月联考化学试题
名校
2 . 氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
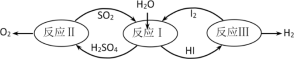
(1)反应Ⅰ的化学方程式是______________________________________
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177 kJ·mol-1
ii.SO3(g)分解。
则SO3(g)分解的热化学方程式为____________________ 。
(3)L(L1、L2)、X可分别代表压强或温度其中之一。如图表示L一定时,ii中SO3(g)的质量分数随X的变化关系。
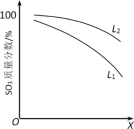
①X代表的物理量是__________ 。
②判断L1、L2的大小关系:L1_______ L2,并简述理由:______________ 。

(1)反应Ⅰ的化学方程式是
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177 kJ·mol-1
ii.SO3(g)分解。
则SO3(g)分解的热化学方程式为
(3)L(L1、L2)、X可分别代表压强或温度其中之一。如图表示L一定时,ii中SO3(g)的质量分数随X的变化关系。

①X代表的物理量是
②判断L1、L2的大小关系:L1
您最近一年使用:0次
2020-10-18更新
|
457次组卷
|
5卷引用:湖北省利川市第五中学2018-2019学年高二上学期期中模拟考试化学试题
名校
解题方法
3 . (1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
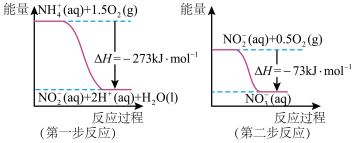
①第一步反应是________ (填“放热”或“吸热”)反应。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是________ 。
(2)化学反应中的焓变与反应物和生成物的键能(E)有关.25℃、101kPa下,已知1g氢气完全燃烧生成液态水时放出142.9kJ的热量,表示氢气燃烧热的热化学方程式是________ .
已知:E(H﹣H)=436kJ/mol,E(O=O)=498kJ/mol则E(H﹣O)=________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+ O2(g)═Cu2O(s)△H=﹣169kJ·mol-1,
O2(g)═Cu2O(s)△H=﹣169kJ·mol-1,
C(s)+ O2(g)═CO(g)△H=﹣110.5kJ·mol-1,
O2(g)═CO(g)△H=﹣110.5kJ·mol-1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ·mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式________ 。若反应过程中转移0.4mole-,则该反应放出(或吸收)的热量为________ kJ。
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是
(2)化学反应中的焓变与反应物和生成物的键能(E)有关.25℃、101kPa下,已知1g氢气完全燃烧生成液态水时放出142.9kJ的热量,表示氢气燃烧热的热化学方程式是
已知:E(H﹣H)=436kJ/mol,E(O=O)=498kJ/mol则E(H﹣O)=
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+
 O2(g)═Cu2O(s)△H=﹣169kJ·mol-1,
O2(g)═Cu2O(s)△H=﹣169kJ·mol-1,C(s)+
 O2(g)═CO(g)△H=﹣110.5kJ·mol-1,
O2(g)═CO(g)△H=﹣110.5kJ·mol-1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ·mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式
您最近一年使用:0次
2020-10-13更新
|
203次组卷
|
3卷引用:湖北省巴东县第三高级中学2022-2023学年高二上学期第一次月考化学试题
名校
4 . 火箭推进器中装有还原剂液态肼(N2H4)和氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。回答下列问题:
(1)过氧化氢的结构式是__________ 。
(2)该反应的热化学方程式为___________ 。
(3)已知H2O(l)=H2O(g) ∆H=+44kJ/mol,则32g液态肼与足量液态过氧化氢反应生成氮气和液态水时,∆H=_________ 。
(4)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的盐,则反应的化学方程式为__________ 。
(5)已知: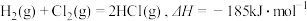 ,几种化学键的键能如下表所示,则a=
,几种化学键的键能如下表所示,则a=_________ 。
(1)过氧化氢的结构式是
(2)该反应的热化学方程式为
(3)已知H2O(l)=H2O(g) ∆H=+44kJ/mol,则32g液态肼与足量液态过氧化氢反应生成氮气和液态水时,∆H=
(4)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的盐,则反应的化学方程式为
(5)已知:
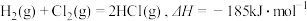 ,几种化学键的键能如下表所示,则a=
,几种化学键的键能如下表所示,则a=共价键 |
|
|
|
键能/( | 436 | 247 | a |
您最近一年使用:0次
2020-08-25更新
|
455次组卷
|
5卷引用:湖北省仙桃、天门、潜江2019-2020学年高一下学期期末考试化学试题
湖北省仙桃、天门、潜江2019-2020学年高一下学期期末考试化学试题(已下线)第一章 化学反应的热效应(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)辽宁省盘锦市第二高级中学2020-2021学年高二上学期第一次阶段性考试化学试题吉林省吉化第一高级中学校2021-2022学年高一下学期复课检测化学试题福建省福州第一中学2022-2023学年高二上学期12月月考化学试题
名校
5 . 按要求填空:
(1)已知X+、Y2+、Zˉ、W2ˉ四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子半径由大到小的顺序是__________________ 。
(2)A+、Bˉ、C、D四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++Bˉ C+D↑,则A+、Bˉ的电子式:
C+D↑,则A+、Bˉ的电子式:___________ ,____________ 。
(3)已知: N2(g)+
N2(g)+ H2(g)=N(g)+3H(g)ΔH1=+akJ·mol-1
H2(g)=N(g)+3H(g)ΔH1=+akJ·mol-1
N(g)+3H(g)=NH3(g)ΔH2=-bkJ·mol-1
NH3(g)=NH3(l)ΔH3=-ckJ·mol-1
写出N2(g)和H2(g)反应生成液氨的热化学方程式____________________________ 。
(4)下列原子: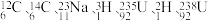 中共有
中共有____ 种元素,_____ 种核素。
(1)已知X+、Y2+、Zˉ、W2ˉ四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子半径由大到小的顺序是
(2)A+、Bˉ、C、D四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++Bˉ
 C+D↑,则A+、Bˉ的电子式:
C+D↑,则A+、Bˉ的电子式:(3)已知:
 N2(g)+
N2(g)+ H2(g)=N(g)+3H(g)ΔH1=+akJ·mol-1
H2(g)=N(g)+3H(g)ΔH1=+akJ·mol-1N(g)+3H(g)=NH3(g)ΔH2=-bkJ·mol-1
NH3(g)=NH3(l)ΔH3=-ckJ·mol-1
写出N2(g)和H2(g)反应生成液氨的热化学方程式
(4)下列原子:
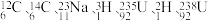 中共有
中共有
您最近一年使用:0次
名校
解题方法
6 . (1)如图为测定中和热的实验装置图。请回答下列问题:
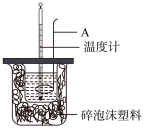
①仪器 A 的名称为___________________ ;
②如果用0.50mol·L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数 值将____________ (填“偏大”、“偏小”或“不变”);
③强酸和强碱的稀溶液的中和热可表示为H+(aq)+OH-(aq) = H2O(l)△H =-57.3kJ·mol-1。已知:CH3COOH(aq)+NaOH(aq) = CH3COONa(aq)+H2O(l)△H =-33.1kJ·mol-1。请写出醋酸溶液电离的热化学方程式:_____________________ 。
(2)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
①已知H2(g)的燃烧热△H1=-285.0kJ·mol-1,CO(g)的燃烧热△H2=-283.0kJ·mol-1,CH3OH(l)的燃烧热△H3=-726.0kJ·mol-1。0.2mol 由H2和 CO 组成的混合气体在完全燃烧时放出 56.8kJ 的能量,则混合气体中 CO 和H2的质量比为_______________ 。工业上在催化剂的作用下, 可用H2(g)和 CO(g)合成CH3OH(l)。请写出由H2(g)和 CO(g)合成CH3OH(l)的热化学方程式:___________________ 。
②丙烷燃烧可以通过以下两种途径:
途径 I:C3H8(g)+5O2(g)═ 3CO2(g)+4H2O(l)△H =-a kJ·mol−1 ;
途径 II:C3H8(g)═ C3H6(g)+H2(g)△H= +b kJ·mol−1,2C3H6(g)+9O2(g)═ 6CO2(g)+6H2O(l)△H =-c kJ·mol−1,2H2(g)+O2(g)═ 2H2O(l)△H =-d kJ·mol−1(abcd均为正值);
a 与 b、c、d 的数学关系式是 a =_____________ 。判断等量的丙烷通过两种途径放出的热量, 途径 I 放出的热量______________ (填“大于”、“等于”或“小于”)途径 II 放出的热量。

①仪器 A 的名称为
②如果用0.50mol·L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数 值将
③强酸和强碱的稀溶液的中和热可表示为H+(aq)+OH-(aq) = H2O(l)△H =-57.3kJ·mol-1。已知:CH3COOH(aq)+NaOH(aq) = CH3COONa(aq)+H2O(l)△H =-33.1kJ·mol-1。请写出醋酸溶液电离的热化学方程式:
(2)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
①已知H2(g)的燃烧热△H1=-285.0kJ·mol-1,CO(g)的燃烧热△H2=-283.0kJ·mol-1,CH3OH(l)的燃烧热△H3=-726.0kJ·mol-1。0.2mol 由H2和 CO 组成的混合气体在完全燃烧时放出 56.8kJ 的能量,则混合气体中 CO 和H2的质量比为
②丙烷燃烧可以通过以下两种途径:
途径 I:C3H8(g)+5O2(g)═ 3CO2(g)+4H2O(l)△H =-a kJ·mol−1 ;
途径 II:C3H8(g)═ C3H6(g)+H2(g)△H= +b kJ·mol−1,2C3H6(g)+9O2(g)═ 6CO2(g)+6H2O(l)△H =-c kJ·mol−1,2H2(g)+O2(g)═ 2H2O(l)△H =-d kJ·mol−1(abcd均为正值);
a 与 b、c、d 的数学关系式是 a =
您最近一年使用:0次
名校
7 . (1)在一定条件下N2与H2反应生成NH3,已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、945.7 kJ,则N2与H2反应生成NH3的热化学方程式为:_____ 。
(2)N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ 的热量,反应N2H4(l)+O2(g)=N2(g)+2H2O(l)的△H=_____ kJ•mol-1。
已知:2H2O2(l)=O2(g)+2H2O(l) △H=-196.4 kJ•mol-1.N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_____ 。
(3)实验室用50 mL 0.50 mol•L-1盐酸与50 mL某浓度的NaOH溶液在如下图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有一处明显的错误,该处错误是缺少一种玻璃仪器,该仪器的名称为_____ ;实验室提供了0.50 mol•L-1和0.55 mol•L-1两种浓度的NaOH溶液,应选择_____ mol•L-1的溶液进行实验。

(2)N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ 的热量,反应N2H4(l)+O2(g)=N2(g)+2H2O(l)的△H=
已知:2H2O2(l)=O2(g)+2H2O(l) △H=-196.4 kJ•mol-1.N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为
(3)实验室用50 mL 0.50 mol•L-1盐酸与50 mL某浓度的NaOH溶液在如下图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有一处明显的错误,该处错误是缺少一种玻璃仪器,该仪器的名称为

您最近一年使用:0次
2020-07-11更新
|
221次组卷
|
3卷引用:湖北省罗田第一中学2021-2022学年高二10月月考化学试题
8 . 资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式______________ 。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____ 、_____ ,CO2的平衡转化率为______ 。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充入1 molCO2,和4 molH2,在II中充入1 mol CH4和2 mol H2 O(g),300℃下开始反应。达到平衡时,下列说法正确的是_________ (填字母)。
A.容器I、II中正反应速率相同 B.容器I、II中CH4的物质的量分数相同 C.容器I中CO2的物质的量比容器II中的多 D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
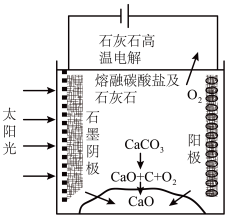
①上述生产过程的能量转化方式是_____ 。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为___ ,阴极的电极反应式为______ 。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充入1 molCO2,和4 molH2,在II中充入1 mol CH4和2 mol H2 O(g),300℃下开始反应。达到平衡时,下列说法正确的是
A.容器I、II中正反应速率相同 B.容器I、II中CH4的物质的量分数相同 C.容器I中CO2的物质的量比容器II中的多 D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:

①上述生产过程的能量转化方式是
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为
您最近一年使用:0次
9 . 煤和甲烷既是重要的常用燃料,又是重要的化工原料。根据题意,回答下列问题:
I.煤制天然气过程中,存在多种化学反应,其中在煤气化装置中发生反应①:C(s) + H2O(g)=CO(g) + H2(g) ∆H = +135 kJ • mol-1,而在水气变换装置中发生反应②:CO(g)+H2O(g)=CO2(g)+ H2(g) ∆H =-41 kJ • mol-1
(1)煤气化前,需要通入一定量的氧气与碳发生燃烧反应,请利用平衡移动原理说明通入氧气的作用:_____________________
(2)写出碳和二氧化碳反应生成一氧化碳的热化学方程式_____ 。
(3)如图表示发生反应①后进入反应②装置的n( H2O)/n(CO)与反应②中CO平衡转化率、温度的变化关系。
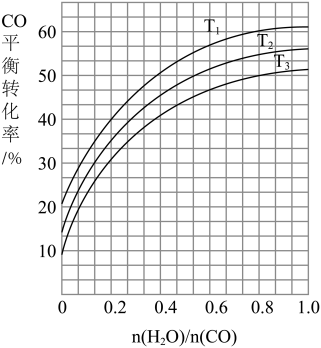
若n(H2O)/n(CO)为0.8,一定量的煤和水蒸气经反应①和反应②后,得到CO与H2的物质的量之比为1:3,则反应②所对应的温度是_____ (填“T1”、“T2”或“T3”)。
Ⅱ.甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和h2混合气体)。现在常(见的重整技术有甲烷——二氧化碳重整、甲烷——水蒸气重整,其反应分别为CH4(g)+3CO2(g)⇌2H2O(g)+4CO(g);CH4(g)+H2O(g)⇌CO(g)+3H2(g)
(4)甲烷——二氧化碳重整的催化转化原理如图所示:
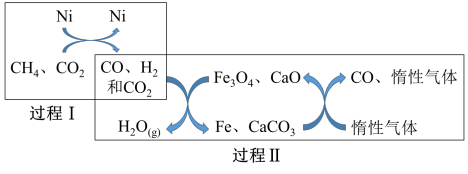
①过程(Ⅱ)实现了含氢物种与含碳物种的分离,写出生成H2O(g)的化学方程式:______
②假设过程(Ⅰ)和过程(Ⅱ)中各步反应均转化完全,则下列说法正确的是_____ (填序号)。
a.过程(Ⅰ)和过程(Ⅱ)中均含有氧化还原反应
b.过程(Ⅱ)中使用的催化剂为Fe3O4和CaCO3
C.若过程(Ⅰ)投料比 ,可导致过程(二)中催化剂失效
,可导致过程(二)中催化剂失效
(5)通过计算机模拟甲烷——水蒸气重整实验测得,在操作压强为0.1Mpa、水碳比n(H2O)/n(CH4)为1.0,温度为900℃,反应达到平衡时,H2的物质的量分数为0.6。已知该反应的速率方程v=kP(CH4)·P-1(H2),式中k为速率常数,P为气体分压,气体分压=总压×气体物质的量分数,则此时该反应速率v=_____ (用含k的式子表示);900℃时,该反应的压强平衡常数Kp=_____ (用平衡分压代替平衡浓度计算)。
I.煤制天然气过程中,存在多种化学反应,其中在煤气化装置中发生反应①:C(s) + H2O(g)=CO(g) + H2(g) ∆H = +135 kJ • mol-1,而在水气变换装置中发生反应②:CO(g)+H2O(g)=CO2(g)+ H2(g) ∆H =-41 kJ • mol-1
(1)煤气化前,需要通入一定量的氧气与碳发生燃烧反应,请利用平衡移动原理说明通入氧气的作用:
(2)写出碳和二氧化碳反应生成一氧化碳的热化学方程式
(3)如图表示发生反应①后进入反应②装置的n( H2O)/n(CO)与反应②中CO平衡转化率、温度的变化关系。

若n(H2O)/n(CO)为0.8,一定量的煤和水蒸气经反应①和反应②后,得到CO与H2的物质的量之比为1:3,则反应②所对应的温度是
Ⅱ.甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和h2混合气体)。现在常(见的重整技术有甲烷——二氧化碳重整、甲烷——水蒸气重整,其反应分别为CH4(g)+3CO2(g)⇌2H2O(g)+4CO(g);CH4(g)+H2O(g)⇌CO(g)+3H2(g)
(4)甲烷——二氧化碳重整的催化转化原理如图所示:

①过程(Ⅱ)实现了含氢物种与含碳物种的分离,写出生成H2O(g)的化学方程式:
②假设过程(Ⅰ)和过程(Ⅱ)中各步反应均转化完全,则下列说法正确的是
a.过程(Ⅰ)和过程(Ⅱ)中均含有氧化还原反应
b.过程(Ⅱ)中使用的催化剂为Fe3O4和CaCO3
C.若过程(Ⅰ)投料比
 ,可导致过程(二)中催化剂失效
,可导致过程(二)中催化剂失效(5)通过计算机模拟甲烷——水蒸气重整实验测得,在操作压强为0.1Mpa、水碳比n(H2O)/n(CH4)为1.0,温度为900℃,反应达到平衡时,H2的物质的量分数为0.6。已知该反应的速率方程v=kP(CH4)·P-1(H2),式中k为速率常数,P为气体分压,气体分压=总压×气体物质的量分数,则此时该反应速率v=
您最近一年使用:0次
2020-06-08更新
|
767次组卷
|
2卷引用:湖北省武汉市第四十九中学2023-2024学年高二上学期10月月考化学试题
2014高三·全国·专题练习
10 . 能源危机当前是一个全球性问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是__ (填字母)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,不使用煤、石油等化石燃料
D.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
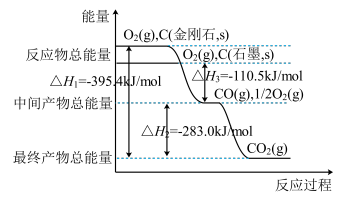
①在通常状况下,金刚石和石墨相比较,__ (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为ΔH=___ 。
②12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为__ kJ。
(3)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1。N2(g)+O2(g)=2NO(g)ΔH=+180.0kJ·mol-1。NO分子中化学键的键能为__ 。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:__ 。
(1)下列做法有助于能源“开源节流”的是
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,不使用煤、石油等化石燃料
D.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
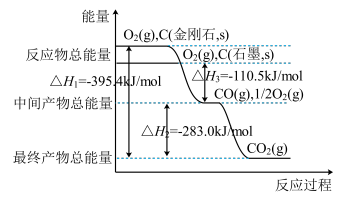
①在通常状况下,金刚石和石墨相比较,
②12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为
(3)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1。N2(g)+O2(g)=2NO(g)ΔH=+180.0kJ·mol-1。NO分子中化学键的键能为
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:
您最近一年使用:0次
2020-05-27更新
|
138次组卷
|
8卷引用:2015-2016学年湖北省武汉二中高一下期末化学试卷







