2023高三上·全国·专题练习
名校
1 . 完成下列问题
(1)已知CH3OH(l)的摩尔燃烧焓ΔH=-726.5 kJ·mol-1,CH3OH(l)+ O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a___________ (填“>”“<”或“=”)726.5。
(2)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:___________ 。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为___________ 。
(4)CO2与H2在某催化剂的作用下反应如图所示:
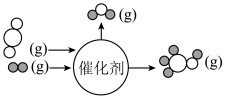
写出该反应的热化学方程式:___________ 。
(5)CO2催化加氢制CH3OH的一种反应历程如图所示(吸附在催化剂表面的物质用*标注,如CO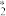 表示CO2吸附在催化剂表面)。
表示CO2吸附在催化剂表面)。
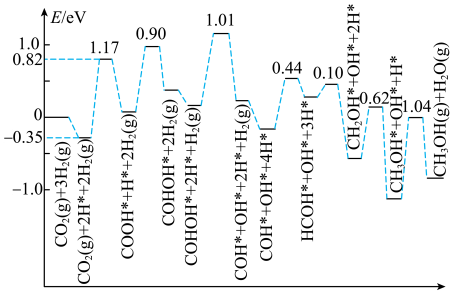
该反应历程中决速步反应的化学方程式为___________ 。
(1)已知CH3OH(l)的摩尔燃烧焓ΔH=-726.5 kJ·mol-1,CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a(2)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为
(4)CO2与H2在某催化剂的作用下反应如图所示:

| 化学键 |  |  | 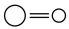 |  |  |
| 键能/(kJ·mol-1) | 436 | 326 | 803 | 464 | 414 |
(5)CO2催化加氢制CH3OH的一种反应历程如图所示(吸附在催化剂表面的物质用*标注,如CO
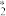 表示CO2吸附在催化剂表面)。
表示CO2吸附在催化剂表面)。
该反应历程中决速步反应的化学方程式为
您最近一年使用:0次
名校
2 . 如图是煤的综合利用过程中化工产业链的一部分
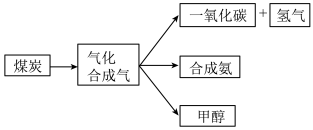
(1)煤的气化发生的主要反应是: 。
。
已知:
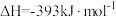

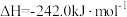
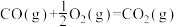
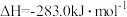
煤气化时发生主要反应的热化学方程式是:
∆H=___________ kJ/mol
(2)用煤气化后得到的 合成氨:
合成氨: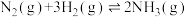
 。在容积为2L的密闭容器中投入
。在容积为2L的密闭容器中投入 和
和 充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是
充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是___________ (填字母)。
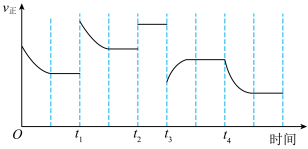
a.t1时可能增大了 的浓度 b.t2时可能充入了氦气
的浓度 b.t2时可能充入了氦气
c.t3时可能降低了温度 d.t4时可能分离出氨气
(3)某温度时合成甲醇的反应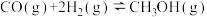
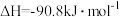 ,在容积固定的密闭容器中,各物质的浓度如下表所示:
,在容积固定的密闭容器中,各物质的浓度如下表所示:
①前2min的反应速率
___________ 。
②该温度下的平衡常数___________ 。(可用分数表示)

(1)煤的气化发生的主要反应是:
 。
。已知:

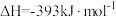

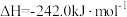
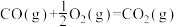
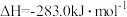
煤气化时发生主要反应的热化学方程式是:

∆H=
(2)用煤气化后得到的
 合成氨:
合成氨: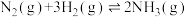
 。在容积为2L的密闭容器中投入
。在容积为2L的密闭容器中投入 和
和 充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是
充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是
a.t1时可能增大了
 的浓度 b.t2时可能充入了氦气
的浓度 b.t2时可能充入了氦气c.t3时可能降低了温度 d.t4时可能分离出氨气
(3)某温度时合成甲醇的反应
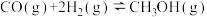
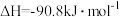 ,在容积固定的密闭容器中,各物质的浓度如下表所示:
,在容积固定的密闭容器中,各物质的浓度如下表所示:浓度 时间 |  | 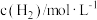 |  |
0 | 1.0 | 1.8 | 0 |
2min | 0.5 | 0.5 | |
4min | 0.4 | 0.6 | 0.6 |
6min | 0.4 | 0.6 | 0.6 |

②该温度下的平衡常数
您最近一年使用:0次
2023-05-13更新
|
136次组卷
|
3卷引用:湖北省宜城市第一中学2023-2024学年高二上学期9月月考化学试题
名校
解题方法
3 . 回答下列问题
(1)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

①第一步反应是________ (填“放热”或“吸热”)反应,判断依据是_______________ 。
②1 mol (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是________________ 。
(2)已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ·mol-1②
O2(g) ΔH=-226 kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为________________ 。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
则表中a=______________ 。
(1)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②1 mol
 (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是(2)已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g) ΔH=-226 kJ·mol-1②
O2(g) ΔH=-226 kJ·mol-1②则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | a |
您最近一年使用:0次
2023-04-20更新
|
279次组卷
|
10卷引用:湖北省黄冈市浠水县实验高级中学2019-2020学年高二上学期期中复习检测化学试题
湖北省黄冈市浠水县实验高级中学2019-2020学年高二上学期期中复习检测化学试题河南省驻马店市正阳县高级中学2019-2020学年高二上学期第三次素质检测化学试题(已下线)综合复习与测试(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)河南省潢川第一中学2022-2023学年高二上学期期末考试化学试题重庆市荣昌永荣中学校2021-2022学年高二上学期期末考试化学试题湖南省株洲市渌口区第三中学2022-2023学年高二下学期期中考试化学试题(已下线)化学反应与能量变化陕西省西安市高陵区第一中学2022-2023学年高二下学期开学考试化学试题河北定州中学2023-2024学年高二上学期12月月考化学试题山西省朔州市怀仁市大地学校高中部2023-2024学年高二上学期12月月考化学试题
4 . 2021年,中国科学院马延和研究员带领团队宣布在人工合成淀粉方面取得突破性进展,是国际上首次在实验室实现二氧化碳到淀粉的全合成。该团队采用一种类似“搭积木”的方式,从头设计、构建了11步反应的非自然固碳与淀粉合成途径,头三步反应如下:
(1)已知:(I)CO2(g)+H2(g) CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1
(Ⅱ)CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
(Ⅲ)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①△H3=______ (用△H1和△H2表示)。
②已知△H3<0,则下列条件中,同时有利于提高CH3OH平衡产率和反应速率的是_____ 。
A.相对高温 B.相对低温 C.相对高压 D.相对低压
(2)T℃时,100MPa条件下,向2L刚性容器中充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得不同时刻容器内压强变化如表:
CH3OH(g)+H2O(g),测得不同时刻容器内压强变化如表:
已知:分压=总压×体积分数。
①该反应用分压表示的平衡常数Kp表达式为_____ 。
②反应前1小时内,用分压表示的平均反应速率v(H2)=_____ MPa•h-1。
③该温度下H2的平衡转化率为______ 。
(3)在催化条件下,密闭容器内通入CO2发生下列反应:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
反应Ⅱ:2CH3OH(g) CH3OCH3(g)+H2O(g) △H4
CH3OCH3(g)+H2O(g) △H4
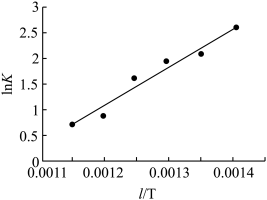
①实验测得反应Ⅱ的平衡常数(记作lnK)与温度( )的关系如图所示,则△H4
)的关系如图所示,则△H4_____ 0(填“>”或“<”)。
②实验测得温度对平衡体系中甲醚、甲醇的百分含量影响如图所示,在300~600K范围内,醇的含量逐渐增大,而甲醚的百分含量逐渐减小的可能原因是:_____ 。

(1)已知:(I)CO2(g)+H2(g)
 CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1(Ⅱ)CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2(Ⅲ)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3①△H3=
②已知△H3<0,则下列条件中,同时有利于提高CH3OH平衡产率和反应速率的是
A.相对高温 B.相对低温 C.相对高压 D.相对低压
(2)T℃时,100MPa条件下,向2L刚性容器中充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得不同时刻容器内压强变化如表:
CH3OH(g)+H2O(g),测得不同时刻容器内压强变化如表:| 时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| p/MPa | 80 | 75 | 72 | 71 | 70 | 70 |
①该反应用分压表示的平衡常数Kp表达式为
②反应前1小时内,用分压表示的平均反应速率v(H2)=
③该温度下H2的平衡转化率为
(3)在催化条件下,密闭容器内通入CO2发生下列反应:
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3反应Ⅱ:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H4
CH3OCH3(g)+H2O(g) △H4①实验测得反应Ⅱ的平衡常数(记作lnK)与温度(
 )的关系如图所示,则△H4
)的关系如图所示,则△H4
②实验测得温度对平衡体系中甲醚、甲醇的百分含量影响如图所示,在300~600K范围内,醇的含量逐渐增大,而甲醚的百分含量逐渐减小的可能原因是:

您最近一年使用:0次
解题方法
5 . 填空。
(1)如图(图中物质均为气态)是 和
和 反应生成
反应生成 和
和 的过程中能量变化示意图,写出
的过程中能量变化示意图,写出 和
和 反应的热化学方程式
反应的热化学方程式_______ 。

(2) (主要指
(主要指 和
和 )是大气主要污染物之一、有效去除大气中的
)是大气主要污染物之一、有效去除大气中的 是环境保护的重要课题。用水吸收
是环境保护的重要课题。用水吸收 的相关热化学方程式如下:
的相关热化学方程式如下:
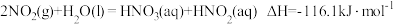

反应 的
的
_______  。
。
(1)如图(图中物质均为气态)是
 和
和 反应生成
反应生成 和
和 的过程中能量变化示意图,写出
的过程中能量变化示意图,写出 和
和 反应的热化学方程式
反应的热化学方程式
(2)
 (主要指
(主要指 和
和 )是大气主要污染物之一、有效去除大气中的
)是大气主要污染物之一、有效去除大气中的 是环境保护的重要课题。用水吸收
是环境保护的重要课题。用水吸收 的相关热化学方程式如下:
的相关热化学方程式如下: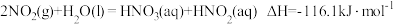

反应
 的
的
 。
。
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)用括号内的字母代号填空:中和热测定实验时,使用的酸和碱最好是_______ (A.恰好完全反应;B.酸稍过量;C.碱稍过量),溶液混合的时候应_______ (A.一次性快速倒入;B.缓缓滴入),若用环形铜丝代替环形玻璃搅拌棒,会导致测定数据_______ (A.偏高;B.偏低)。
(2)保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促进燃料循环使用的构想,如图所示:

过程I的能量转化形式为_______ 能转化为_______ 能。
(3)有机物M经过太阳光照射可转化成N,转化过程如下:
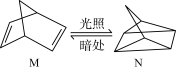 △H=+88.6 kJ·mol−1。
△H=+88.6 kJ·mol−1。
则M、N相比,较稳定的是_______ 。
(4)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。其过程如下所示:

反应I:2H2SO4(l) 2SO2(g)+2H2Og)+O2(g) △H1=+551 kJ·mol−1
2SO2(g)+2H2Og)+O2(g) △H1=+551 kJ·mol−1
反应Ⅲ:S(s)+O2(g)=SO2(g) △H2=-297 kJ·mol−1
写出反应Ⅱ的热化学方程式:_______ 。
(1)用括号内的字母代号填空:中和热测定实验时,使用的酸和碱最好是
(2)保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促进燃料循环使用的构想,如图所示:

过程I的能量转化形式为
(3)有机物M经过太阳光照射可转化成N,转化过程如下:
 △H=+88.6 kJ·mol−1。
△H=+88.6 kJ·mol−1。则M、N相比,较稳定的是
(4)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。其过程如下所示:

反应I:2H2SO4(l)
 2SO2(g)+2H2Og)+O2(g) △H1=+551 kJ·mol−1
2SO2(g)+2H2Og)+O2(g) △H1=+551 kJ·mol−1反应Ⅲ:S(s)+O2(g)=SO2(g) △H2=-297 kJ·mol−1
写出反应Ⅱ的热化学方程式:
您最近一年使用:0次
2022-10-31更新
|
219次组卷
|
3卷引用:湖北省荆州市沙市中学2022-2023学年高二上学期期末化学试题
7 . 研究NO2、SO2、等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为_______ 。利用反应6NO2+8NH3  7N2+12H2O也可处理NO2,当转移1.2 mol电子时,消耗的NO2在标准状况下是
7N2+12H2O也可处理NO2,当转移1.2 mol电子时,消耗的NO2在标准状况下是_______ L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) △H= -196.6 kJ/mol
2SO3(g) △H= -196.6 kJ/mol
2NO(g)+O2(g) 2NO2(g) △H= -113.0 kJ/mol
2NO2(g) △H= -113.0 kJ/mol
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的 △H=
SO3(g)+NO(g)的 △H=_______ kJ/mol。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=_______ 。
(3)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质,写出反应的化学方程式_______ ;该反应中氧化产物与还原产物的物质的量之比为_______ 。
(1)NO2可用水吸收,相应的化学反应方程式为
 7N2+12H2O也可处理NO2,当转移1.2 mol电子时,消耗的NO2在标准状况下是
7N2+12H2O也可处理NO2,当转移1.2 mol电子时,消耗的NO2在标准状况下是(2)已知:2SO2(g)+O2(g)
 2SO3(g) △H= -196.6 kJ/mol
2SO3(g) △H= -196.6 kJ/mol2NO(g)+O2(g)
 2NO2(g) △H= -113.0 kJ/mol
2NO2(g) △H= -113.0 kJ/mol则反应NO2(g)+SO2(g)
 SO3(g)+NO(g)的 △H=
SO3(g)+NO(g)的 △H=一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=
(3)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质,写出反应的化学方程式
您最近一年使用:0次
名校
解题方法
8 . 按要求填空
(1)在25℃,101 kPa下,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为_______ 。
(2)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。
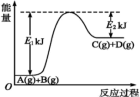
①该反应是_______ (填“吸热”或“放热”)反应,反应的ΔH=_______ kJ· mol-1(用含E1、E2的代数式表示)。
②该反应过程中,断裂旧化学键吸收的总能量_______ (填“>”“ <”或“=”)形成新化学键释放的总能量
(3)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.

Ⅱ.
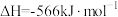
Ⅲ.
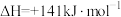
①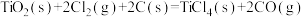 的
的
_______ 。
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1_______ Q2(填“>”、“<”或“=”)。
(1)在25℃,101 kPa下,氢气在1.00mol氧气中完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学方程式为
(2)某反应A(g)+B(g)= C(g)+D(g)过程中的能量变化如图所示,回答问题。

①该反应是
②该反应过程中,断裂旧化学键吸收的总能量
(3)由金红石(TiO2)制取单质Ti的步骤为:

已知:Ⅰ.


Ⅱ.

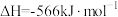
Ⅲ.

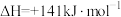
①
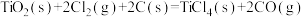 的
的
②若已知2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2
则Q1
您最近一年使用:0次
2022-09-18更新
|
256次组卷
|
3卷引用:湖北省武汉市东湖中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
9 . 研究含碳、氮的物质间转化的热效应,在日常生活与工业生产中均有很重要的意义。
(1)已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。
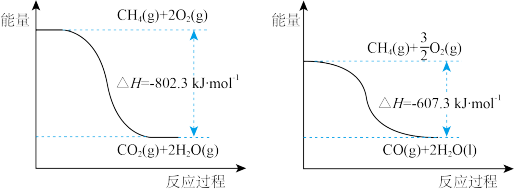
①写出表示甲烷燃烧热的热化学方程式:_______ 。
②CO的燃烧热△H=_______ kJ·mol-1。
(2)已知拆开1 molH-H、1 molN-H、1 mol N ≡N化学键需要的能量分别是436 kJ、391kJ、946kJ, 则N2与H2反应生成NH3的热化学方程式为_______ 。
(3)以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。
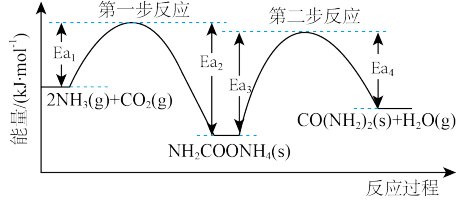
①第一步反应的热化学方程式为_______ 。
②第二步反应的△H_______ 0(填“>”、“<”或“=”)。
③从图象分析决定生产尿素的总反应的反应速率的步骤是第_______ 步反应。
(1)已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式:
②CO的燃烧热△H=
(2)已知拆开1 molH-H、1 molN-H、1 mol N ≡N化学键需要的能量分别是436 kJ、391kJ、946kJ, 则N2与H2反应生成NH3的热化学方程式为
(3)以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。

①第一步反应的热化学方程式为
②第二步反应的△H
③从图象分析决定生产尿素的总反应的反应速率的步骤是第
您最近一年使用:0次
2022-09-06更新
|
812次组卷
|
6卷引用:湖北省襄阳市第六中学2023-2024学年高二上学期10月月考化学试题
10 . 煤炭燃烧过程中会释放出大量的 ,直接排放含
,直接排放含 的烟气至空气中会形成酸雨,危害环境。
的烟气至空气中会形成酸雨,危害环境。
(1)利用钠碱循环法可脱除烟气中的 。
。
在钠碱循环法中, 溶液作为吸收液,试写出
溶液作为吸收液,试写出 溶液吸收
溶液吸收 ,反应的离子方程式:
,反应的离子方程式:_______ 。
(2)为减少 的排放,常采用“钙基固硫法”。
的排放,常采用“钙基固硫法”。
“钙基固硫法”即将生石灰和含硫的煤炭混合燃烧,将含硫煤炭产生的 转化为
转化为 ,则生石灰将
,则生石灰将 转化为
转化为 发生反应的化学方程式为
发生反应的化学方程式为_______ ,以该反应为原理处理1t含硫1.6%的煤炭时,理论上至少加入_______ kg生石灰。
(3)“钙基固硫”时煤炭燃烧过程中产生的CO会与 发生反应I和反应II,降低脱硫效率,反应I:
发生反应I和反应II,降低脱硫效率,反应I:
 ;反应II:
;反应II: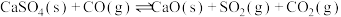

①反应I为_______ (填“吸热”或“放热”)反应。
②已知: 转化为
转化为 的能量关系如图所示。
的能量关系如图所示。

写出该反应的热化学方程式:_______ 。以该反应为原理,稀硫酸为电解质溶液,设计CO燃料电池,则CO由_______ (填“正极”或“负极”)通入,通入 的一极的电极反应式为
的一极的电极反应式为_______ 。
③根据上述反应。则

_______  。
。
 ,直接排放含
,直接排放含 的烟气至空气中会形成酸雨,危害环境。
的烟气至空气中会形成酸雨,危害环境。(1)利用钠碱循环法可脱除烟气中的
 。
。在钠碱循环法中,
 溶液作为吸收液,试写出
溶液作为吸收液,试写出 溶液吸收
溶液吸收 ,反应的离子方程式:
,反应的离子方程式:(2)为减少
 的排放,常采用“钙基固硫法”。
的排放,常采用“钙基固硫法”。“钙基固硫法”即将生石灰和含硫的煤炭混合燃烧,将含硫煤炭产生的
 转化为
转化为 ,则生石灰将
,则生石灰将 转化为
转化为 发生反应的化学方程式为
发生反应的化学方程式为(3)“钙基固硫”时煤炭燃烧过程中产生的CO会与
 发生反应I和反应II,降低脱硫效率,反应I:
发生反应I和反应II,降低脱硫效率,反应I:
 ;反应II:
;反应II: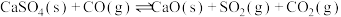

①反应I为
②已知:
 转化为
转化为 的能量关系如图所示。
的能量关系如图所示。
写出该反应的热化学方程式:
 的一极的电极反应式为
的一极的电极反应式为③根据上述反应。则


 。
。
您最近一年使用:0次



