名校
1 . (1)丙烷是一种优良的燃料,下图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图。试回答下列问题:

①写出表示丙烷燃烧热的热化学方程式:_________________________ 。
②二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ的热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ的热量,则混合气体中,丙烷和二甲醚的物质的量之比为_________________ 。
(2)盖斯定律认为:不管化学反应是一步完成或分步完成的,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g) H2O(l) ΔH1=-Q1kJ·mol-1
H2O(l) ΔH1=-Q1kJ·mol-1
C2H5OH(g) C2H5OH(l) ΔH2=-Q2kJ·mol-1
C2H5OH(l) ΔH2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g) 2CO2(g)+3H2O(g) ΔH3=-Q3kJ·mol-1
2CO2(g)+3H2O(g) ΔH3=-Q3kJ·mol-1
若使23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________ kJ。

①写出表示丙烷燃烧热的热化学方程式:
②二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ的热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ的热量,则混合气体中,丙烷和二甲醚的物质的量之比为
(2)盖斯定律认为:不管化学反应是一步完成或分步完成的,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g)
 H2O(l) ΔH1=-Q1kJ·mol-1
H2O(l) ΔH1=-Q1kJ·mol-1C2H5OH(g)
 C2H5OH(l) ΔH2=-Q2kJ·mol-1
C2H5OH(l) ΔH2=-Q2kJ·mol-1C2H5OH(g)+3O2(g)
 2CO2(g)+3H2O(g) ΔH3=-Q3kJ·mol-1
2CO2(g)+3H2O(g) ΔH3=-Q3kJ·mol-1若使23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
您最近一年使用:0次
名校
2 . 羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+ H2O(g) H2S(g) +CO2(g) △H=-34 kJ·mol1
H2S(g) +CO2(g) △H=-34 kJ·mol1
氢解反应:COS(g) +H2(g) H2S(g)+CO(g) △H=+7 kJ·mol1。
H2S(g)+CO(g) △H=+7 kJ·mol1。
已知:2H2(g) +O2(g)=== 2H2O(g) △H=-484 kJ·mol1。
写出表示CO燃烧热的热化学方程式:______________ 。
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率______ (填“增大”“减小”或“不变”,下同),COS 的转化率_______ 。
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5 min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5 min 内,v(H2S)=_______ mol·L-1·min-1。
②该温度下,上述水解反应的平衡常数K=____________ 。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+ H2O(g)
 H2S(g) +CO2(g) △H=-34 kJ·mol1
H2S(g) +CO2(g) △H=-34 kJ·mol1氢解反应:COS(g) +H2(g)
 H2S(g)+CO(g) △H=+7 kJ·mol1。
H2S(g)+CO(g) △H=+7 kJ·mol1。已知:2H2(g) +O2(g)=== 2H2O(g) △H=-484 kJ·mol1。
写出表示CO燃烧热的热化学方程式:
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5 min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5 min 内,v(H2S)=
②该温度下,上述水解反应的平衡常数K=
您最近一年使用:0次
2017-11-19更新
|
315次组卷
|
5卷引用:【全国省级联考】湖北省2017-2018学年高二下学期期末阶段摸底调研联合考试化学试题
3 . Ⅰ.(1)当1 g氨气完全分解为N2和H2时,吸收2.7kJ的热量,写出其热化学方程式:___________________________________________________________ 。
(2)HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和NaOH反应的中和热的热化学方程式为____________________________________________ 。
Ⅱ.已知下列反应,回答下列问题:
2CO(g)+O2(g)=2CO2(g) △H=﹣566kJ/mol ①
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) △H=﹣266kJ/mol ②
O2(g) △H=﹣266kJ/mol ②
(1)CO的燃烧热为______________ 。
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:______________________________________________________________ 。
(3)已知反应①中的相关的化学键键能数据如下:则a=____________ kJ/mol
(2)HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和NaOH反应的中和热的热化学方程式为
Ⅱ.已知下列反应,回答下列问题:
2CO(g)+O2(g)=2CO2(g) △H=﹣566kJ/mol ①
Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g) △H=﹣266kJ/mol ②
O2(g) △H=﹣266kJ/mol ②(1)CO的燃烧热为
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:
(3)已知反应①中的相关的化学键键能数据如下:则a=
| 化学键 | C=O(CO2) | C  O(CO) O(CO) | O=O |
| E/(kJ.mol-1) | 803.5 | 1076 | a |
您最近一年使用:0次
4 . 氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g) 2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g) 2NH3(g) △H=
2NH3(g) △H=___________ kJ·mol-1。
(2)在恒温恒容容积为a L的密闭容器中进行合成氨的反应,起始加入N2 1.0 molH23.0 mol。
①该温度下合成氨反应的平衡常数表达式为__________________ ;
②经过2min达到化学平衡状态时测得H2的转化率为40%,则平均化学反应速率v(NH3)__________ ;
③若其它条件不变增大压强,则合成氨反应的化学平衡常数____________ (填“变大”、“变小或“不变”);
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2 (g)的平衡转化率随X的变化关系。
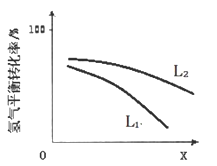
i .X代表的物理量是________________ ,
ii.判断L1、L2的大小关系____________ (填“>”“ <”或“ = ”),并简述理由:______________ 。
(1)已知25℃时:N2(g)+O2(g)
 2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-12H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g)
 2NH3(g) △H=
2NH3(g) △H=(2)在恒温恒容容积为a L的密闭容器中进行合成氨的反应,起始加入N2 1.0 molH23.0 mol。
①该温度下合成氨反应的平衡常数表达式为
②经过2min达到化学平衡状态时测得H2的转化率为40%,则平均化学反应速率v(NH3)
③若其它条件不变增大压强,则合成氨反应的化学平衡常数
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2 (g)的平衡转化率随X的变化关系。

i .X代表的物理量是
ii.判断L1、L2的大小关系
您最近一年使用:0次
名校
5 . 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
请回答下列问题:
(1)反应②是________ (填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________ (用K1、K2表示);根据反应③判断ΔS___ 0(填“>”、“=”或“<”),在______ (填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v正________ v逆(填“>”、“=”或“<”)。
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) CO(g)+H2O(g) CO(g)+H2O(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v正
您最近一年使用:0次
2017-10-12更新
|
355次组卷
|
4卷引用:湖北省武汉市汉南区职教中心2019-2020学年高二上学期期中考试化学试题
湖北省武汉市汉南区职教中心2019-2020学年高二上学期期中考试化学试题甘肃省天水市第一中学2017-2018学年高二上学期第一阶段考试(理)化学试题(已下线)黄金30题系列++高二化学(选修4)+++大题好拿分【基础版】河北省秦皇岛市第一中学2020-2021学年高二上学期12月月考化学试题
名校
6 . (1)已知2 mol氢气燃烧生成液态水时放出572 kJ的热量,反应方程式是2H2(g)+O2(g)===2H2O(l)。请回答下列问题:
①该反应的生成物能量总和________ (填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量_____ (填“大于”、“小于”或“等于”)572 kJ。
(2) 2.3g有机物C2H6O和一定量的氧气混合点燃,恰好完全燃烧,生成CO2和液态水,并放出68.35kJ热量,则该反应的热化学方程式是________________________________ 。
(3) FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________________________ 。
①该反应的生成物能量总和
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量
(2) 2.3g有机物C2H6O和一定量的氧气混合点燃,恰好完全燃烧,生成CO2和液态水,并放出68.35kJ热量,则该反应的热化学方程式是
(3) FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)
 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是
您最近一年使用:0次
2017-10-11更新
|
220次组卷
|
3卷引用:湖北省宜昌市金东方高级中学2017-2018学年高二9月月考化学试题
名校
7 . 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇。
(1)已知①C(s)+O2(g)=CO2(g) ΔH1
则碳与水蒸气反应C(s)+2H2O(g) CO2(g)+2H2(g)的ΔH =
CO2(g)+2H2(g)的ΔH =________ 。
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH<0
CH3OH(g)+H2O(g)ΔH<0
①工业生产过程中CO2和H2的转化率________ (填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是_______________ (填两点)。
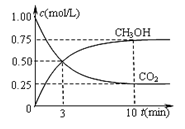
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如下图所示。该温度下的平衡常数为______ (保留三位有效数字)。
改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器).反应过程中部分数据见下表:
CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器).反应过程中部分数据见下表:
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)___ K(Ⅱ)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(Ⅰ)___ c(Ⅱ)。
②对反应Ⅰ,前10 min内的平均反应速率υ(CH3OH)=______ ,若30 min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_____ 移动(填“正向”、“逆向”或“不”)。
(1)已知①C(s)+O2(g)=CO2(g) ΔH1
②2H2(g)+O2(g)=2H2O (l) ΔH2
③H2O (l)= H2O (g) ΔH3
则碳与水蒸气反应C(s)+2H2O(g)
 CO2(g)+2H2(g)的ΔH =
CO2(g)+2H2(g)的ΔH =(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH<0
CH3OH(g)+H2O(g)ΔH<0①工业生产过程中CO2和H2的转化率
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如下图所示。该温度下的平衡常数为
改变温度,使反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器).反应过程中部分数据见下表:
CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器).反应过程中部分数据见下表:| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)
②对反应Ⅰ,前10 min内的平均反应速率υ(CH3OH)=
您最近一年使用:0次
2017-03-13更新
|
2603次组卷
|
3卷引用:2017届湖北省七市(州)高三第一次联合调考(3月联考)理科综合化学试卷
2017届湖北省七市(州)高三第一次联合调考(3月联考)理科综合化学试卷2017届湖南省长沙市长郡中学高三(实验班)第十次月考理综化学试卷(已下线)湖南省长沙市长郡中学2017届高三(实验班)第十次月考理综化学试题
8 . (1)甲醇蒸气转化为氢气的一种原理是CH3OH和H2O反应生成CO2和H2。
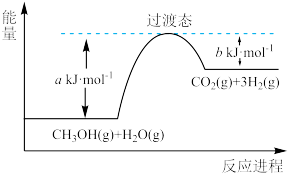
下图是该过程中能量变化示意图。若在反应体系中加入催化剂,反应速率增大,正反应活化能a的变化是_______ (填“增大”、“减小”或“不变”),反应热ΔH的变化是_______ (填“增大”、“减小”或“不变”)。请写出反应进程CH3OH(g)和H2O(g)反应的热化学方程式_______ 。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下4.48 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为_______ ,放出的热量为_______ kJ(用含有a和b的代数式表示)。

下图是该过程中能量变化示意图。若在反应体系中加入催化剂,反应速率增大,正反应活化能a的变化是
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下4.48 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为
您最近一年使用:0次
2016-12-09更新
|
285次组卷
|
2卷引用:2016-2017学年湖北省部分重点中学高二上学期期中化学试卷
9 . 经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.
(1)pM2.5的雾霾中能形成酸雨的物质是_______.
(2)为消除NOx对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体.
已知: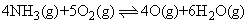 △H=-900.0 kJ·moL-1
△H=-900.0 kJ·moL-1
 △H=+180.0 kJ·moL-1
△H=+180.0 kJ·moL-1
已知NH3(g)与NO(g)在一定条件下反应,生成无污染气体,请写出转化过程的热化学反应方程式___________________.
(3)对于反应 ,在恒温恒容条件下,向密闭容器中加入等物质的N2和O2.下列方法中可以说明可逆反应已达平衡状态的是____________.
,在恒温恒容条件下,向密闭容器中加入等物质的N2和O2.下列方法中可以说明可逆反应已达平衡状态的是____________.
a.容器内压强不再变化
b.混合气体密度不再变化ZXXK]
c.混合气体的平均相对分子质量不再变化
d.NO的质量分数不再变化
(4)下图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4,阴极的电极反应式是________,物质A是_________(填名称)

(1)pM2.5的雾霾中能形成酸雨的物质是_______.
(2)为消除NOx对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体.
已知:
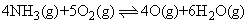 △H=-900.0 kJ·moL-1
△H=-900.0 kJ·moL-1 △H=+180.0 kJ·moL-1
△H=+180.0 kJ·moL-1已知NH3(g)与NO(g)在一定条件下反应,生成无污染气体,请写出转化过程的热化学反应方程式___________________.
(3)对于反应
 ,在恒温恒容条件下,向密闭容器中加入等物质的N2和O2.下列方法中可以说明可逆反应已达平衡状态的是____________.
,在恒温恒容条件下,向密闭容器中加入等物质的N2和O2.下列方法中可以说明可逆反应已达平衡状态的是____________.a.容器内压强不再变化
b.混合气体密度不再变化ZXXK]
c.混合气体的平均相对分子质量不再变化
d.NO的质量分数不再变化
(4)下图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4,阴极的电极反应式是________,物质A是_________(填名称)

您最近一年使用:0次
解题方法
10 . 按要求书写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_________________
(2)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)ΔH2=-393.5kJ/mol
③H2(g)+1/2O2(g)=H2O(l)ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_________________ 。
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
(2)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)ΔH2=-393.5kJ/mol
③H2(g)+1/2O2(g)=H2O(l)ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式
您最近一年使用:0次



