名校
1 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+ H2O(g) = CO(g)+3H2(g) ΔH =-206.2kJ·mol-1
CH4(g)+ CO2(g) = 2CO(g)+2H2(g) ΔH =-247.4kJ·kJmol-1
2H2S(g) = 2H2(g)+S2(g) ΔH =+169.8kJ·kJmol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为___________ 。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是___________ ;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式: ___________ 。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是___________ 。

已知:CH4(g)+ H2O(g) = CO(g)+3H2(g) ΔH =-206.2kJ·mol-1
CH4(g)+ CO2(g) = 2CO(g)+2H2(g) ΔH =-247.4kJ·kJmol-1
2H2S(g) = 2H2(g)+S2(g) ΔH =+169.8kJ·kJmol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是

您最近一年使用:0次
2016-12-09更新
|
125次组卷
|
2卷引用:2015-2016学年湖北省荆州中学高二上第一次月考化学试卷
2 . (1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)=2H2O(l)
(l)请回答下列问题:
①该反应的生成物能量总和________ (填“大于”、“小于”或“等于”)反应物能量总和。
②若2mol氢气完全燃烧生成水蒸气,则放出的热量________ (填“>”、“<”或“=”)572kJ。
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点______________________ 。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1= -197kJ·mol-1;
2SO3(g) ΔH1= -197kJ·mol-1;
H2O(g)=H2O(l)ΔH2= -44kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3= -545kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________________________________ 。
(l)请回答下列问题:
①该反应的生成物能量总和
②若2mol氢气完全燃烧生成水蒸气,则放出的热量
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
2SO2(g)+O2(g)
 2SO3(g) ΔH1= -197kJ·mol-1;
2SO3(g) ΔH1= -197kJ·mol-1;H2O(g)=H2O(l)ΔH2= -44kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3= -545kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是
您最近一年使用:0次
2016-12-09更新
|
610次组卷
|
7卷引用:湖北省巴东县第二高级中学2020-2021学年高二上学期期中考试化学试题
湖北省巴东县第二高级中学2020-2021学年高二上学期期中考试化学试题2015-2016学年云南省开远四中高二下学期期中化学试卷【校级联考】河北省鸡泽县第一中学2018-2019学年高一下学期3月月考化学试题甘肃省镇原县镇原中学2019-2020学年高二上学期第一次月考化学试题云南省昆明师范专科学校附属中学2020-2021学年高二上学期期中考试化学试题(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
2014高三·全国·专题练习
解题方法
3 . 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为_______ ;
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式_______ ;
(3)已知H2O(l)=H2O(g) ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为_______ 。
(4)肼-空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为_______ 。
(1)氮元素原子的L层电子数为
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式
(3)已知H2O(l)=H2O(g) ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为
(4)肼-空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为
您最近一年使用:0次
11-12高二上·湖北黄冈·期中
解题方法
4 . 按要求回答下列问题:
(1)已知在200℃,101kPa时,H2与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为_______________________________________ 。
(2)太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量。已知下列数据:
其中最适宜作为储能介质的是________ 。(选填物质序号)
(3)离子晶体晶格能的定义是气态离子形成1mol离子晶体释放的能量,通常取正值。现已知: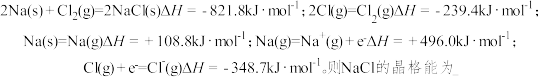
______________ 。
(1)已知在200℃,101kPa时,H2与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为
(2)太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量。已知下列数据:
| 序号 | 盐 | 熔点/℃ | 熔化热/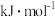 | 参考价格/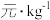 |
| ① | CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
| ② | Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
| ③ | Na2HPO4·12H2O | 36.1 | 100.1 | 1800~2400 |
| ④ | Na2SiO3·5H2O | 52.5 | 49.7 | 1400~1800 |
其中最适宜作为储能介质的是
(3)离子晶体晶格能的定义是气态离子形成1mol离子晶体释放的能量,通常取正值。现已知:
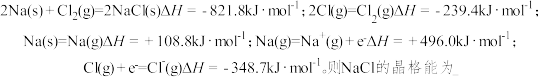
您最近一年使用:0次
11-12高二上·湖北襄阳·期中
5 . 2009年“六·五”世界环境日,中国主题是“减少污染——行动起来”,这向世界传达了建设环境友好型社会的理念。已知反应:
①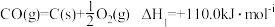
②2CO(g)+O2(g)=2CO2(g) ∆H2=-566.0kJ/mol
请回答下列问题:
(1)反应①的熵变∆S______ (填“>”或“<”)0。
(2)有人建议,汽车尾气中的CO可用催化加热分解的方法来消除(反应①),这一方案在理论上是否可行?______ (填“可行”或“不可行”)。
(3)反应②中的∆H2是不是CO的燃烧热?______ (填“是”或“不是”)。
(4)煤炭的充分燃烧也是建设环境友好型社会的一个重要方面,12 g C(s)完全燃烧生成CO2(g)时,放出的热量为______ kJ(依据反应①、②计算)。
①
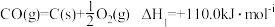
②2CO(g)+O2(g)=2CO2(g) ∆H2=-566.0kJ/mol
请回答下列问题:
(1)反应①的熵变∆S
(2)有人建议,汽车尾气中的CO可用催化加热分解的方法来消除(反应①),这一方案在理论上是否可行?
(3)反应②中的∆H2是不是CO的燃烧热?
(4)煤炭的充分燃烧也是建设环境友好型社会的一个重要方面,12 g C(s)完全燃烧生成CO2(g)时,放出的热量为
您最近一年使用:0次
10-11高二上·湖北·期中
名校
6 . 红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1 mol产物的数据)根据上图回答下列问题
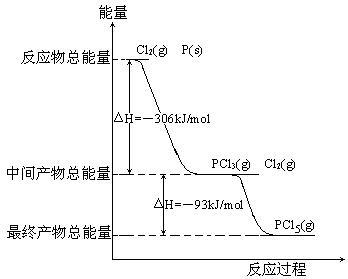
(1)P和Cl2反应生成PCl3的热化学方程式:____________________________ ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式:___________________________ ;
温度T1时,在密闭容器中加入0.8 mol PCl5 ,反应达到平衡时还剩余0.6 mol PCl5 ,其分解率α1等于____________ ;
(3)P和Cl2分两步反应生成1mol PCl5的△H3=_______________________ ;P和Cl2一步反应生成1 mol PCl5的△H4_____ △H3(填“大于”,“小于”或“等于”) 。

(1)P和Cl2反应生成PCl3的热化学方程式:
(2)PCl5分解生成PCl3和Cl2的热化学方程式:
温度T1时,在密闭容器中加入0.8 mol PCl5 ,反应达到平衡时还剩余0.6 mol PCl5 ,其分解率α1等于
(3)P和Cl2分两步反应生成1mol PCl5的△H3=
您最近一年使用:0次
2016-12-09更新
|
482次组卷
|
7卷引用:2010年湖北省襄樊市四校联考-高二上学期期中考试化学卷
(已下线)2010年湖北省襄樊市四校联考-高二上学期期中考试化学卷(已下线)2011-2012年河南省长葛市第三实验高中高二上学期第一次月考化学试卷2015-2016学年河北省容城中学高二上学期第一次月考化学试卷2015-2016学年西藏拉萨中学高二上第一次月考化学试卷甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题黑龙江省大庆十中2017-2018学年高一下学期期末考试化学试题人教版高二化学选修四专题:化学反应热的计算同步练习卷
11-12高二上·湖北武汉·期末
7 . 能源是人类生存和发展的重要支柱。研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义。
(1)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g) =CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH=______ kJ/moL
(2)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
① 图中反应的ΔH=____________ kJ/mol(用含有E1、E2代数式表示)。

② 已知热化学方程式:H2(g)+1/2O2(g) = H2O(g) ΔH=-241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为________ kJ/mol。
③ 图中虚线(II)与实线(I) 对于同一反应具有的意义:
____________________________________________________________________ 。
(1)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g) =CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH=
(2)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
① 图中反应的ΔH=

② 已知热化学方程式:H2(g)+1/2O2(g) = H2O(g) ΔH=-241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为
③ 图中虚线(II)与实线(I) 对于同一反应具有的意义:
您最近一年使用:0次
9-10高二下·湖北孝感·期末
8 . (1)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3 + MnSO4 + H2SO4===Na2SO4 + Bi2(SO4)3 + NaMnO4 + H2O
①上述反应中还原产物是____________ ,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将____________ molHCl氧化成Cl2;
②写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式______________ 。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(L)===2H2O(L)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为______________ 。
NaBiO3 + MnSO4 + H2SO4===Na2SO4 + Bi2(SO4)3 + NaMnO4 + H2O
①上述反应中还原产物是
②写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(L)===2H2O(L)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+
 O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
O2(g)===H2O(L) ΔH=-285.84kJ·mol-1在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
您最近一年使用:0次
9 . 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g)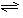 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______ 移动(填“向左”“向右”或“不”);,使用催化剂_____ 反应的ΔH(填“增大”“减小”或“不改变”)。
(2)O2(g)= O+2(g)+e- H1=1175.7kJ·mol-1
H1=1175.7kJ·mol-1
PtF6(g)+ e-1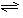 PtF6-(g)
PtF6-(g) H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H=
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________ 沉淀(填化学式),生成该沉淀的离子方程式为____________ 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________ 性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________ 。
(1)合成氨反应反应N2(g)+3H2(g)
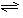 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡(2)O2(g)= O+2(g)+e-
 H1=1175.7kJ·mol-1
H1=1175.7kJ·mol-1PtF6(g)+ e-1
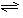 PtF6-(g)
PtF6-(g) H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1O2+PtF6-(s)=O2+(g)+PtF6-
 H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
 H=
H=(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
您最近一年使用:0次
2016-12-09更新
|
1607次组卷
|
9卷引用:2011-2012学年湖北省荆州中学高二上学期期中考试化学试卷
(已下线)2011-2012学年湖北省荆州中学高二上学期期中考试化学试卷2009年普通高等学校招生统一考试理综试题化学部分(山东卷)(已下线)2009学年中山一中、翠园中学、宝安中学高三联考化学试题(已下线)2010—2011学年浙江省杭州二中高二下二学期期中考试化学试卷(已下线)2012届高考化学一轮复习《溶液中的离子反应》专题综合测试(苏教版)(已下线)2011-2012学年吉林省长春二中高二上学期期末考试化学试卷2015-2016学年四川省彭州中学高二下2月月考化学试卷山西省朔州市怀仁一中2018-2019学年高二上学期第五次月考化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)
10 . 请认真分析下图,然后回答问题:

①图中所示反应是____________ (填“吸热”或“放热”)反应,该反应的△H=________ (用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+1/2O2(g)=H2O(g);△H=-241.8 kJ/mol。该反应的活化能为167.2kJ/mol,则其逆反应的活化能为____________ 。
③对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是_________

①图中所示反应是
②已知热化学方程式:H2(g)+1/2O2(g)=H2O(g);△H=-241.8 kJ/mol。该反应的活化能为167.2kJ/mol,则其逆反应的活化能为
③对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是
您最近一年使用:0次



