运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g)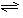 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______ 移动(填“向左”“向右”或“不”);,使用催化剂_____ 反应的ΔH(填“增大”“减小”或“不改变”)。
(2)O2(g)= O+2(g)+e- H1=1175.7kJ·mol-1
H1=1175.7kJ·mol-1
PtF6(g)+ e-1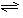 PtF6-(g)
PtF6-(g) H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H=
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________ 沉淀(填化学式),生成该沉淀的离子方程式为____________ 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________ 性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________ 。
(1)合成氨反应反应N2(g)+3H2(g)
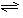 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡(2)O2(g)= O+2(g)+e-
 H1=1175.7kJ·mol-1
H1=1175.7kJ·mol-1PtF6(g)+ e-1
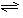 PtF6-(g)
PtF6-(g) H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1O2+PtF6-(s)=O2+(g)+PtF6-
 H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
 H=
H=(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
2009·山东·高考真题 查看更多[9]
2009年普通高等学校招生统一考试理综试题化学部分(山东卷)(已下线)2009学年中山一中、翠园中学、宝安中学高三联考化学试题(已下线)2010—2011学年浙江省杭州二中高二下二学期期中考试化学试卷(已下线)2012届高考化学一轮复习《溶液中的离子反应》专题综合测试(苏教版)(已下线)2011-2012学年湖北省荆州中学高二上学期期中考试化学试卷(已下线)2011-2012学年吉林省长春二中高二上学期期末考试化学试卷2015-2016学年四川省彭州中学高二下2月月考化学试卷山西省朔州市怀仁一中2018-2019学年高二上学期第五次月考化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)
更新时间:2016-12-09 00:20:08
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】肼(N2H4)是一种无色油状液体,沸点113.5℃,具有强还原性。能与NaClO剧烈反应生成N2。
(1)N2H4分子中N的化合价为___________
(2)N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃)、沸点(114℃)分别远高于O2的熔点(-218℃)、沸点(-183℃),原因是___________ 。
(3)由碱性NaClO溶液和尿素 反应可获得
反应可获得 ,反应原理为:
,反应原理为: 。实验中反应物的加料方式为
。实验中反应物的加料方式为___________ (填序号)。
A.将尿素滴加到碱性NaClO溶液中 B.将碱性NaClO溶液滴加到尿素中
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应生成氮气与水蒸气。已知32g液态肼在上述反应中放出64.22kJ的热量,该反应的热化学方程式为___________ 。
(5)肼-空气燃料电池是一种新型环保电池,(用KOH溶液作电解液),该电池负极的电极反应式为___________ 。
(6)H2是一种理想的绿色清洁能源,N2H4催化分解制氢是能源利用领域的研究热点。在温和条件下,负载型双金属合金M催化N2H4迅速分解,并且制氢选择性可达100%,可能机理如图所示(图中“虚线”表示吸附在催化剂上)。请将N2H4催化分解制氢的机理补充完整:N2H4吸附在(催化剂)M表面,连续断裂___________ 键,形成N2H3、___________ 和N2H等中间产物,直至H原子全部脱去,最终生成___________ 。
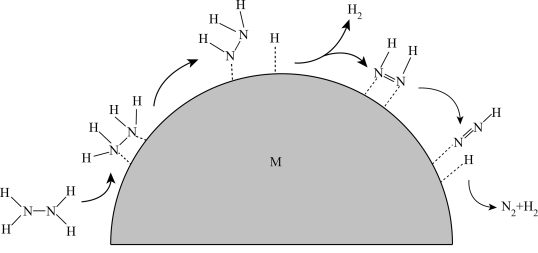
(1)N2H4分子中N的化合价为
(2)N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃)、沸点(114℃)分别远高于O2的熔点(-218℃)、沸点(-183℃),原因是
(3)由碱性NaClO溶液和尿素
 反应可获得
反应可获得 ,反应原理为:
,反应原理为: 。实验中反应物的加料方式为
。实验中反应物的加料方式为A.将尿素滴加到碱性NaClO溶液中 B.将碱性NaClO溶液滴加到尿素中
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应生成氮气与水蒸气。已知32g液态肼在上述反应中放出64.22kJ的热量,该反应的热化学方程式为
(5)肼-空气燃料电池是一种新型环保电池,(用KOH溶液作电解液),该电池负极的电极反应式为
(6)H2是一种理想的绿色清洁能源,N2H4催化分解制氢是能源利用领域的研究热点。在温和条件下,负载型双金属合金M催化N2H4迅速分解,并且制氢选择性可达100%,可能机理如图所示(图中“虚线”表示吸附在催化剂上)。请将N2H4催化分解制氢的机理补充完整:N2H4吸附在(催化剂)M表面,连续断裂

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】煤炭可以转化为清洁能源和化工原料。
⑴用煤可以制得水煤气,其化学反应方程式为________________________________ 。
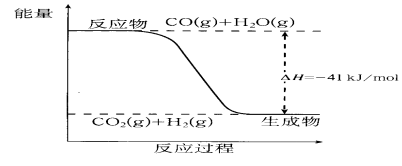
⑵已知一氧化碳与水蒸气反应过程的能量变化如图所示。则此反应为_________ (填“放热”或“吸热”)反应,反应的热化学方程式为___________________________________ 。
⑶已知1mol C完全转化为水煤气时吸收热量131.5kJ,则1mol C与CO2反应生成CO吸收热量______ kJ。

⑴用煤可以制得水煤气,其化学反应方程式为
⑵已知一氧化碳与水蒸气反应过程的能量变化如图所示。则此反应为
⑶已知1mol C完全转化为水煤气时吸收热量131.5kJ,则1mol C与CO2反应生成CO吸收热量
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
H2(g)+ O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
则CO(g)+2H2(g) CH3OH(g) ΔH=
CH3OH(g) ΔH=__ kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是__ (填写序号)。
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1__ p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=__ (mol·L-1)-2;
③在其它条件不变的情况下,再增加amolCO和2amolH2,达到新平衡时,CO的转化率__ (填“增大”、“减小”或“不变”)。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+
 O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ·mol-1CO(g)+
 O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1H2(g)+
 O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8kJ·mol-1则CO(g)+2H2(g)
 CH3OH(g) ΔH=
CH3OH(g) ΔH=(2)下列措施中能够增大上述合成甲醇反应的反应速率的是
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1
②100℃时,该反应的化学平衡常数K=
③在其它条件不变的情况下,再增加amolCO和2amolH2,达到新平衡时,CO的转化率
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】I.目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应过程中能量的变化。
CH3OH(g)+H2O(g),如图表示该反应过程中能量的变化。
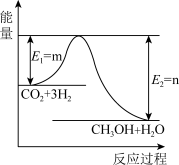
(1)该反应为____ 反应(“吸热”或“放热”)。
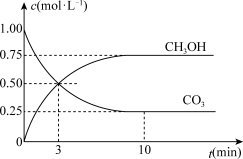
(2)在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=____ 。反应达到平衡时CO2的转化率为____ 。平衡时CH3OH的体积分数为____ 。
II.在298K时,将0.1molN2O4气体充入1L抽空的密闭容器中,回答下列问题:
(3)当反应达到平衡时,对于反应N2O4(g) 2NO2(g),改变某一条件后,下列说法中,一定能说明化学平衡向正反应方向移动的是
2NO2(g),改变某一条件后,下列说法中,一定能说明化学平衡向正反应方向移动的是____ (填序号)。
①气体颜色加深②NO2的体积分数增加③单位时间内消耗N2O4和NO2的物质的量之比大于1∶2④恒温恒压充入He
(4)达到平衡后下列条件的改变可使NO2反应速率增大的是____ (填字母序号)。
a.扩大容器的容积 b.再充入一定量的N2O4 c.分离出一定量的NO2
(5)在固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)。已知Fe3+对H2O2的分解具有催化作用。利用如图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的
N2O4(g)。已知Fe3+对H2O2的分解具有催化作用。利用如图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的____ (填“深”或“浅”),其原因是____ 。

 CH3OH(g)+H2O(g),如图表示该反应过程中能量的变化。
CH3OH(g)+H2O(g),如图表示该反应过程中能量的变化。
(1)该反应为
(2)在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=

II.在298K时,将0.1molN2O4气体充入1L抽空的密闭容器中,回答下列问题:
(3)当反应达到平衡时,对于反应N2O4(g)
 2NO2(g),改变某一条件后,下列说法中,一定能说明化学平衡向正反应方向移动的是
2NO2(g),改变某一条件后,下列说法中,一定能说明化学平衡向正反应方向移动的是①气体颜色加深②NO2的体积分数增加③单位时间内消耗N2O4和NO2的物质的量之比大于1∶2④恒温恒压充入He
(4)达到平衡后下列条件的改变可使NO2反应速率增大的是
a.扩大容器的容积 b.再充入一定量的N2O4 c.分离出一定量的NO2
(5)在固定体积的密闭容器中,发生可逆反应:2NO2(g)
 N2O4(g)。已知Fe3+对H2O2的分解具有催化作用。利用如图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的
N2O4(g)。已知Fe3+对H2O2的分解具有催化作用。利用如图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】利用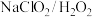 酸性复合吸收剂可同时对
酸性复合吸收剂可同时对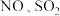 进行氧化得到硝酸和硫酸而除去。在温度一定时,
进行氧化得到硝酸和硫酸而除去。在温度一定时, 、溶液
、溶液 对脱硫脱硝的影响如图所示:
对脱硫脱硝的影响如图所示:
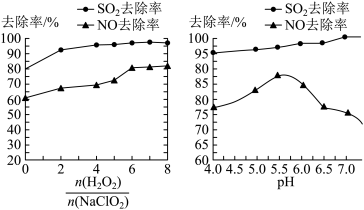
由图所示可知脱硫脱硝最佳条件是____________________________________ 。
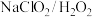 酸性复合吸收剂可同时对
酸性复合吸收剂可同时对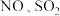 进行氧化得到硝酸和硫酸而除去。在温度一定时,
进行氧化得到硝酸和硫酸而除去。在温度一定时, 、溶液
、溶液 对脱硫脱硝的影响如图所示:
对脱硫脱硝的影响如图所示:
由图所示可知脱硫脱硝最佳条件是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】1.反应
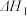 ,平衡常数为
,平衡常数为 ;
;
反应
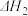 ,平衡常数为
,平衡常数为 。
。
在不同温度时 、
、 的值如下表:
的值如下表:
反应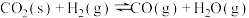
 ,平衡常数为K,
,平衡常数为K,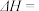
__________ (用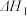 和
和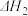 表示),
表示),
__________ (用 和
和 表示),且由上述计算可知,反应
表示),且由上述计算可知,反应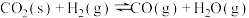 是
是__________ (填“吸热”或“放热”)反应。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 气体,发生反应
气体,发生反应
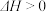 ,
, 的浓度与时间的关系如图所示:
的浓度与时间的关系如图所示:
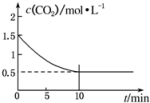
①该条件下反应的平衡常数为__________ 。
②下列措施中能使平衡时K增大的是__________ (填序号)
A.升高温度 B.增大压强
C.充入一定量的 D.再加入一定量铁粉
D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是__________ (填字母)。
a.容器中压强不变
b.气体的密度不再改变
c.
d.
e.容器内气体总物质的量不变

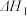 ,平衡常数为
,平衡常数为 ;
;反应

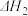 ,平衡常数为
,平衡常数为 。
。在不同温度时
 、
、 的值如下表:
的值如下表:| 平衡常数 |  |  |
 | 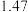 | 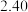 |
 | 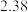 | 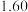 |
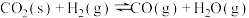
 ,平衡常数为K,
,平衡常数为K,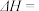
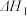 和
和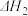 表示),
表示),
 和
和 表示),且由上述计算可知,反应
表示),且由上述计算可知,反应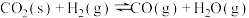 是
是(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
 气体,发生反应
气体,发生反应
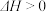 ,
, 的浓度与时间的关系如图所示:
的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为
②下列措施中能使平衡时K增大的是
A.升高温度 B.增大压强
C.充入一定量的
 D.再加入一定量铁粉
D.再加入一定量铁粉③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是
a.容器中压强不变
b.气体的密度不再改变
c.

d.

e.容器内气体总物质的量不变
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,浓度均为0.1 mol/L的6种溶液的pH如表:
(1)上述溶液中的阴离子结合H+能力最弱的为_______ 。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是_______ (用化学方程式表示)。将溶液加热蒸干最后得到的固体产物是_______ ;
(3)结合表中数据分析,与0.1 mol/L的CH3COONa溶液中水的电离程度相同的有_______ (填字母代号)。
A.pH=8.8的NaOH溶液
B. pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.1 mol/L的NaCN溶液
E.pH=8. 8的Na2CO3溶液
(4)将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度关系正确的有_______ 。
A.c(Na+)= c(CO ) +c(HCO
) +c(HCO ) +c(H2CO3)
) +c(H2CO3)
B. 2c(Na+)=3c(CO ) +3c(HCO
) +3c(HCO ) +3c(H2CO3)
) +3c(H2CO3)
C. c(OH-)= c(H+) +c(HCO ) +2c(H2CO3)
) +2c(H2CO3)
D. c(Na+) +c(H+) = 2c(CO ) +c(HCO
) +c(HCO ) +c(OH-)
) +c(OH-)
E. c(Na+)>c(HCO )> c(CO
)> c(CO ) > c(OH-)> c(H+)
) > c(OH-)> c(H+)
F. c(Na+)> c(CO ) > c(HCO
) > c(HCO ) > c(H+)> c(OH-)
) > c(H+)> c(OH-)
(5)0.1 mol/LHCl与0.1 mol/L Na2CO3溶液等体积混合后溶液中各离子浓度大小关系为_______ 。
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8. 8 | 9. 7 | 11. 6 | 10. 3 | 11. 1 | 11. 3 |
(1)上述溶液中的阴离子结合H+能力最弱的为
(2)NaAlO2溶液呈碱性的原因是
(3)结合表中数据分析,与0.1 mol/L的CH3COONa溶液中水的电离程度相同的有
A.pH=8.8的NaOH溶液
B. pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.1 mol/L的NaCN溶液
E.pH=8. 8的Na2CO3溶液
(4)将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度关系正确的有
A.c(Na+)= c(CO
 ) +c(HCO
) +c(HCO ) +c(H2CO3)
) +c(H2CO3)B. 2c(Na+)=3c(CO
 ) +3c(HCO
) +3c(HCO ) +3c(H2CO3)
) +3c(H2CO3)C. c(OH-)= c(H+) +c(HCO
 ) +2c(H2CO3)
) +2c(H2CO3)D. c(Na+) +c(H+) = 2c(CO
 ) +c(HCO
) +c(HCO ) +c(OH-)
) +c(OH-)E. c(Na+)>c(HCO
 )> c(CO
)> c(CO ) > c(OH-)> c(H+)
) > c(OH-)> c(H+)F. c(Na+)> c(CO
 ) > c(HCO
) > c(HCO ) > c(H+)> c(OH-)
) > c(H+)> c(OH-)(5)0.1 mol/LHCl与0.1 mol/L Na2CO3溶液等体积混合后溶液中各离子浓度大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】常温下,有浓度均为0.1mol·L 的下列4种溶液:①NaCN溶液、②NaOH溶液、③CH3COONa溶液、④Na2CO3溶液。
的下列4种溶液:①NaCN溶液、②NaOH溶液、③CH3COONa溶液、④Na2CO3溶液。
(1)这4种溶液的pH由大到小的顺序是____________ (填序号)。
(2)NaCN溶液呈碱性的原因是_____________ (用离子方程式说明)。
(3)若向等体积的③和④中分别滴加盐酸至溶液呈中性,则消耗盐酸的体积③_____ (填“>”、“<”或“=”)④。
(4)25℃时,将 mol·L
mol·L 的醋酸和0.1mol·L
的醋酸和0.1mol·L NaOH溶液等体积混合后,溶液的pH=7,则
NaOH溶液等体积混合后,溶液的pH=7,则
___ (填“>”、“<”或“=”)0.1。
(5)向NaCN溶液中通入CO2,则发生反应的离子方程式为_________ 。
 的下列4种溶液:①NaCN溶液、②NaOH溶液、③CH3COONa溶液、④Na2CO3溶液。
的下列4种溶液:①NaCN溶液、②NaOH溶液、③CH3COONa溶液、④Na2CO3溶液。| HCN | H2CO3 | CH3COOH |
Ka=4.9×10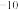 | Ka1=4.5×10 Ka2=4.7×10  | Ka=1.7×10 |
(2)NaCN溶液呈碱性的原因是
(3)若向等体积的③和④中分别滴加盐酸至溶液呈中性,则消耗盐酸的体积③
(4)25℃时,将
 mol·L
mol·L 的醋酸和0.1mol·L
的醋酸和0.1mol·L NaOH溶液等体积混合后,溶液的pH=7,则
NaOH溶液等体积混合后,溶液的pH=7,则
(5)向NaCN溶液中通入CO2,则发生反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】填空。
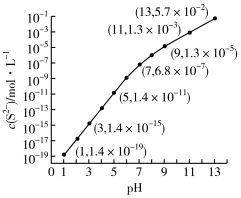
(1)25℃,在0.10 mol/LH2S溶液中,通入HCl气体成加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的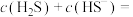
___________ mol/L;
②某溶液含0.020 mol/L Mn2+、0.10mol/LH2S,当溶液pH=___________ 时,Mn2+开始沉淀[已知: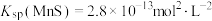 ]。
]。
(2)25℃,两种酸的电离平衡常数如下表。
①0.10 mol/LNaHSO3溶液中离子浓度由大到小的顺序为___________ 。
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为___________ 。
(3)银是一种费金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。已知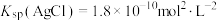 ,若向5 mL0.018 mol/L的AgNO3溶液中加入5 mL0.020 mol/L的盐酸,混合后溶液中的Ag+的浓度为
,若向5 mL0.018 mol/L的AgNO3溶液中加入5 mL0.020 mol/L的盐酸,混合后溶液中的Ag+的浓度为___________ mol/L。
(1)25℃,在0.10 mol/LH2S溶液中,通入HCl气体成加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的
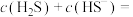
②某溶液含0.020 mol/L Mn2+、0.10mol/LH2S,当溶液pH=
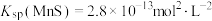 ]。
]。
(2)25℃,两种酸的电离平衡常数如下表。
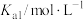 |  | |
| H2SO3 | 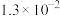 | 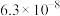 |
| H2CO3 | 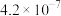 | 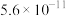 |
①0.10 mol/LNaHSO3溶液中离子浓度由大到小的顺序为
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为
(3)银是一种费金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。已知
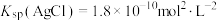 ,若向5 mL0.018 mol/L的AgNO3溶液中加入5 mL0.020 mol/L的盐酸,混合后溶液中的Ag+的浓度为
,若向5 mL0.018 mol/L的AgNO3溶液中加入5 mL0.020 mol/L的盐酸,混合后溶液中的Ag+的浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】根据所学知识回答下列问题。
(1)已知Ksp(BaCO3) =2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①BaCO3在20 mL 0.01 mol·L-1Na2CO3溶液中的Ksp_________ (填“大于”、“小于”或“等于”)其在20 mL 0.01 mol·L-1 BaCl2溶液中的Ksp
②现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为_______ mol/L。
③向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中c(CO32—)/c(SO42—)=___________ (保留三位有效数字)。
(2)已知25℃ 时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是_______________ 。(填写序号);b中氯离子的浓度为__________ mol/L。
(1)已知Ksp(BaCO3) =2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①BaCO3在20 mL 0.01 mol·L-1Na2CO3溶液中的Ksp
②现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为
③向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中c(CO32—)/c(SO42—)=
(2)已知25℃ 时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是
您最近一年使用:0次
【推荐3】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+和Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_______ ,离子方程式____________________________ 。
(2) 和
和 在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c( )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
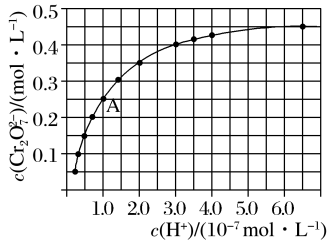
①当溶液酸性增强的时候,溶液颜色变化情况为:_________________ 。
②由图可知,溶液酸性增大, 的平衡转化率
的平衡转化率_________ (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________ 。
③升高温度,溶液中 的平衡转化率减小,则该反应的ΔH
的平衡转化率减小,则该反应的ΔH_____ 0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol⋅L−1)时,溶液中c(Ag+)
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol⋅L−1)时,溶液中c(Ag+)___ mol⋅L−1,此时溶液中c( )等于
)等于_____ mol⋅L−1 (已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(1)Cr3+和Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
(2)
 和
和 在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c( )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
①当溶液酸性增强的时候,溶液颜色变化情况为:
②由图可知,溶液酸性增大,
 的平衡转化率
的平衡转化率③升高温度,溶液中
 的平衡转化率减小,则该反应的ΔH
的平衡转化率减小,则该反应的ΔH(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与
 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol⋅L−1)时,溶液中c(Ag+)
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol⋅L−1)时,溶液中c(Ag+) )等于
)等于
您最近一年使用:0次



