名校
解题方法
1 . 完成下列问题
(1)0.1mol 完全燃烧生成液态水和
完全燃烧生成液态水和 ,放出88.96kJ热量,
,放出88.96kJ热量, 的燃烧热为
的燃烧热为
___________ kJ/mol。
(2)单斜硫和正交硫转化为 的能量变化图如图。
的能量变化图如图。
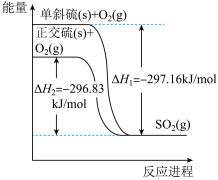
32g单斜硫转化为正交硫的反应热为
___________ kJ/mol,单斜硫比正交硫的稳定性___________ (填“强”或“弱”)。
(3) 和
和 在一定条件下能发生反应:
在一定条件下能发生反应: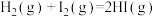
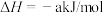
已知:
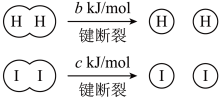 a、b、c均大于零
a、b、c均大于零
断开1mol H-I键所需能量为___________ kJ/mol。
(1)0.1mol
 完全燃烧生成液态水和
完全燃烧生成液态水和 ,放出88.96kJ热量,
,放出88.96kJ热量, 的燃烧热为
的燃烧热为
(2)单斜硫和正交硫转化为
 的能量变化图如图。
的能量变化图如图。
32g单斜硫转化为正交硫的反应热为

(3)
 和
和 在一定条件下能发生反应:
在一定条件下能发生反应: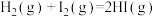
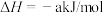
已知:
 a、b、c均大于零
a、b、c均大于零断开1mol H-I键所需能量为
您最近一年使用:0次
名校
2 .  的资源化利用能有效减少
的资源化利用能有效减少 排放,充分利用碳资源。
排放,充分利用碳资源。
(1)电解法转化 可实现
可实现 资源化利用。电解
资源化利用。电解 制
制 的原理示意图如下。
的原理示意图如下。

①写出阴极 还原为
还原为 的电极反应式:
的电极反应式:_______ 。
②电解一段时间后,阳极区的 溶液浓度降低,结合化学用语解释其原因
溶液浓度降低,结合化学用语解释其原因_______ 。
(2)用 还原
还原 可以在一定条件下合成
可以在一定条件下合成 (不考虑副反应):
(不考虑副反应):
①某温度下,恒容密闭容器中, 和
和 的起始浓度分别为
的起始浓度分别为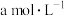 和
和 反应平衡时,
反应平衡时, 的产率为b,该温度下反应平衡常数的值为
的产率为b,该温度下反应平衡常数的值为_______ 。

②恒压下, 和
和 的起始物质的量比为
的起始物质的量比为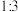 时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如右图所示,其中分子筛膜能选择性分离出
时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如右图所示,其中分子筛膜能选择性分离出 。
。

a.甲醇平衡产率随温度升高而降低的原因为_______ 。
b.P点甲醇产率高于T点的原因为_______ 。
(3) 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:
反应I:

反应II:

在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图。其中:
的选择性随温度的变化如图。其中:


①温度高于 ,
, 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是_______ 。
② 时,在催化剂作用下
时,在催化剂作用下 和
和 反应一段时间后,测得
反应一段时间后,测得 的选择性为
的选择性为 (图中A点)。此时,不改变反应时间和温度,能提高
(图中A点)。此时,不改变反应时间和温度,能提高 选择性的措施是
选择性的措施是_______ (答出1点即可)
 的资源化利用能有效减少
的资源化利用能有效减少 排放,充分利用碳资源。
排放,充分利用碳资源。(1)电解法转化
 可实现
可实现 资源化利用。电解
资源化利用。电解 制
制 的原理示意图如下。
的原理示意图如下。
①写出阴极
 还原为
还原为 的电极反应式:
的电极反应式:②电解一段时间后,阳极区的
 溶液浓度降低,结合化学用语解释其原因
溶液浓度降低,结合化学用语解释其原因(2)用
 还原
还原 可以在一定条件下合成
可以在一定条件下合成 (不考虑副反应):
(不考虑副反应):
①某温度下,恒容密闭容器中,
 和
和 的起始浓度分别为
的起始浓度分别为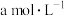 和
和 反应平衡时,
反应平衡时, 的产率为b,该温度下反应平衡常数的值为
的产率为b,该温度下反应平衡常数的值为
②恒压下,
 和
和 的起始物质的量比为
的起始物质的量比为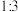 时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如右图所示,其中分子筛膜能选择性分离出
时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如右图所示,其中分子筛膜能选择性分离出 。
。
a.甲醇平衡产率随温度升高而降低的原因为
b.P点甲醇产率高于T点的原因为
(3)
 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:反应I:


反应II:


在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图。其中:
的选择性随温度的变化如图。其中:

①温度高于
 ,
, 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是②
 时,在催化剂作用下
时,在催化剂作用下 和
和 反应一段时间后,测得
反应一段时间后,测得 的选择性为
的选择性为 (图中A点)。此时,不改变反应时间和温度,能提高
(图中A点)。此时,不改变反应时间和温度,能提高 选择性的措施是
选择性的措施是
您最近一年使用:0次
3 . 依据图示关系,下列说法不正确 的是
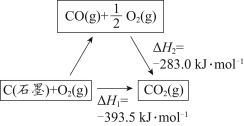

| A.石墨燃烧是放热反应 |
| B.C(石墨)+CO2(g)=2CO(g) △H=△H1-△H2 |
| C.1 mol C(石墨)和1 mol CO分别在足量O2中燃烧,全部转化为CO2,前者放热多 |
| D.化学反应的△H,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
2022-12-05更新
|
244次组卷
|
2卷引用:北京市第四十三中学2021-2022学年高二上学期12月月考化学试题
4 . 二氧化碳捕获技术用于去除气流中的二氧化碳或者分离出二氧化碳作为气体产物,其中CO2催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有催化剂时的能量变化。

(1)从图可知,有催化剂存在的是过程_______ (填“Ⅰ”或“Ⅱ”)。
(2)写出图中CO2催化合成甲醇的热化学方程式:_______ 。
(3)已知:1mol液态甲醇完全气化需吸热37.4kJ,1mol液态水完全气化需吸热44.0kJ,由CO2合成1mol液态甲醇和1mol液态水将_______ (填“吸收”或“放出”)_______ kJ热量。
(4)关于CO2催化合成甲醇的反应,下列说法中,合理的是_______(填字母序号)。

(1)从图可知,有催化剂存在的是过程
(2)写出图中CO2催化合成甲醇的热化学方程式:
(3)已知:1mol液态甲醇完全气化需吸热37.4kJ,1mol液态水完全气化需吸热44.0kJ,由CO2合成1mol液态甲醇和1mol液态水将
(4)关于CO2催化合成甲醇的反应,下列说法中,合理的是_______(填字母序号)。
| A.该反应中所有原子都被用于合成甲醇 |
| B.该反应可用于CO2的转化,有助于缓解温室效应 |
| C.使用催化剂可以降低该反应的ΔH,从而使反应放出更多热量 |
| D.降温分离出液态甲醇和水,将剩余气体重新通入反应器,可以提高CO2与H2的利用率 |
您最近一年使用:0次
解题方法
5 . 某工厂使用石油热裂解的副产物CH4来制取H2,其生产流程如图所示:

(1)第II步反应为CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH<0,其平衡常数随温度的变化如表:
在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为_______ 。
(2)在一个不传热的固定容积的容器中,判断第II步反应达平衡的标志是_______ (填序号)。
①体系的压强不再发生变化 ②混合气体的平均相对分子质量不变
③各组分的物质的量浓度不再改变 ④体系的温度不再发生变化
(3)若400℃时,第Ⅱ步反应生成l mol H2的热量为 33.2kJ, 第Ⅰ步反应的热化学方程式为CH4(g)+H2O(g) 3H2(g)+CO(g) ∆H=-103.3 kJ·mol-1。则400℃时,CH4和水蒸气反应生成CO2和H2的热化学方程式为
3H2(g)+CO(g) ∆H=-103.3 kJ·mol-1。则400℃时,CH4和水蒸气反应生成CO2和H2的热化学方程式为_______ 。

(1)第II步反应为CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH<0,其平衡常数随温度的变化如表:
| 温度T/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(2)在一个不传热的固定容积的容器中,判断第II步反应达平衡的标志是
①体系的压强不再发生变化 ②混合气体的平均相对分子质量不变
③各组分的物质的量浓度不再改变 ④体系的温度不再发生变化
(3)若400℃时,第Ⅱ步反应生成l mol H2的热量为 33.2kJ, 第Ⅰ步反应的热化学方程式为CH4(g)+H2O(g)
 3H2(g)+CO(g) ∆H=-103.3 kJ·mol-1。则400℃时,CH4和水蒸气反应生成CO2和H2的热化学方程式为
3H2(g)+CO(g) ∆H=-103.3 kJ·mol-1。则400℃时,CH4和水蒸气反应生成CO2和H2的热化学方程式为
您最近一年使用:0次
6 . 已知:①
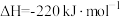
②氢气燃烧的能量变化示意图:
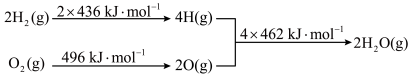
下列说法正确的是

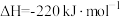
②氢气燃烧的能量变化示意图:

下列说法正确的是
| A.1 mol C(s)完全燃烧放出110 kJ的热量 |
B.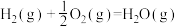  |
C.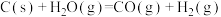  |
D.欲分解2 mol  ,至少需要提供 ,至少需要提供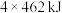 的热量 的热量 |
您最近一年使用:0次
21-22高一下·北京西城·期中
名校
7 . 以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
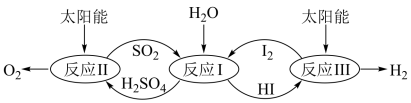
相关反应的热化学方程式为:
反应I:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1=-213kJ·mol-1
反应II:H2SO4(aq)=SO2(g)+H2O(1)+ O2(g) △H2=+327kJ·mol-l
O2(g) △H2=+327kJ·mol-l
反应III:2HI(aq)=H2(g)+I2(g)△H3=+172kJ·mol-1
下列说法不正确的是

相关反应的热化学方程式为:
反应I:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1=-213kJ·mol-1
反应II:H2SO4(aq)=SO2(g)+H2O(1)+
 O2(g) △H2=+327kJ·mol-l
O2(g) △H2=+327kJ·mol-l反应III:2HI(aq)=H2(g)+I2(g)△H3=+172kJ·mol-1
下列说法不正确的是
| A.该过程实现了太阳能到化学能的转化 |
| B.SO2和I2对总反应起到了催化剂的作用 |
| C.总反应的热化学方程式为:2H2O(1)=2H2(g)+O2(g) △H=+286kJ·mol-l |
| D.该过程使水分解制氢分为三步反应,但总反应的△H不变 |
您最近一年使用:0次
名校
8 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CO2资源化利用对缓解碳减排压力具有重要意义。在二氧化碳催化加氢制甲烷的反应体系中,主要发生反应的热化学方程式为:
反应I:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1=-164.7kJ·mol-1
CH4(g)+2H2O(g) ΔH1=-164.7kJ·mol-1
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
反应III:2CO(g)+2H2(g) CO2(g)+CH4(g) ΔH3=-247.1kJ·mol-1
CO2(g)+CH4(g) ΔH3=-247.1kJ·mol-1
向恒压、密闭容器中通入1molCO2和4molH2,平衡时体系内CH4、CO、CO2的物质的量(n)与温度(T)的变化关系如图所示。

(1)反应I~III中,属于吸热反应的是____ (填反应序号)。
(2)反应I的平衡常数表达式为____ 。
(3)盖斯定律的重要价值是可以利用已知反应的反应热求得未知反应的反应热,利用上述反应计算CH4(g)+H2O(g) CO(g)+3H2(g)的ΔH=
CO(g)+3H2(g)的ΔH=____ 。
(4)结合上述反应,解释图中CO的物质的量随温度的变化的原因:___ 。
(5)在实际生产中为了提高甲烷的产量,选择的反应条件为较低温度和使用合适的催化剂,从反应原理角度说明选择该反应条件的理由:____ 、____ 。
反应I:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH1=-164.7kJ·mol-1
CH4(g)+2H2O(g) ΔH1=-164.7kJ·mol-1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1反应III:2CO(g)+2H2(g)
 CO2(g)+CH4(g) ΔH3=-247.1kJ·mol-1
CO2(g)+CH4(g) ΔH3=-247.1kJ·mol-1向恒压、密闭容器中通入1molCO2和4molH2,平衡时体系内CH4、CO、CO2的物质的量(n)与温度(T)的变化关系如图所示。

(1)反应I~III中,属于吸热反应的是
(2)反应I的平衡常数表达式为
(3)盖斯定律的重要价值是可以利用已知反应的反应热求得未知反应的反应热,利用上述反应计算CH4(g)+H2O(g)
 CO(g)+3H2(g)的ΔH=
CO(g)+3H2(g)的ΔH=(4)结合上述反应,解释图中CO的物质的量随温度的变化的原因:
(5)在实际生产中为了提高甲烷的产量,选择的反应条件为较低温度和使用合适的催化剂,从反应原理角度说明选择该反应条件的理由:
您最近一年使用:0次
2022-01-15更新
|
347次组卷
|
4卷引用:北京市第三十五中学2022-2023学年高三上学期 10月月考化学试题
9 . 已知下列热化学方程式:
2Zn(s)+O2(g)=2ZnO(s) ΔH1=-702.2 kJ·mol-1;
Hg(l)+ O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。
O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3中ΔH3的值是
2Zn(s)+O2(g)=2ZnO(s) ΔH1=-702.2 kJ·mol-1;
Hg(l)+
 O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。
O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1。由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3中ΔH3的值是
| A.-260.4 kJ·mol-1 | B.-254.6 kJ·mol-1 |
| C.-438.9 kJ·mol-1 | D.-441.8 kJ·mol-1 |
您最近一年使用:0次
2021-07-26更新
|
705次组卷
|
55卷引用:北京市第三十一中学2021-2022学年高二上学期期中考试化学试题
北京市第三十一中学2021-2022学年高二上学期期中考试化学试题(已下线)2010年福建省厦门市杏南中学高二上学期10月月考理科化学卷(已下线)2010—2011学年浙江省嘉兴一中高二下学期期中考试化学试卷(已下线)2011-2012学年广东省汕头市达濠中学高二上学期期末考试化学试卷(已下线)2011学年浙江省瑞安十校高二第二学期期中联考化学试卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷(已下线)2014-2015学年广东阳东县第二中学高二10月月考化学(理)试卷(已下线)2015届内蒙古巴彦淖尔市第一中学高三10月月考化学试卷2015-2016学年青海省高级中学高二上9月质检化学试卷2015-2016学年青海西宁第十四中学高二上期中考试化学卷广东省肇庆市实验中学2017-2018学年高二上学期期中考试化学(理)试题云南省峨山彝族自治县第一中学2017-2018学年高二12月月考(理)化学试题福建省泉州市泉港区第一中学2017-2018学年高二下学期第一次(4月)月考化学试题河南省郑州市第106中学2018-2019学年高二上学期第一次月考化学试题甘肃省岷县一中2018-2019学年高二上学期期中考试化学试题江西省上饶市第二中学2018-2019学年高二上学期期中考试化学试题山西省忻州二中2018-2019学年高二上学期期中考试化学试题黑龙江省鸡西市第十九中学2019届高三上学期期中考试化学试题【全国百强校】四川省南充市阆中中学2018-2019学年高二上学期1月质量检测化学试题【全国百强校】河南省实验中学2018-2019学年高二上学期期中考试化学试题山东省济宁市微山县第二中学2019-2020学年高二10月月考化学试题宁夏青铜峡市高级中学2019-2020学年高二上学期期中考试化学试题辽宁省辽河油田第二高级中学2019-2020学年高二上学期期中考试化学试题福建省泉州第十六中学2019-2020学年高二10月份月考化学试题江西省吉安市吉水二中、新干二中、吉安县二中、永丰二中、泰和二中五校2019-2020学年高二期中联考化学试题甘肃省临夏中学2019-2020学年高二上学期期中考试化学(理)试题四川省广安市岳池县第一中学2019-2020学年高二上学期第一次月考化学试题山东省济南外国语学校2019-2020学年高二下学期3月份“空中课堂”阶段性测试化学试题甘肃省白银市会宁县第二中学2017-2018学年高二上学期期中考试理科化学试题河南省安阳市林州市第一中学2019-2020学年高二下学期4月月考化学试题北京市海淀区中关村中学2019-2020学年高二下学期期末练习化学试题山西省临猗县临晋中学2020-2021学年高二9月月考化学试题甘肃省白银市靖远县第四中学2021届高三上学期10月月考化学试题陕西省渭南市临渭区尚德中学2020-2021学年高二上学期第一次月考化学试题甘肃省兰州市第四片区2020-2021学年高二上学期期中考试化学(理)试题黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题甘肃省张掖市第二中学2020-2021学年高二上学期期中考试化学试题天津市滨海新区汉沽第六中学2020-2021学年高二上学期期中化学试题(已下线)练习3 化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版)河北省唐山市2020-2021学年高二上学期期末考试化学试题海南省三亚华侨学校(南新校区)2020-2021学年高二下学期开学考试化学试题河南省汤阴县五一中学2019-2020学年高二上学期期中考试化学试题贵州省龙里县九八五实验学校2020-2021学年高二上学期1月月考化学试题(已下线)第17讲 化学能与热能(精讲)-2022年一轮复习讲练测(已下线)专题18 化学反应与能量(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练福建省泉州现代中学2021-2022学年高二上学期9月月考化学试题黑龙江省哈尔滨市第六中学校2021-2022学年高二上学期10月阶段性总结化学试题山东省新泰市第二中学2021-2022学年上学期高二阶段性测试(一)化学试题新疆乌鲁木齐第四中学2021-2022学年高二上学期期中考试化学试题重庆市沙坪坝实验中学校2021-2022学年高二上学期10月月考化学试题重庆市沙坪坝实验中学校2021-2022学年高二上学期12月月考化学试题海南省三亚华侨学校(南新校区)2021-2022学年高二上学期期中考试化学试题江西省瑞金市第二中学2021-2022学年高二上学期第一次月考化学试题甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题云南省保山市智源高级中学2023-2024学年高一下学期4月期中考试化学试题
10 . 碳酸钠晶体(Na2CO3·10H2O)失水可得到Na2CO3·H2O(s)或Na2CO3(s),两个化学反应的能量变化示意图如下:
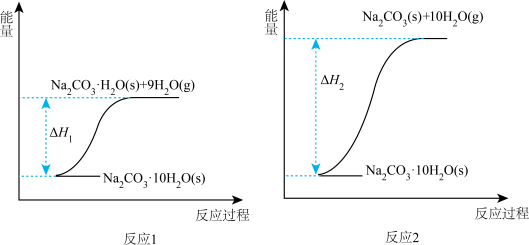
| A.∆H1<0 |
| B.碳酸钠晶体(Na2CO3·10H2O)失水不是化学变化 |
| C.Na2CO3·H2O(s)失水生成Na2CO3(s):∆H=∆H1-∆H2 |
| D.向Na2CO3(s)中滴加几滴水,温度升高 |
您最近一年使用:0次
2021-05-10更新
|
385次组卷
|
2卷引用:北京市西城区2021届高三化学第二次模拟考试



