解题方法
1 . 碳捕集与碳封存技术有望成为碳减排的关键,其中碳捕集技术是指从空气中捕获二氧化碳的各种科学技术的统称。
(1)工业上用 捕碳可合成
捕碳可合成 :
:
已知:①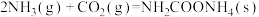
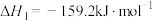
②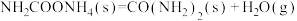
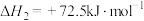 。
。
则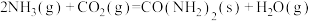

_______  。
。
(2)现将0.08mol纯净的氨基甲酸铵置于2L恒容密闭容器中,分别在不同温度下进行反应: 。实验测得的有关数据见下表(
。实验测得的有关数据见下表(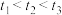 )
)
氨基甲酸铵分解反应是_______ (填“放热”或“吸热”)反应,15℃达平衡时,氨基甲酸铵的转化率为_______ ,化学平衡常数
_______ 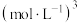 。
。
(3)用 捕碳的反应为:
捕碳的反应为: 。为研究温度对
。为研究温度对 捕获
捕获 效率的影响,将一定量的
效率的影响,将一定量的 溶液置于密闭容器中,并充入一定量的
溶液置于密闭容器中,并充入一定量的 气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得
气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得 气体浓度,得到趋势图:
气体浓度,得到趋势图:

①b、c、d三点的平衡常数 、
、 、
、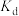 从大到小的顺序为
从大到小的顺序为_______ 。
②在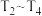 温度区间,容器内
温度区间,容器内 气体浓度呈现先减小后增大的变化趋势,其原因是
气体浓度呈现先减小后增大的变化趋势,其原因是_______ 。
(1)工业上用
 捕碳可合成
捕碳可合成 :
:已知:①
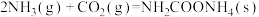
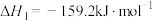
②
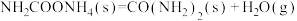
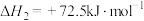 。
。则
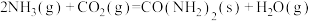

 。
。(2)现将0.08mol纯净的氨基甲酸铵置于2L恒容密闭容器中,分别在不同温度下进行反应:
 。实验测得的有关数据见下表(
。实验测得的有关数据见下表(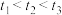 )
)温度/℃ 气体总浓度/ 时间/min | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
 | 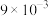 | 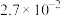 | 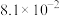 |
 | 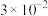 |  |  |
 | 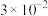 |  |  |

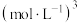 。
。(3)用
 捕碳的反应为:
捕碳的反应为: 。为研究温度对
。为研究温度对 捕获
捕获 效率的影响,将一定量的
效率的影响,将一定量的 溶液置于密闭容器中,并充入一定量的
溶液置于密闭容器中,并充入一定量的 气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得
气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得 气体浓度,得到趋势图:
气体浓度,得到趋势图:
①b、c、d三点的平衡常数
 、
、 、
、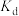 从大到小的顺序为
从大到小的顺序为②在
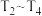 温度区间,容器内
温度区间,容器内 气体浓度呈现先减小后增大的变化趋势,其原因是
气体浓度呈现先减小后增大的变化趋势,其原因是
您最近一年使用:0次
名校
解题方法
2 . 硝酸是一种重要的化工原料,工业上采用氨的催化氧化法制备硝酸。
(1)已知反应N2(g)+3H2(g) ⇌ 2NH3(g)为放热反应,在恒容容器中能说明该反应达到平衡状态的是( )
(2)理论上,为了增大平衡时的转化率,可采取的措施是_____________ (要求答出两点)
(3)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下表,则400℃时,测得某时刻氮气、氢气、氨气的物质的量浓度分别为1 mol·L-1、2 mol·L-1、3 mol·L-1时,此时刻该反应正反应速率_____ 逆反应速率(填“大于”、“小于”或“等于”)
(4)消除硝酸工厂尾气的一种方法是用甲烷催化还原氮氧化物,已知:
① CH4 (g)+2O2(g)=CO2(g)+2H2O(g) △ H=-890.3 kJ·mol-1
② N2(g)+2O2(g)=2NO2(g) △ H=-67.0 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为___________________________________________
(5)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____ 沉淀(填化学式),当两种沉淀共存时,溶液中C(Mg2+)/C(Cu2+)=_________ (已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
(1)已知反应N2(g)+3H2(g) ⇌ 2NH3(g)为放热反应,在恒容容器中能说明该反应达到平衡状态的是( )
| A.容器内N2、H2、NH3的浓度之比为1:2:3 |
| B.v正(N2)=v逆(H2) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
(3)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下表,则400℃时,测得某时刻氮气、氢气、氨气的物质的量浓度分别为1 mol·L-1、2 mol·L-1、3 mol·L-1时,此时刻该反应正反应速率
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
① CH4 (g)+2O2(g)=CO2(g)+2H2O(g) △ H=-890.3 kJ·mol-1
② N2(g)+2O2(g)=2NO2(g) △ H=-67.0 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为
(5)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
您最近一年使用:0次
10-11高三上·贵州遵义·阶段练习
3 . 已知: C(s)+1/2 O2(g)=CO(g);△H1=-110.35kJ/mol
CO(g)+1/2 O2(g)=CO2(g);△H2= -282.57 kJ/mol
则:C(s)+O2(g)=CO2(g);△H3=
CO(g)+1/2 O2(g)=CO2(g);△H2= -282.57 kJ/mol
则:C(s)+O2(g)=CO2(g);△H3=
| A.+172.22 kJ/mol | B.-172.22 kJ/mol |
| C.+392.92 kJ/mol | D.-392.92 kJ/mol |
您最近一年使用:0次




