1 . 利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。反应过程中伴有生成十氢萘(1-MD)的副反应,涉及反应如图:
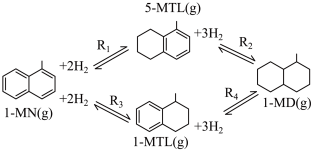
回答下列问题:
(1)1-甲基萘(1-MN)的组成元素电负性由小到大的顺序为___________ 。
(2)已知一定条件下反应 、
、 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应 的焓变为
的焓变为___________ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(3)四个平衡体系的平衡常数与温度的关系如图甲所示。
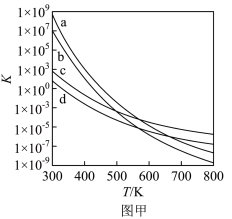
①c、d分别为反应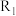 和
和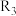 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应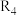 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为___________ 。
②已知反应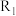 的速率方程
的速率方程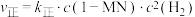 ,
,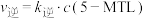 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时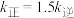 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③下列说法不正确的是___________ (填标号)。
A.四个反应均为放热反应
B.反应体系中1-MD最稳定
C.压强越大,温度越低越有利于生成四氢萘类物质
D.由上述信息可知,400K时反应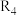 速率最快
速率最快
(4)1-MN在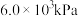 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性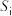 (某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数
(某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数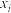 (
(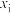 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应
外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应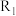 的平衡常数
的平衡常数
___________  (列出计算式)。
(列出计算式)。

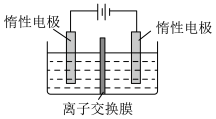
(5)利用膜电解技术(装置如图所示),以 为主要原料制备
为主要原料制备 的总反应方程式为:
的总反应方程式为: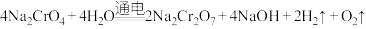 。则
。则 在
在___________ (填“阴”或“阳”)极室制得,电解时通过膜的离子主要为___________ 。

回答下列问题:
(1)1-甲基萘(1-MN)的组成元素电负性由小到大的顺序为
(2)已知一定条件下反应
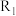 、
、 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应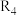 的焓变为
的焓变为 、
、 、
、 的代数式表示)。
的代数式表示)。(3)四个平衡体系的平衡常数与温度的关系如图甲所示。

①c、d分别为反应
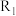 和
和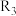 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应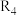 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为②已知反应
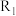 的速率方程
的速率方程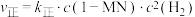 ,
,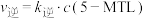 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时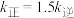 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③下列说法不正确的是
A.四个反应均为放热反应
B.反应体系中1-MD最稳定
C.压强越大,温度越低越有利于生成四氢萘类物质
D.由上述信息可知,400K时反应
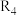 速率最快
速率最快(4)1-MN在
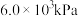 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性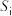 (某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数
(某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数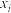 (
(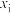 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应
外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应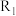 的平衡常数
的平衡常数
 (列出计算式)。
(列出计算式)。
(5)利用膜电解技术(装置如图所示),以
 为主要原料制备
为主要原料制备 的总反应方程式为:
的总反应方程式为: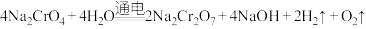 。则
。则 在
在
您最近一年使用:0次
解题方法
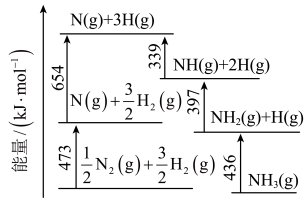
2 . 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据下图数据计算反应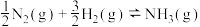

________  。
。 为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、
为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、 、
、 、
、 的混合气体,在反应器A进行合成氨,其催化剂Ⅲ铁触媒,在500℃活性最大,反应器B中主要发生的反应为
的混合气体,在反应器A进行合成氨,其催化剂Ⅲ铁触媒,在500℃活性最大,反应器B中主要发生的反应为
 ,装置如图。
,装置如图。_______ 气流b(填“>”“<”或“=”)。
②气体流速一定,经由催化剂Ⅰ到催化剂Ⅱ,原料转化率有提升,其可能原因是:_______ 。
③下列说法正确的是_______ 。
A.合成氨是目前自然固氮最重要的途径
B.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气流速,有利于水煤气生成
C.体系温度升高,可能导致催化剂失活,用热交换器将原料气可预热并使反应体系冷却
D.终端出口2得到的气体,通过液化可分离出
(3)LiH-3d过渡金属复合催化剂也可用于催化合成氨,已知 先被吸附发生反应
先被吸附发生反应
 ,紧接着
,紧接着 被吸附发生的反应方程式
被吸附发生的反应方程式___________ 。
(4)工业上常用甲烷水蒸气重整制备所得的氢气用于合成氨的原料,体系中发生如下反应。
Ⅰ.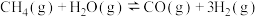
Ⅱ.
恒温恒压条件下,1mol (g)和1mol
(g)和1mol  (g)反应达平衡时,
(g)反应达平衡时, (g)的转化率为m,
(g)的转化率为m, (g)的物质的量为n mol,则反应Ⅰ的平衡常数
(g)的物质的量为n mol,则反应Ⅰ的平衡常数
___________ (写出含有m、n的计算式;对于反应 ,
,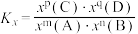 ,x为物质的量分数)。
,x为物质的量分数)。
(1)根据下图数据计算反应
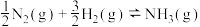

 。
。
 为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、
为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、 、
、 、
、 的混合气体,在反应器A进行合成氨,其催化剂Ⅲ铁触媒,在500℃活性最大,反应器B中主要发生的反应为
的混合气体,在反应器A进行合成氨,其催化剂Ⅲ铁触媒,在500℃活性最大,反应器B中主要发生的反应为
 ,装置如图。
,装置如图。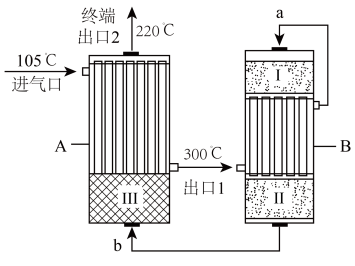
②气体流速一定,经由催化剂Ⅰ到催化剂Ⅱ,原料转化率有提升,其可能原因是:
③下列说法正确的是
A.合成氨是目前自然固氮最重要的途径
B.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气流速,有利于水煤气生成
C.体系温度升高,可能导致催化剂失活,用热交换器将原料气可预热并使反应体系冷却
D.终端出口2得到的气体,通过液化可分离出

(3)LiH-3d过渡金属复合催化剂也可用于催化合成氨,已知
 先被吸附发生反应
先被吸附发生反应
 ,紧接着
,紧接着 被吸附发生的反应方程式
被吸附发生的反应方程式(4)工业上常用甲烷水蒸气重整制备所得的氢气用于合成氨的原料,体系中发生如下反应。
Ⅰ.
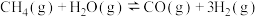
Ⅱ.

恒温恒压条件下,1mol
 (g)和1mol
(g)和1mol  (g)反应达平衡时,
(g)反应达平衡时, (g)的转化率为m,
(g)的转化率为m, (g)的物质的量为n mol,则反应Ⅰ的平衡常数
(g)的物质的量为n mol,则反应Ⅰ的平衡常数
 ,
,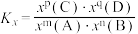 ,x为物质的量分数)。
,x为物质的量分数)。
您最近一年使用:0次
名校
解题方法
3 . 新型材料 和
和 应用前景广泛,对其制备过程的研究成为热点。回答下列问题:
应用前景广泛,对其制备过程的研究成为热点。回答下列问题:
(1)在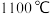 下用镓与氨气制得氮化镓,该可逆反应每生成
下用镓与氨气制得氮化镓,该可逆反应每生成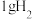 放出
放出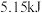 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是_______ (已知金属镓的熔点是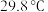 ,沸点是
,沸点是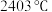 ;氮化镓的熔点为
;氮化镓的熔点为 )。
)。
(2)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中 的体积分数与压强(P)、温度(T)的关系如图1所示(已知图中
的体积分数与压强(P)、温度(T)的关系如图1所示(已知图中 和
和 的温度均小于
的温度均小于 )。
)。
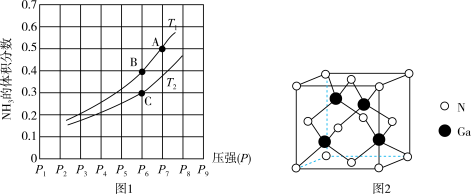
①下列说法错误的是_______ (填标号)。
a.当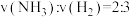 时达到了化学平衡状态
时达到了化学平衡状态
b.温度一定时,达到平衡后再充入氦气(氦气不参与反应), 的转化率减小
的转化率减小
c.B点和C点化学平衡常数的关系是: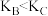
d. 的晶体结构如图2所示,
的晶体结构如图2所示, 原子和N原子都是
原子和N原子都是 杂化
杂化
②已知在 时体系的初始压强为
时体系的初始压强为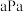 ,则A点的
,则A点的
_______ 。[气相平衡中用组分的平衡分压代替物质的量浓度表示平衡常数(记作 ),分压=总压×气体的物质的量分数,用含a的式子表示]。
),分压=总压×气体的物质的量分数,用含a的式子表示]。
(3)电解精炼法提纯镓的过程中需控制合适的电压,若电压太高时阴极会产生 ,导致电解效率下降。若外电路通过
,导致电解效率下降。若外电路通过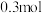 电子时,阴极得到
电子时,阴极得到 的镓。则该电解装置的电解效率
的镓。则该电解装置的电解效率
_______ (已知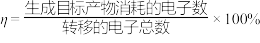 )。
)。
(4)铝粉与 在一定温度下可直接生成
在一定温度下可直接生成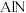 ,加入少量
,加入少量 固体可促进反应。将等质量的铅粉与不同量的
固体可促进反应。将等质量的铅粉与不同量的 混合均匀后置于充满
混合均匀后置于充满 的密闭容器中,用电火花引燃。不同温度下合成产物的
的密闭容器中,用电火花引燃。不同温度下合成产物的 图谱如图3所示,产品中
图谱如图3所示,产品中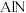 的质量分数
的质量分数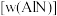 随原料中
随原料中 的变化如图4所示,燃烧过程中温度随时间的变化如图5所示。则:
的变化如图4所示,燃烧过程中温度随时间的变化如图5所示。则:

①合成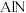 的最佳条件是
的最佳条件是_______ 。
②当 较小时,有利于
较小时,有利于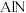 制备的原因可能是
制备的原因可能是_______ ;当 超过一定值后,
超过一定值后,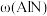 明显减少的原因可能是
明显减少的原因可能是_______ 。
 和
和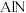 应用前景广泛,对其制备过程的研究成为热点。回答下列问题:
应用前景广泛,对其制备过程的研究成为热点。回答下列问题:(1)在
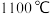 下用镓与氨气制得氮化镓,该可逆反应每生成
下用镓与氨气制得氮化镓,该可逆反应每生成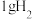 放出
放出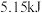 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是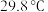 ,沸点是
,沸点是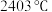 ;氮化镓的熔点为
;氮化镓的熔点为 )。
)。(2)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中
 的体积分数与压强(P)、温度(T)的关系如图1所示(已知图中
的体积分数与压强(P)、温度(T)的关系如图1所示(已知图中 和
和 的温度均小于
的温度均小于 )。
)。
①下列说法错误的是
a.当
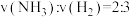 时达到了化学平衡状态
时达到了化学平衡状态b.温度一定时,达到平衡后再充入氦气(氦气不参与反应),
 的转化率减小
的转化率减小c.B点和C点化学平衡常数的关系是:
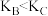
d.
 的晶体结构如图2所示,
的晶体结构如图2所示, 原子和N原子都是
原子和N原子都是 杂化
杂化②已知在
 时体系的初始压强为
时体系的初始压强为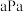 ,则A点的
,则A点的
 ),分压=总压×气体的物质的量分数,用含a的式子表示]。
),分压=总压×气体的物质的量分数,用含a的式子表示]。(3)电解精炼法提纯镓的过程中需控制合适的电压,若电压太高时阴极会产生
 ,导致电解效率下降。若外电路通过
,导致电解效率下降。若外电路通过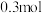 电子时,阴极得到
电子时,阴极得到 的镓。则该电解装置的电解效率
的镓。则该电解装置的电解效率
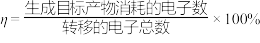 )。
)。(4)铝粉与
 在一定温度下可直接生成
在一定温度下可直接生成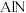 ,加入少量
,加入少量 固体可促进反应。将等质量的铅粉与不同量的
固体可促进反应。将等质量的铅粉与不同量的 混合均匀后置于充满
混合均匀后置于充满 的密闭容器中,用电火花引燃。不同温度下合成产物的
的密闭容器中,用电火花引燃。不同温度下合成产物的 图谱如图3所示,产品中
图谱如图3所示,产品中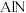 的质量分数
的质量分数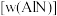 随原料中
随原料中 的变化如图4所示,燃烧过程中温度随时间的变化如图5所示。则:
的变化如图4所示,燃烧过程中温度随时间的变化如图5所示。则:
①合成
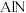 的最佳条件是
的最佳条件是②当
 较小时,有利于
较小时,有利于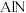 制备的原因可能是
制备的原因可能是 超过一定值后,
超过一定值后,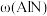 明显减少的原因可能是
明显减少的原因可能是
您最近一年使用:0次
2022-05-04更新
|
455次组卷
|
2卷引用:河南省周口恒大中学2023-2024学年高三上学期12月月考化学试题



