1 . 研究碳、氮、硫及其化合物的转化对环境的改善有重大意义。
(1)在一定条件下, CH4可与 NO2反应除去 NO,已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= 890.2 kJ•mol-1
②2NO2(g) ⇌ N2(g)+ 2O2 (g) ΔH =-67.0 kJ•rnol-1
③H2O (g)= H2O(l) ΔH =-44.0 kJ•mol-1
则 CH4(g)+ 2NO2 (g) ⇌ CO2(g)+ 2H2O(g)+N2(g) ΔH =___ kJ·mol-1。
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2 SO2 (g)+O2(g) ⇌ 2SO3(g) ΔH <0,下列说法正确的是______ 。
A.升高温度,正反应速率增大,逆反应速率减小
B.使用催化剂, 能提高SO2的转化率
C.在一定温度下的恒容容器中,混合气体的密度不再发生变化能说明上述反应达到平衡状态
D.温度不变,增大压强, 该反应的化学平衡常数不变
E.350K 和 500K 时,反应的平衡常数分别为Kl、K2,且K1>K2
(3)若在 T1℃下,往一恒容密闭容器中通入SO2和 O2[其中n (SO2)∶n(O2)=2∶l]发生反应2 SO2 (g)+O2(g) ⇌ 2SO3(g),容器中总压强为 0.1 MPa,反应 8min 时达到平衡,测得容器内总压强为0.09MPa,反应 8min 时,SO2的转化率为_________ 。
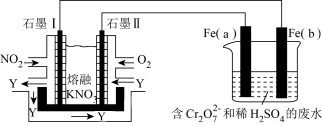
(4)将 NO2、O2和熔融KNO3制成燃料电池,电解处理含Cr2O 的废水,工作原理如图所示。
的废水,工作原理如图所示。

①Fe(a)电极为____________ (填“阳极”或“阴极”),a 极的电极反应为________ 。
②请完成电解池中Cr2O 转化为Cr3+的离子反应方程式:Cr2O
转化为Cr3+的离子反应方程式:Cr2O +
+ ___ Fe2+__ =___ Cr3+__ Fe3+__ 。
③若在标准状况下有 224 mL 氧气参加反应,则电解装置中铁棒的质量减少____ 。在相同条件下,消耗的NO2和O2的体积比为_________ 。
④称取含 Na2Cr2O7的废水样品6.55g配成 250mL溶液,量取 25.00mL 于碘量瓶中,加入2mol • L-1 H2SO4和足量碘化钾溶液(铬的还原产物为Cr3+),放于暗处 5min,加入淀粉溶液作指示剂,用0.3000mol • L-1Na2S2O3]标准溶液滴定 (I2 +2S2O =2 I- + S4O
=2 I- + S4O ),判断达到滴定终点的现象是
),判断达到滴定终点的现象是______ 。若实验中平均消耗Na2S2O3标准溶液 25.00mL,则重铬酸钠的纯度为 ______ (设整个过程中其他杂质不参与反应)。
(5)为了清除 NO、NO2、N2O4对大气的污染, 常采用氢氧化钠溶液进行吸收处理。现有由 a mol NO2、b mol N2O4,cmolNO组成的混合气体,恰好被VL氢氧化钠溶液吸收(无气体剩余)转化为 NaNO3和NaNO2,则此氢氧化钠溶液的物质的量浓度最小为_________ 。
(1)在一定条件下, CH4可与 NO2反应除去 NO,已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= 890.2 kJ•mol-1
②2NO2(g) ⇌ N2(g)+ 2O2 (g) ΔH =-67.0 kJ•rnol-1
③H2O (g)= H2O(l) ΔH =-44.0 kJ•mol-1
则 CH4(g)+ 2NO2 (g) ⇌ CO2(g)+ 2H2O(g)+N2(g) ΔH =
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2 SO2 (g)+O2(g) ⇌ 2SO3(g) ΔH <0,下列说法正确的是
A.升高温度,正反应速率增大,逆反应速率减小
B.使用催化剂, 能提高SO2的转化率
C.在一定温度下的恒容容器中,混合气体的密度不再发生变化能说明上述反应达到平衡状态
D.温度不变,增大压强, 该反应的化学平衡常数不变
E.350K 和 500K 时,反应的平衡常数分别为Kl、K2,且K1>K2
(3)若在 T1℃下,往一恒容密闭容器中通入SO2和 O2[其中n (SO2)∶n(O2)=2∶l]发生反应2 SO2 (g)+O2(g) ⇌ 2SO3(g),容器中总压强为 0.1 MPa,反应 8min 时达到平衡,测得容器内总压强为0.09MPa,反应 8min 时,SO2的转化率为
(4)将 NO2、O2和熔融KNO3制成燃料电池,电解处理含Cr2O
 的废水,工作原理如图所示。
的废水,工作原理如图所示。
①Fe(a)电极为
②请完成电解池中Cr2O
 转化为Cr3+的离子反应方程式:Cr2O
转化为Cr3+的离子反应方程式:Cr2O +
+ ③若在标准状况下有 224 mL 氧气参加反应,则电解装置中铁棒的质量减少
④称取含 Na2Cr2O7的废水样品6.55g配成 250mL溶液,量取 25.00mL 于碘量瓶中,加入2mol • L-1 H2SO4和足量碘化钾溶液(铬的还原产物为Cr3+),放于暗处 5min,加入淀粉溶液作指示剂,用0.3000mol • L-1Na2S2O3]标准溶液滴定 (I2 +2S2O
 =2 I- + S4O
=2 I- + S4O ),判断达到滴定终点的现象是
),判断达到滴定终点的现象是(5)为了清除 NO、NO2、N2O4对大气的污染, 常采用氢氧化钠溶液进行吸收处理。现有由 a mol NO2、b mol N2O4,cmolNO组成的混合气体,恰好被VL氢氧化钠溶液吸收(无气体剩余)转化为 NaNO3和NaNO2,则此氢氧化钠溶液的物质的量浓度最小为
您最近一年使用:0次
2 . 研究碳、氮、硫及其化合物的转化对环境的改善有重大意义。
(1)在一定条件下,CH4可与NO2反应除去NO,已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.2kJ•mol-1
②2NO2(g)⇌N2(g)+2O2(g) ΔH=-67.0kJ•rnol-1
③H2O(g)=H2O(l) ΔH=-44.0kJ•mol-1
则CH4(g)+2NO2(g)⇌CO2(g)+2H2O(g)+N2(g) ΔH=_________ kJ·mol-1。
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)⇌2SO3(g) ΔH<0,下列说法正确的是________ 。
A.升高温度,正反应速率增大,逆反应速率减小
B.使用催化剂,能提高SO2的转化率
C在一定温度下的恒容容器中,混合气体的密度不再发生变化能说明上述反应达到平衡状态
D.温度不变,增大压强,该反应的化学平衡常数不变
E.350K和500K时,反应的平衡常数分别为Kl、K2,且K1>K2
(3)若在T1℃下,往一恒容密闭容器中通入SO2和O2[其中n(SO2):n(O2)=2:l]发生反应2SO2(g)+O2(g)⇌2SO3(g),容器中总压强为0.1MPa,反应8min时达到平衡,测得容器内总压强为0.09MPa,反应8min时,SO2的转化率为________ 。
(4)将NO2、O2和熔融KNO3制成燃料电池,电解处理含 的废水,工作原理如图所示。
的废水,工作原理如图所示。
①Fe(a)电极为________ (填“阳极”或“阴极”),a极的电极反应为_________ 。
②请完成电解池中Cr2O72-转化为Cr3+的离子反应方程式:___  +
+___ Fe2++___ =____ Cr3++___ Fe3++____ 。
③若在标准状况下有224mL氧气参加反应,则电解装置中铁棒的质量减少_________ 。在相同条件下,消耗的NO2和O2的体积比为_________ 。
④称取含Na2Cr2O7的废水样品6.55g配成250mL溶液,量取25.00mL于碘量瓶中,加入2moll•L-1H2SO4和足量碘化钾溶液(铬的还原产物为Cr3+),放于暗处5min,加入淀粉溶液作指示剂,用0.3000mol•L-1Na2S2O3]标准溶液滴定(I2+2 =2I-+
=2I-+ ),判断达到滴定终点的现象是
),判断达到滴定终点的现象是_________ 。若实验中平均消耗Na2S2O3标准溶液25.00mL,则重铬酸钠的纯度为________ (设整个过程中其他杂质不参与反应)
(5)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由amolNO2、bmolN2O4,cmolNO组成的混合气体,恰好被VL氢氧化钠溶液吸收(无气体剩余)转化为NaNO3和NaNO2,则此氢氧化钠溶液的物质的量浓度最小为________ 。
(1)在一定条件下,CH4可与NO2反应除去NO,已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.2kJ•mol-1
②2NO2(g)⇌N2(g)+2O2(g) ΔH=-67.0kJ•rnol-1
③H2O(g)=H2O(l) ΔH=-44.0kJ•mol-1
则CH4(g)+2NO2(g)⇌CO2(g)+2H2O(g)+N2(g) ΔH=
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)⇌2SO3(g) ΔH<0,下列说法正确的是
A.升高温度,正反应速率增大,逆反应速率减小
B.使用催化剂,能提高SO2的转化率
C在一定温度下的恒容容器中,混合气体的密度不再发生变化能说明上述反应达到平衡状态
D.温度不变,增大压强,该反应的化学平衡常数不变
E.350K和500K时,反应的平衡常数分别为Kl、K2,且K1>K2
(3)若在T1℃下,往一恒容密闭容器中通入SO2和O2[其中n(SO2):n(O2)=2:l]发生反应2SO2(g)+O2(g)⇌2SO3(g),容器中总压强为0.1MPa,反应8min时达到平衡,测得容器内总压强为0.09MPa,反应8min时,SO2的转化率为
(4)将NO2、O2和熔融KNO3制成燃料电池,电解处理含
 的废水,工作原理如图所示。
的废水,工作原理如图所示。
①Fe(a)电极为
②请完成电解池中Cr2O72-转化为Cr3+的离子反应方程式:
 +
+③若在标准状况下有224mL氧气参加反应,则电解装置中铁棒的质量减少
④称取含Na2Cr2O7的废水样品6.55g配成250mL溶液,量取25.00mL于碘量瓶中,加入2moll•L-1H2SO4和足量碘化钾溶液(铬的还原产物为Cr3+),放于暗处5min,加入淀粉溶液作指示剂,用0.3000mol•L-1Na2S2O3]标准溶液滴定(I2+2
 =2I-+
=2I-+ ),判断达到滴定终点的现象是
),判断达到滴定终点的现象是(5)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由amolNO2、bmolN2O4,cmolNO组成的混合气体,恰好被VL氢氧化钠溶液吸收(无气体剩余)转化为NaNO3和NaNO2,则此氢氧化钠溶液的物质的量浓度最小为
您最近一年使用:0次



