1 . 二甲醚(CH3OCH3)是一种清洁能源由合成气(CO,H2)制备二甲醚的反应原理如下:
反应Ⅰ:CO(g) +2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)⇌CH3OCH3(g) +H2O(g)△H2
回答下列问题:
(1)上述反应符合“原子经济”原则的是____ (填“反应Ⅰ”或“反应Ⅱ”)。下图中使曲线a对应反应按曲线b进行的措施是____ ,该反应自发进行的条件为____ (填“低温”或“高温")。
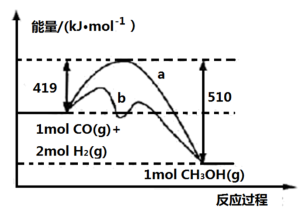
(2)已知△H2=-20.0kJ ·mol-1;H2O(l)=H2O (g)△H= +44.0 kJ·mol-1,则由合成气(CO、H2)制备1 mol CH3OCH3(g),且生成H2O (l)的热化学方程式为____ ;
(3)模拟该制备原理,起始时在某容器中充入2 mol CO和4 mol H2合成CH3OCH3(g),平衡时混合物中氢气的体积分数与温度、压强的关系如下图所示。
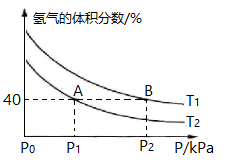
①下列有关说法能够证明恒温恒压时,反应2CO(g) +4H2(g)⇌CH3OCH3(g)+H2O (g)一定达到平衡状态的是 (填序号)___ 。
a.CO和H2的转化率相等
b.反应体系中混合气体密度保持不变
c. c(H2):c( CH3OCH3)的值保持不变
d.反应体系压强保持不变
②上图中T1____ (填“>”、“ <””或“=”,下同)T2;在A、B两点条件下,该反应从开始到平衡时生成二甲醚的平均速率:v (A)_____ v(B)。
③A点对应的CH3OCH3(g)的体积分数为_______ ,B点对应的Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
反应Ⅰ:CO(g) +2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)⇌CH3OCH3(g) +H2O(g)△H2
回答下列问题:
(1)上述反应符合“原子经济”原则的是

(2)已知△H2=-20.0kJ ·mol-1;H2O(l)=H2O (g)△H= +44.0 kJ·mol-1,则由合成气(CO、H2)制备1 mol CH3OCH3(g),且生成H2O (l)的热化学方程式为
(3)模拟该制备原理,起始时在某容器中充入2 mol CO和4 mol H2合成CH3OCH3(g),平衡时混合物中氢气的体积分数与温度、压强的关系如下图所示。

①下列有关说法能够证明恒温恒压时,反应2CO(g) +4H2(g)⇌CH3OCH3(g)+H2O (g)一定达到平衡状态的是 (填序号)
a.CO和H2的转化率相等
b.反应体系中混合气体密度保持不变
c. c(H2):c( CH3OCH3)的值保持不变
d.反应体系压强保持不变
②上图中T1
③A点对应的CH3OCH3(g)的体积分数为
您最近一年使用:0次
19-20高二·浙江·期末
解题方法
2 . 下列说法不正确的是
A.已知冰的熔化热为6.0 ,冰中氢键键能为20 ,冰中氢键键能为20 。假设每摩尔冰中有2 。假设每摩尔冰中有2 氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 |
B.由于键能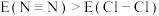 ,故单质的沸点: ,故单质的沸点: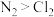 |
C.实验测得环己烷、环己烯和苯的标准燃烧热分别为-3916 、-3747 、-3747 和-3265 和-3265 ,可以证明在苯分子中不存在独立的碳碳双键 ,可以证明在苯分子中不存在独立的碳碳双键 |
| D.碳纤维是一种高性能纤维材料,其不属于有机物范畴 |
您最近一年使用:0次
3 . 合成气(CO+H2)是制备合成油和烯烃等众多化工产品的枢纽原料,而催化甲烷部分氧化是生产合成气的主要工艺之一,涉及的反应为:
①2CH4(g)+O2(g) 2CO(g)+4H2(g) △H
2CO(g)+4H2(g) △H
已知如下反应:
②CH4(g)+2O2(g) CO2(g)+2H2O(g) △H1=-810kJ/mol
CO2(g)+2H2O(g) △H1=-810kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g) △H2=+225kJ/mol
CO(g)+3H2(g) △H2=+225kJ/mol
④CO(g)+H2O(g) CO2(g)+H2(g) △H3=-35kJ/mol
CO2(g)+H2(g) △H3=-35kJ/mol
请回答下列问题:
(1)试计算反应①的△H=___ 。
(2)在某体积固定的绝热密闭容器中发生反应④,下列事实能证明反应已达平衡的是___ 。
(3)在某恒容密闭容器中加入一定量的甲烷和氧气发生反应③,使其充分反应,测得不同温度和压强下甲烷的转化率如图1所示,由该图可得出的结论是___ 。

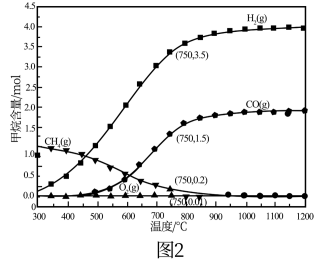
(4)现将2molCH4和1molO2加入某体积可变的密闭容器中,发生反应①。控制压强为1atm,测得不同温度下反应体系中各组分平衡含量如图2所示。实际生产中控制的温度为750℃,则此温度下CO的产率为___ ,若平衡时容器的体积为VL,则该反应的平衡常数K=___ 。(用含V代数式表示,不必化简)。
①2CH4(g)+O2(g)
 2CO(g)+4H2(g) △H
2CO(g)+4H2(g) △H已知如下反应:
②CH4(g)+2O2(g)
 CO2(g)+2H2O(g) △H1=-810kJ/mol
CO2(g)+2H2O(g) △H1=-810kJ/mol③CH4(g)+H2O(g)
 CO(g)+3H2(g) △H2=+225kJ/mol
CO(g)+3H2(g) △H2=+225kJ/mol④CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-35kJ/mol
CO2(g)+H2(g) △H3=-35kJ/mol请回答下列问题:
(1)试计算反应①的△H=
(2)在某体积固定的绝热密闭容器中发生反应④,下列事实能证明反应已达平衡的是
| A.容器内温度不再变化 | B.混合气体的平均分子量不再变化 |
| C.各组分的物质的量相等 | D.1molH—O键断裂同时有1molH—H键断裂 |

(4)现将2molCH4和1molO2加入某体积可变的密闭容器中,发生反应①。控制压强为1atm,测得不同温度下反应体系中各组分平衡含量如图2所示。实际生产中控制的温度为750℃,则此温度下CO的产率为

您最近一年使用:0次
名校
解题方法
4 . 近年来,雾霾已经给人类的生产生活带来了极大的危害。据分析,雾霾主要成分为灰尘、SO2、NOx、有机碳氢化合物等粒子。据研究,烟气脱硝是治理雾霾的方法之一。
Ⅰ.可用氨气作为脱硝剂,其脱硝原理是NH3与NO反应生成两种无毒的物质。
已知:①2NO(g)=N2(g)+O2(g) △H=akJ•mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=bkJ•mol-1
(1)写出该氨气脱硝反应的热化学反应方程式:_________ 。
(2)已知反应②在高温时自发,低温时非自发,则b______ 0(假设各物质在反应过程中状态均不发生变化,且均为气态)。(填“<”或“>”或“无法确定”)
Ⅱ.臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生该反应,相关信息如下表及图所示,回答下列问题:

(3)T1_____ T2(填“<”或“>”或“无法确定”),该反应的△H______ 0(填“<”“>”)
(4)在恒温恒容条件下,下列条件能够证明该反应已经达到平衡的是______ 。
a.混合气体密度不再改变 b.消耗2nmolNO2的同时,消耗了nmolO3 c.O2浓度不再改变 d.混合气体的平均相对分子质量不再改变 e.容器内混合气体压强不再改变 f.2υ正(NO2)=υ逆(O2)
(5)其他条件一定,且反应时间相同,NO2的转化率与温度、压强的关系如图所示。据此,回答下列问题:

②p1______ p2,(填“<”或“>”或“无法确定”);
②a点的正逆反应速率的关系为:υa正______ υa逆(填“<”或“>”或“无法确定”)
Ⅰ.可用氨气作为脱硝剂,其脱硝原理是NH3与NO反应生成两种无毒的物质。
已知:①2NO(g)=N2(g)+O2(g) △H=akJ•mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=bkJ•mol-1
(1)写出该氨气脱硝反应的热化学反应方程式:
(2)已知反应②在高温时自发,低温时非自发,则b
Ⅱ.臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生该反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | 1molO3和2molNO2 | 1molO3和2molNO2 |

(3)T1
(4)在恒温恒容条件下,下列条件能够证明该反应已经达到平衡的是
a.混合气体密度不再改变 b.消耗2nmolNO2的同时,消耗了nmolO3 c.O2浓度不再改变 d.混合气体的平均相对分子质量不再改变 e.容器内混合气体压强不再改变 f.2υ正(NO2)=υ逆(O2)
(5)其他条件一定,且反应时间相同,NO2的转化率与温度、压强的关系如图所示。据此,回答下列问题:

②p1
②a点的正逆反应速率的关系为:υa正
您最近一年使用:0次
2020-10-05更新
|
378次组卷
|
4卷引用:福建省福州第三中学2019-2020学年高二上学期期末考试化学试题
名校
解题方法
5 . 科学家积极探索新技术对CO2进行综合利用, CO2可用来合成低碳烃。
CO2(g) +4H2(g) CH4(g) + 2H2O(g) ΔH= a kJ/mol
CH4(g) + 2H2O(g) ΔH= a kJ/mol
(1)已知:①4H2(g)+ 2O2(g)=4H2O(g) △H=-967.2kJ/mol.
②CH4(g) + 2O2(g) =CO2(g) + 2H2O(g) ΔH=-802.0 kJ/mol.
请回答:①②这两个反应在热力学上趋势均很大,其原因是__________________ ; a=____________ kJ/mol。
(2)在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。
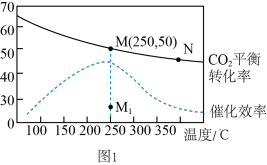
①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=______ MPa-2。(Kp是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×体积分数。)
②欲增加二氧化碳的平衡转化率,可采取的措施有__________ 。
A.通入惰性气体 B.提高温度
C.增加二氧化碳浓度 D.增加氢气浓度
③下列说法正确的是_________ 。
A.平衡常数大小:KN>KM
B.其他条件不变,若不使用催化剂,则250℃ 时CO2的平衡转化率可能位于点M1
C.图1中M点时,甲烷的体积分数为12.5%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(3)新型高效的甲烷燃料电池工作时总反应式:CH4+2O2=CO2+2H2O。
①该电池的负极是___________ (填a或b),②负极电极反应式为___________ ;
CO2(g) +4H2(g)
 CH4(g) + 2H2O(g) ΔH= a kJ/mol
CH4(g) + 2H2O(g) ΔH= a kJ/mol (1)已知:①4H2(g)+ 2O2(g)=4H2O(g) △H=-967.2kJ/mol.
②CH4(g) + 2O2(g) =CO2(g) + 2H2O(g) ΔH=-802.0 kJ/mol.
请回答:①②这两个反应在热力学上趋势均很大,其原因是
(2)在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。

①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=
②欲增加二氧化碳的平衡转化率,可采取的措施有
A.通入惰性气体 B.提高温度
C.增加二氧化碳浓度 D.增加氢气浓度

③下列说法正确的是
A.平衡常数大小:KN>KM
B.其他条件不变,若不使用催化剂,则250℃ 时CO2的平衡转化率可能位于点M1
C.图1中M点时,甲烷的体积分数为12.5%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(3)新型高效的甲烷燃料电池工作时总反应式:CH4+2O2=CO2+2H2O。
①该电池的负极是
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.含氮化合物在工农业生产中都有重要应用。
(1)已知:
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-541.8 kJ/mol,化学平衡常数为K1
2N2(g)+6H2O(g) △H=-541.8 kJ/mol,化学平衡常数为K1
N2H4(g)+O2(g) N2(g)+2H2O(g) △H=-534 kJ/mol,化学平衡常数为K2
N2(g)+2H2O(g) △H=-534 kJ/mol,化学平衡常数为K2
则用NH3和O2制取N2H4的热化学方程式为__________________________________ ,该反应的化学平衡常数K=_______ (用K1、K2表示)。
(2)对于2NO(g)+2CO(g) N2(g)+2CO2(g) 在一定温度下,在1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。下图为容器内的压强(P)与起始压强(P0)的比值(
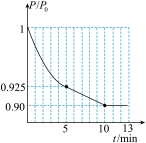
N2(g)+2CO2(g) 在一定温度下,在1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。下图为容器内的压强(P)与起始压强(P0)的比值(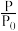 )随时间(t)的变化曲线,0~5 min内,该反应的平均反应速率v(N2)=
)随时间(t)的变化曲线,0~5 min内,该反应的平均反应速率v(N2)=______ ,平衡时NO的转化率为________ 。
Ⅱ.2NH3(g)+CO2(g) NH2COONH4(s)
NH2COONH4(s)
(3)该反应能正向自发进行的原因是_____________________ 。
(4)恒温恒容下通入2 mol NH3和1 mol CO2进行上述反应,下列事实能证明反应已达平衡的是__________ 。
A.体系压强保持不变 B.气体平均密度保持不变
C.气体的平均摩尔质量保持不变 D.氨气的体积分数不变
Ⅲ.在恒温恒压 条件下,向某密闭容器中通入2 mol SO2和1 mol O2,发生2SO2(g)+O2(g) 2SO3(g)反应,达到平衡后,t1时刻再向该容器中通入2 mol SO2和1 mol O2,请在下图中画出从t1时刻到再次达到化学平衡后的正逆反应速率随时间变化图像
2SO3(g)反应,达到平衡后,t1时刻再向该容器中通入2 mol SO2和1 mol O2,请在下图中画出从t1时刻到再次达到化学平衡后的正逆反应速率随时间变化图像________ 。

(1)已知:
4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H=-541.8 kJ/mol,化学平衡常数为K1
2N2(g)+6H2O(g) △H=-541.8 kJ/mol,化学平衡常数为K1N2H4(g)+O2(g)
 N2(g)+2H2O(g) △H=-534 kJ/mol,化学平衡常数为K2
N2(g)+2H2O(g) △H=-534 kJ/mol,化学平衡常数为K2则用NH3和O2制取N2H4的热化学方程式为
(2)对于2NO(g)+2CO(g)
 N2(g)+2CO2(g) 在一定温度下,在1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。下图为容器内的压强(P)与起始压强(P0)的比值(
N2(g)+2CO2(g) 在一定温度下,在1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。下图为容器内的压强(P)与起始压强(P0)的比值(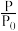 )随时间(t)的变化曲线,0~5 min内,该反应的平均反应速率v(N2)=
)随时间(t)的变化曲线,0~5 min内,该反应的平均反应速率v(N2)=
Ⅱ.2NH3(g)+CO2(g)
 NH2COONH4(s)
NH2COONH4(s)(3)该反应能正向自发进行的原因是
(4)恒温恒容下通入2 mol NH3和1 mol CO2进行上述反应,下列事实能证明反应已达平衡的是
A.体系压强保持不变 B.气体平均密度保持不变
C.气体的平均摩尔质量保持不变 D.氨气的体积分数不变
Ⅲ.在
 2SO3(g)反应,达到平衡后,t1时刻再向该容器中通入2 mol SO2和1 mol O2,请在下图中画出从t1时刻到再次达到化学平衡后的正逆反应速率随时间变化图像
2SO3(g)反应,达到平衡后,t1时刻再向该容器中通入2 mol SO2和1 mol O2,请在下图中画出从t1时刻到再次达到化学平衡后的正逆反应速率随时间变化图像
您最近一年使用:0次
解题方法
7 . 2017年11月联合国气候大会在德国波恩开幕,CO2的回收利用再一次提上了日程。
I利用CO2制取丙烯(C3H6)
(1)用CO2催化加氢可制取丙烯的原理为:3CO2(g)+9H2(g) C3H6(g)+6H2O(g) △H。
C3H6(g)+6H2O(g) △H。
已知热化学方程式如下
①2C2H6(g)+9O2(g)=6CO2(g)+6H2O(l) △H1;
②2H2O(g)=2H2(g)+O2(g) ΔH2;
③H2O(g)==H2O(l) △H3;
则制取丙烯反应的△H=______ (用△H1、△H2、△H3表示)。
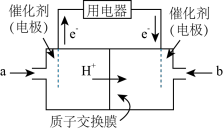
(2)以稀磷酸为电解质溶液,以石墨为电极,利用太阳能电池将CO2转化为丙烯的工作原理如下图所示。

①电解池中的交换膜为_______ :(填“阴”或“阳")离子交换膜,通过交换的离子是_______ (填离子符号)。
②阴极的电极反应为_____________________________ 。
II.利用CO2制取二甲醚(CH3OCH3)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
比n(H2)/n(CO2)]的变化曲线如下左图:

①在其他条件不变时,在右图中画出平衡时CH3OCH3的体积分数随投料比n(H2)/n(CO2)交化的曲线图____________ 。
②某温度下将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是____________ 。

A.P4>P3>P2>P1B .T4>T3>T2>T1C.P1>P2>P3>P4D. T1>T2>T3>T4.
III利用CO2制取甲醇(CH3OH)
用CO2催化加氢制取甲醇的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示

(4)不能证明该反应达到化学平衡状态的是___________ 。
A.气体的总压强不变
B. CH3OH(g)和H2O(g)的物质的量之比不变
C.混合气体的密度不再不变
D.单位时间内断裂3NA个H—H键同时形成2NA个C=O键
(5)仅改变某个反应条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线I、II所示。曲线Ⅱ对应的实验条件改变是_____________ 。
I利用CO2制取丙烯(C3H6)
(1)用CO2催化加氢可制取丙烯的原理为:3CO2(g)+9H2(g)
 C3H6(g)+6H2O(g) △H。
C3H6(g)+6H2O(g) △H。已知热化学方程式如下
①2C2H6(g)+9O2(g)=6CO2(g)+6H2O(l) △H1;
②2H2O(g)=2H2(g)+O2(g) ΔH2;
③H2O(g)==H2O(l) △H3;
则制取丙烯反应的△H=
(2)以稀磷酸为电解质溶液,以石墨为电极,利用太阳能电池将CO2转化为丙烯的工作原理如下图所示。

①电解池中的交换膜为
②阴极的电极反应为
II.利用CO2制取二甲醚(CH3OCH3)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料
CH3OCH3(g)+3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比n(H2)/n(CO2)]的变化曲线如下左图:

①在其他条件不变时,在右图中画出平衡时CH3OCH3的体积分数随投料比n(H2)/n(CO2)交化的曲线图
②某温度下将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是

A.P4>P3>P2>P1B .T4>T3>T2>T1C.P1>P2>P3>P4D. T1>T2>T3>T4.
III利用CO2制取甲醇(CH3OH)
用CO2催化加氢制取甲醇的反应为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
CH3OH(g)+H2O(g) △H=-b kJ·mol—1(b>0)。T℃时,将 1 mol CO2和4molH2充入的密闭溶液中,测得H2的物质的量随时间变化如图中实线所示
(4)不能证明该反应达到化学平衡状态的是
A.气体的总压强不变
B. CH3OH(g)和H2O(g)的物质的量之比不变
C.混合气体的密度不再不变
D.单位时间内断裂3NA个H—H键同时形成2NA个C=O键
(5)仅改变某个反应条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线I、II所示。曲线Ⅱ对应的实验条件改变是
您最近一年使用:0次
8 . 面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________ 。
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。

①p1________ p2(填“大于”、“小于”或“等于”);
②在温度和容积不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率________ (填“增大”、“减小”或“不变”,下同),平衡常数________ 。
(3)关于CO(g)+2H2(g) CH3OH(g) ΔH1=-90 kJ·mol-1 正确的是
CH3OH(g) ΔH1=-90 kJ·mol-1 正确的是_____________________
A.温度和压强一定时,混合气体的密度不再变化,证明已经达到平衡状态
B. 2V(CO)正= V(H2)逆
C.温度和体积一定时,容器内压强不变,证明已经达到平衡状态
D.百分比组成2W(CO)=W(H2),证明已经达到平衡状态
E.混合气体的平均相对分子质量不再改变的状态,证明已经达到平衡状态
F.温度越高越有利于该反应自发进行
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)
 CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH2=-41 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41 kJ·mol-1写出由二氧化碳、氢气制备甲醇的热化学方程式:
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。

①p1
②在温度和容积不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率
(3)关于CO(g)+2H2(g)
 CH3OH(g) ΔH1=-90 kJ·mol-1 正确的是
CH3OH(g) ΔH1=-90 kJ·mol-1 正确的是A.温度和压强一定时,混合气体的密度不再变化,证明已经达到平衡状态
B. 2V(CO)正= V(H2)逆
C.温度和体积一定时,容器内压强不变,证明已经达到平衡状态
D.百分比组成2W(CO)=W(H2),证明已经达到平衡状态
E.混合气体的平均相对分子质量不再改变的状态,证明已经达到平衡状态
F.温度越高越有利于该反应自发进行
您最近一年使用:0次
9 . 二氧化碳是导致温室效应的主要气体,其对应的水溶液碳酸是可乐饮料的主要成分之一。回答下列问题:
(1)下列事实中,能证明碳酸是弱酸的是________
A.碳酸不稳定,易分解为二氧化碳和水
B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍
C.相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液
D.常温下,5.0×10-6mol/L的碳酸溶液pH值为6
(2)煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH=Q1kJ/mol
途径II:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH=Q2kJ/mol
再燃烧水煤气:CO(g)+1/2O2(g)=CO2(g) ΔH=Q3kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH=Q4kJ/mol
则Q1、Q2、Q3、Q4的数学关系式是___________________________________ ;
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol/L。
①若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=_______ ,该步电离的电离度α=______ (已知:10-5.6=2.5×10-6,保留一位小数);
②常温下,0.10 mol/L NaHCO3溶液的pH等于8.0,则此时溶液中c(H2CO3)_____ c(CO32-)(填“>”“=”或“<”),原因是__________________________________________________ ;(用离子方程式和必要的文字说明);
③向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是_________
A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液
(1)下列事实中,能证明碳酸是弱酸的是
A.碳酸不稳定,易分解为二氧化碳和水
B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍
C.相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液
D.常温下,5.0×10-6mol/L的碳酸溶液pH值为6
(2)煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH=Q1kJ/mol
途径II:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH=Q2kJ/mol
再燃烧水煤气:CO(g)+1/2O2(g)=CO2(g) ΔH=Q3kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH=Q4kJ/mol
则Q1、Q2、Q3、Q4的数学关系式是
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol/L。
①若忽略水的电离及H2CO3的第二级电离,则H2CO3
 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=②常温下,0.10 mol/L NaHCO3溶液的pH等于8.0,则此时溶液中c(H2CO3)
③向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是
A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液
您最近一年使用:0次
名校
10 . 某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

(1)装置甲中盛放浓硝酸的仪器A的名称是______ ,该装置中发生反应的化学方程式为________________________ 。
(2) 装置丙中的试管内发生反应的离子方程式为:_______________________ 。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是________ 。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________ 色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为________ 色。
(5)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是_____________ 。

(1)装置甲中盛放浓硝酸的仪器A的名称是
(2) 装置丙中的试管内发生反应的离子方程式为:
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为
(5)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是
您最近一年使用:0次
2017-10-30更新
|
447次组卷
|
3卷引用:湖北省鄂州市2018-2019学年高二高中质量监测化学试题



