名校
1 . H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:___________________________________________ 。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。

①从反应开始到平衡,CO2的平均反应速率v(CO2)=___________________ 。
②达到平衡时,H2的转化率为__________ 。
③该反应的平衡常数K=___________________ (表达式)。
④下列措施不能提高反应速率的是__________ 。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
(1)已知25℃,1.01×105Pa时,8.0g CH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写出该反应的热化学反应方程式:
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g) + H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的转化率为
③该反应的平衡常数K=
④下列措施不能提高反应速率的是
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g) + 2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
您最近一年使用:0次
2018-07-24更新
|
328次组卷
|
4卷引用:【全国市级联考】江苏省无锡市普通高中2017-2018学年高一下学期期末考试化学试题
【全国市级联考】江苏省无锡市普通高中2017-2018学年高一下学期期末考试化学试题【全国百强校】内蒙古集宁一中(西校区)2017-2018学年高一下学期期末考试化学试题(已下线)【新东方】高中化学140(已下线)2022年浙江1月高考真题变式题(26-31)
2 . (1)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)═2H+(aq)+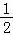 O2(g)+2e﹣△H=+284kJ/mol
O2(g)+2e﹣△H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)═2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e﹣═C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=﹣1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式_________ .
(2)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.
测得CO2和CH3OH(g)的浓度随时间变化如图1所示
①一定温度下,不能说明该反应达到平衡状态的是:_________ (填序号)
a.体系的压强不再改变
b.体系的密度不再改变
c.各气体的浓度不再改变
d.各气体的质量分数不再改变
e.反应速率v(CO2)正∶v(H2)逆=1∶3
②从反应开始到平衡,氢气的平均反应速率v(H2)=________ mol/(L•min);
③氢气的转化率=____________ ;
④该反应的平衡常数为K=_________ 保留三位有效数字);
⑤下列措施中能使平衡体系中n(CH3OH)/ n(CO2)增大的是________ .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑥当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1____ c2的关系(填>、<、=).
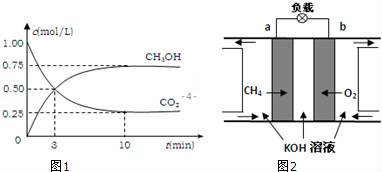
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池(在上面).请回答:
①通入甲烷一极的电极反应式为___________ ;
②随着电池不断放电,电解质溶液的pH______ (填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率____ (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
④用该燃料电池以石墨电极电解2.0L 0.25 mol·L-1 CuSO4溶液,5min后在一个电极上有6.4gCu析出。则阳极的电极反应式为____________________ ; 此时得到的O2在标准状况下的体积为______ L;向电解后的溶液中加入下列哪种物质可使电解质溶液恢复原来的浓度:____________
A. CuSO4 B.H2O C.CuO D.CuCO3
Ⅰ、H2O(l)═2H+(aq)+
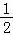 O2(g)+2e﹣△H=+284kJ/mol
O2(g)+2e﹣△H=+284kJ/molⅡ、CO2(g)+C5(s)+2H+(aq)═2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e﹣═C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=﹣1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
(2)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示

①一定温度下,不能说明该反应达到平衡状态的是:
a.体系的压强不再改变
b.体系的密度不再改变
c.各气体的浓度不再改变
d.各气体的质量分数不再改变
e.反应速率v(CO2)正∶v(H2)逆=1∶3
②从反应开始到平衡,氢气的平均反应速率v(H2)=
③氢气的转化率=
④该反应的平衡常数为K=
⑤下列措施中能使平衡体系中n(CH3OH)/ n(CO2)增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑥当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池(在上面).请回答:
①通入甲烷一极的电极反应式为
②随着电池不断放电,电解质溶液的pH
③通常情况下,甲烷燃料电池的能量利用率
④用该燃料电池以石墨电极电解2.0L 0.25 mol·L-1 CuSO4溶液,5min后在一个电极上有6.4gCu析出。则阳极的电极反应式为
A. CuSO4 B.H2O C.CuO D.CuCO3
您最近一年使用:0次
名校
解题方法
3 . 将CO2转化成C2H4可以变废为宝、改善环境。以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
Ⅰ.CO2(g) + C2H6(g) C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
Ⅱ.C2H6(g) CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
(1)反应I的反应历程可分为如下两步:
i.C2H6(g) C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
ii.H2(g)+CO2(g) H2O(g)+CO(g) ∆H2 (反应速率较慢)
H2O(g)+CO(g) ∆H2 (反应速率较慢)
①∆H2 =______ kJ·mol-1
②相比于提高c(C2H6),提高c(CO2) 对反应I速率影响更大,原因是______ 。
(2)0.1 MPa时向密闭容器中充入CO2和C2H6,温度对催化剂K-Fe-Mn/Si-2 性能的影响如图所示:
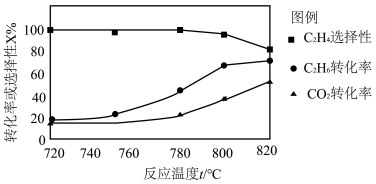
① 工业生产中反应I选择800℃,原因是______ 。
② 800℃时,不同的CO2和C2H6体积比对反应影响的实验数据如下表:
a. 随 增大, CO2转化率将
增大, CO2转化率将______ (填“增大”或“减小”)。
b. 解释 对产物中C2H4的质量分数影响的原因:
对产物中C2H4的质量分数影响的原因:______ 。
(3)我国科学家使用电化学的方法(装置如图)

用C2H6 和CO2合成了C2H4。
①N是电源的______ 极。
②阳极电极反应式是______ 。
Ⅰ.CO2(g) + C2H6(g)
 C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)
C2H4(g)+H2O(g)+CO(g) ∆H = +177 kJ·mol-1(主反应)Ⅱ.C2H6(g)
 CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)
CH4(g)+H2(g)+C(s) ∆H = +9kJ·mol-1 (副反应)(1)反应I的反应历程可分为如下两步:
i.C2H6(g)
 C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)
C2H4(g)+H2(g) ∆H1 = +136 kJ·mol-1(反应速率较快)ii.H2(g)+CO2(g)
 H2O(g)+CO(g) ∆H2 (反应速率较慢)
H2O(g)+CO(g) ∆H2 (反应速率较慢)①∆H2 =
②相比于提高c(C2H6),提高c(CO2) 对反应I速率影响更大,原因是
(2)0.1 MPa时向密闭容器中充入CO2和C2H6,温度对催化剂K-Fe-Mn/Si-2 性能的影响如图所示:

① 工业生产中反应I选择800℃,原因是
② 800℃时,不同的CO2和C2H6体积比对反应影响的实验数据如下表:
 | 平衡时有机产物的质量分数 | |
| CH4 | C2H4 | |
| 15.0/15.0 | 7.7 | 92.3 |
| 20.0/10.0 | 6.4 | 93.6 |
| 24.0 /6.0 | 4.5 | 95.5 |
 增大, CO2转化率将
增大, CO2转化率将b. 解释
 对产物中C2H4的质量分数影响的原因:
对产物中C2H4的质量分数影响的原因:(3)我国科学家使用电化学的方法(装置如图)

用C2H6 和CO2合成了C2H4。
①N是电源的
②阳极电极反应式是
您最近一年使用:0次
2020-11-09更新
|
274次组卷
|
4卷引用:北京市朝阳区2021届高三上学期期中质量检测化学试题
名校
4 . 碳是形成化合物种类最多的元素,其单质及其部分化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ;ΔH=+88.6 kJ·mol-1。
;ΔH=+88.6 kJ·mol-1。
则M、N相比,较稳定的是____ 。
(2)工业生产可利用CO从燃煤烟气中脱硫。
已知S(s)的燃烧热(△H)为-mkJ/mol。CO与O2反应的能量变化如下图所示,则CO从燃煤烟气中脱硫的热化学方程式为__________________ (△H用含m的代数式表示) 。

(3)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ·mol-1,CH3OH(l)+ O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a____ (填“>”“ <”或“=”) 238.6。
(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为______ 。
(5)实验室用该耐高温材料废料(含Al2O3、TiC及少量C和Fe2O3)制备净水剂——液体聚合硫酸铝铁[AlFe(OH)n(SO4)m],操作步骤如下(部分操作和条件略):
I.向废料中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
①写出步骤I主反应的化学反应方程式__________________________________________ ,
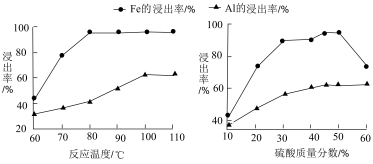
②步骤I中反应温度与H2SO4的质量分数会影响铁与铝的浸出率。根据下图分析,
步骤I中反应的适宜温度是_______ ,H2SO4质量分数的适宜范围是_________ .
③步骤II中加入双氧水所发生的离子方程式是_______________________ 。
④.......
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ;ΔH=+88.6 kJ·mol-1。
;ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是
(2)工业生产可利用CO从燃煤烟气中脱硫。
已知S(s)的燃烧热(△H)为-mkJ/mol。CO与O2反应的能量变化如下图所示,则CO从燃煤烟气中脱硫的热化学方程式为

(3)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ·mol-1,CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a(4)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为
(5)实验室用该耐高温材料废料(含Al2O3、TiC及少量C和Fe2O3)制备净水剂——液体聚合硫酸铝铁[AlFe(OH)n(SO4)m],操作步骤如下(部分操作和条件略):
I.向废料中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
①写出步骤I主反应的化学反应方程式
②步骤I中反应温度与H2SO4的质量分数会影响铁与铝的浸出率。根据下图分析,
步骤I中反应的适宜温度是

③步骤II中加入双氧水所发生的离子方程式是
④.......
您最近一年使用:0次
2020-11-09更新
|
324次组卷
|
4卷引用:江西省南昌市第二中学2021届高三上学期第四次考试理综化学试题
5 . HCN是常见的化工原料,其有机衍生物往往以甙的形式广泛存在于植物界中。
(1)HCN中三种元素的电负性从大到小的顺序为___ 。
(2)室温时HCN的Ka=6.2×10-10,写出HCN的电离方程式:___ ;向NaCN溶液中通入CO2,发生反应的离子方程式为___ (H2CO3的Ka1=4.45×10-7、Ka2=4.7×10-11)。
(3)已知下列热化学反应:
N2(g)+3H2(g)=2NH3(g) ΔH1=-91.8kJ·mol-1
C(s)+2H2(g)=CH4(g) ΔH2=-75.0kJ·mol-1
H2(g)+2C(s)+N2(g)=2HCN(g) ΔH3=+270.0kJ·mol-1
则反应NH3(g)+CH4(g)=HCN(g)+3H2(g)的ΔH=___ kJ·mol-1。
(4)测定木薯肉水解产物中HCN含量的步骤如下:称取ag木薯肉进行水解,将产生的HCN蒸出,用V1mLc1mol·L-1Hg(NO3)2溶液吸收HCN,[Hg(NO3)2+2HCN=Hg(CN)2+2HNO3];以NH4Fe(SO4)2·12H2O作指示剂,用c2mol·L-1KSCN标准溶液滴定上述剩余的Hg(NO3)2,[Hg(NO3)2+2KSCN=Hg(SCN)2+2KNO3];滴定至终点时消耗KSCN溶液V2mL。该木薯肉样品中所含HCN的质量分数c(HCN)=___ (用c1、c2、V1、V2表示)。
(1)HCN中三种元素的电负性从大到小的顺序为
(2)室温时HCN的Ka=6.2×10-10,写出HCN的电离方程式:
(3)已知下列热化学反应:
N2(g)+3H2(g)=2NH3(g) ΔH1=-91.8kJ·mol-1
C(s)+2H2(g)=CH4(g) ΔH2=-75.0kJ·mol-1
H2(g)+2C(s)+N2(g)=2HCN(g) ΔH3=+270.0kJ·mol-1
则反应NH3(g)+CH4(g)=HCN(g)+3H2(g)的ΔH=
(4)测定木薯肉水解产物中HCN含量的步骤如下:称取ag木薯肉进行水解,将产生的HCN蒸出,用V1mLc1mol·L-1Hg(NO3)2溶液吸收HCN,[Hg(NO3)2+2HCN=Hg(CN)2+2HNO3];以NH4Fe(SO4)2·12H2O作指示剂,用c2mol·L-1KSCN标准溶液滴定上述剩余的Hg(NO3)2,[Hg(NO3)2+2KSCN=Hg(SCN)2+2KNO3];滴定至终点时消耗KSCN溶液V2mL。该木薯肉样品中所含HCN的质量分数c(HCN)=
您最近一年使用:0次
解题方法
6 . 近年来,如何降低大气中CO2含量及有效开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为___________ ,在四个反应中一定是氧化还原反应的是(填数字符号)___________ 。

(2)把煤作为燃料有下列两种使用途径:
途径Ⅰ:C(s)+O2(g)=CO2(g) ΔH1<0;
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0;
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) ΔH3<0,
2H2(g)+O2(g)=2H2O(g) ΔH4<0。
则对等量碳而言途径Ⅰ放出的热量___________ (填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v(正)___________ v(逆)(填“>”、“<”或“=”)。
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
则反应N2(g)+3F2(g)=2NF3(g)的ΔH=___________
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为

(2)把煤作为燃料有下列两种使用途径:
途径Ⅰ:C(s)+O2(g)=CO2(g) ΔH1<0;
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0;
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) ΔH3<0,
2H2(g)+O2(g)=2H2O(g) ΔH4<0。
则对等量碳而言途径Ⅰ放出的热量
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v(正)
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
| 化学键 | N≡N | F—F | N—F |
| 键能(kJ·mol-1) | 941.7 | 154.8 | 283.0 |
则反应N2(g)+3F2(g)=2NF3(g)的ΔH=
您最近一年使用:0次
解题方法
7 . 石油加氢精制和天然气净化等过程产生有毒的H2S,直接排放会污染空气。
(1)一种脱硫工艺为:真空K2CO3-克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数的对数值为lgK=______ 。(已知:H2CO3lgK1= -6.4,lgK2=-10.3;H2S lgK1ˊ= -7,lgK2ˊ= -19)
②已知下列热化学方程式:
2H2S(g) +3O2(g)=2SO2(g)+2H2O(l) ΔH1= -1172kJ·mol-1
2H2S(g) +O2(g)=2S (s) +2H2O(l)△H2= -632 kJ·mol-1
克劳斯法回收硫的反应为SO2气体和H2S气体反应生成S(s),则该反应的热化学方程式为______ 。
(2)工业采用高温分解H2S制取氢气,2H2S(g) 2H2(g) +S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g) +S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。

①反应2H2S(g)⇌2H2(g) + S2(g)的ΔH_____ (填“>”“<”或“=”) 0。
②985℃时,反应经过5 s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2) =______ ,下列各项不能作为该反应达到平衡状态的标志的是______ 。
A.压强不再变化
B.气体密度不再变化
C.气体的平均相对分子质量不再变化
D. H2的消耗速率与S2的消耗速率之比为2:1
E. S2的在体系中质量分数保持不变
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是______ 。
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。

①装置中微电池负极的电极反应式:______
②当有16gS2析出时,有______ mol H+经质子膜进入正极区。
(1)一种脱硫工艺为:真空K2CO3-克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数的对数值为lgK=
②已知下列热化学方程式:
2H2S(g) +3O2(g)=2SO2(g)+2H2O(l) ΔH1= -1172kJ·mol-1
2H2S(g) +O2(g)=2S (s) +2H2O(l)△H2= -632 kJ·mol-1
克劳斯法回收硫的反应为SO2气体和H2S气体反应生成S(s),则该反应的热化学方程式为
(2)工业采用高温分解H2S制取氢气,2H2S(g)
 2H2(g) +S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g) +S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
①反应2H2S(g)⇌2H2(g) + S2(g)的ΔH
②985℃时,反应经过5 s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2) =
A.压强不再变化
B.气体密度不再变化
C.气体的平均相对分子质量不再变化
D. H2的消耗速率与S2的消耗速率之比为2:1
E. S2的在体系中质量分数保持不变
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。

①装置中微电池负极的电极反应式:
②当有16gS2析出时,有
您最近一年使用:0次
8 . 氢气(H2)是最理想的燃料。回答下列问题:
(1)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为___________ 。
(2)氢气作为燃料的优点是________________ (写出一点即可)。目前,氢氧燃料电池已经使用于汽车。若该电池的电解质呈碱性,写出负极电池反应式:_____________ ;若该电池的电解质呈酸性,写出正极电池反应式:________________ 。
(3)氢气可制备H2O2。工业上较为成熟的方法是蒽醌法,其原理是:烷基蒽醌与有机溶剂配制成工作溶液,在压力为0.30MPa、温度55~65℃、有催化剂存在的条件下,通入氢气进行氢化,在40~44℃温度下与空气(或氧气)进行逆流氧化,经萃取、再生、精制与浓缩制得质量分数为20%~30%的过氧化氢水溶液产品。上述过程可用以下反应表示:
I.H2(g)+A(l)=B(l) △H1
II.O2(g)+B(l)=A(l)+H2O2(l) △H2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)=H2O2(l)的△H_________ (填“>”“<”或“=”)0。
(4)金属氢化物(NaH、MgH2等)是常用的储氢材料,写出MgH2与水反应的化学方程式:__________________ 。
(1)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为
(2)氢气作为燃料的优点是
(3)氢气可制备H2O2。工业上较为成熟的方法是蒽醌法,其原理是:烷基蒽醌与有机溶剂配制成工作溶液,在压力为0.30MPa、温度55~65℃、有催化剂存在的条件下,通入氢气进行氢化,在40~44℃温度下与空气(或氧气)进行逆流氧化,经萃取、再生、精制与浓缩制得质量分数为20%~30%的过氧化氢水溶液产品。上述过程可用以下反应表示:
I.H2(g)+A(l)=B(l) △H1
II.O2(g)+B(l)=A(l)+H2O2(l) △H2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)=H2O2(l)的△H
(4)金属氢化物(NaH、MgH2等)是常用的储氢材料,写出MgH2与水反应的化学方程式:
您最近一年使用:0次
9 . 十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
汽车的排气管上安装“催化转化器”,发生反应①:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5 kJ·mol-1。
2CO2(g)+N2(g) △H=-746.5 kJ·mol-1。
(1)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如图。

①图中a,b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__ 。(填“a”或“b”)
②T℃时,该反应的化学平衡常数K=__ ;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将__ 移动。(填“向左”、“向右”或“不”)
③15min时,若改变外界反应条件,导致n(NO)发生图中所示变化,则改变的条件可能是___ (任答一条即可)。
④又已知:反应②N2(g)+O2(g) 2NO(g) △H2=+180.5 kJ·mol-1,则CO的燃烧热△H=
2NO(g) △H2=+180.5 kJ·mol-1,则CO的燃烧热△H=__ 。
(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应①,如图为平衡时NO的体积分数与温度、压强的关系。

①温度:T1__ T2(填“<”或“>”)。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____ 点。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝原理,其脱硝率(脱硝率即NO的转化率)与温度、负载率(分子筛中催化剂的质量分数)的关系如图所示。

为达到最佳脱硝效果,应采取的条件是________ 。
汽车的排气管上安装“催化转化器”,发生反应①:2NO(g)+2CO(g)
 2CO2(g)+N2(g) △H=-746.5 kJ·mol-1。
2CO2(g)+N2(g) △H=-746.5 kJ·mol-1。(1)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如图。

①图中a,b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是
②T℃时,该反应的化学平衡常数K=
③15min时,若改变外界反应条件,导致n(NO)发生图中所示变化,则改变的条件可能是
④又已知:反应②N2(g)+O2(g)
 2NO(g) △H2=+180.5 kJ·mol-1,则CO的燃烧热△H=
2NO(g) △H2=+180.5 kJ·mol-1,则CO的燃烧热△H=(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应①,如图为平衡时NO的体积分数与温度、压强的关系。

①温度:T1
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝原理,其脱硝率(脱硝率即NO的转化率)与温度、负载率(分子筛中催化剂的质量分数)的关系如图所示。

为达到最佳脱硝效果,应采取的条件是
您最近一年使用:0次
名校
解题方法
10 . 用甲醇(CH3OH)制备一些高附加值产品,是目前研究的热点。
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ. CH3OH(g)+H2O(g) 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1
反应Ⅱ. H2(g)+CO2(g) H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1
反应Ⅲ. CH3OH(g) 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1
反应Ⅳ. 2CH3OH(g) 2H2O(g)+C2H4(g) △H4= c kJ·mol-1
2H2O(g)+C2H4(g) △H4= c kJ·mol-1
①△H1=______ kJ·mol-1 。
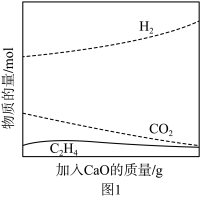
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,请分析加入CaO提高氢气产率的原因:______ 。
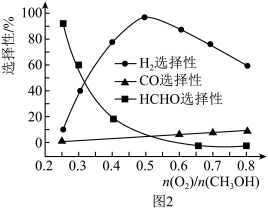
③在一定条件下用氧气催化氧化甲醇制氢气,原料气中 对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制 =
=______ ,当 = 0.25时,CH3OH和O2发生的主要反应方程式为
= 0.25时,CH3OH和O2发生的主要反应方程式为______ 。
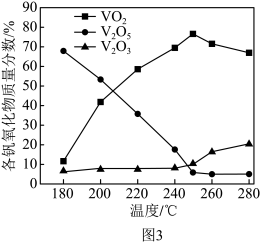
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1000kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是______ 。
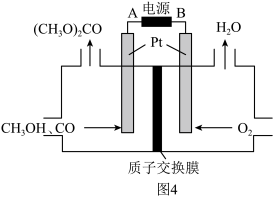
(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。
①电源的负极为______ (填“A”或“B”)。
②阳极的电极反应式为______ 。
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ. CH3OH(g)+H2O(g)
 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1反应Ⅱ. H2(g)+CO2(g)
 H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1反应Ⅲ. CH3OH(g)
 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1 反应Ⅳ. 2CH3OH(g)
 2H2O(g)+C2H4(g) △H4= c kJ·mol-1
2H2O(g)+C2H4(g) △H4= c kJ·mol-1①△H1=
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,请分析加入CaO提高氢气产率的原因:

③在一定条件下用氧气催化氧化甲醇制氢气,原料气中
 对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制 =
= = 0.25时,CH3OH和O2发生的主要反应方程式为
= 0.25时,CH3OH和O2发生的主要反应方程式为
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1000kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是

(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。
①电源的负极为
②阳极的电极反应式为

您最近一年使用:0次
2020-01-19更新
|
315次组卷
|
3卷引用:江苏省无锡市普通高中2019-2020学年高三上学期期终调研试化学试题



