1 . 甲烷是一种重要的化工原料,在生产中有着重要的应用。
I.工业上以CH4和H2O为原料,通过下列反应来制备甲醇:
①CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H=-129.0kJ•mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为___________ 。
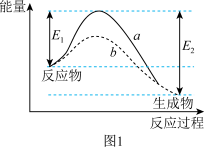
(2)1932年,美国理论化学家亨利·艾琳等人在统计力学和量子力学的基础上建立了过渡态理论,认为催化剂主要是通过改变过渡态物质而降低了活化能。对于反应②,在使用和未使用催化剂时,反应过程和能量的对应关系如图1所示。使用了催化剂的曲线是___________ (填“a”或“b”);断裂反应物中的化学键吸收的总能量___________ (填“>”、“<”或“=”)形成生成物中的化学键释放的总能量。
II.甲烷还可以制作燃料电池。如图2是甲烷燃料电池原理示意图,回答下列问题:
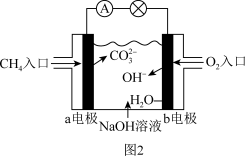
已知:总反应为CH4+2O2+2NaOH=Na2CO3+3H2O
(3)该装置的能量转换形式是___________ 。
(4)电池的负极是___________ (填“a”或“b”),该极的电极反应是 ___________ 。
(5)电池工作一段时间后电解质溶液的碱性___________ (填“增强”、“减弱”或“不变”)。
(6)标准状况下,消耗3.36L甲烷,电路中转移的电子数目为___________ 。
I.工业上以CH4和H2O为原料,通过下列反应来制备甲醇:
①CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H=-129.0kJ•mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为
(2)1932年,美国理论化学家亨利·艾琳等人在统计力学和量子力学的基础上建立了过渡态理论,认为催化剂主要是通过改变过渡态物质而降低了活化能。对于反应②,在使用和未使用催化剂时,反应过程和能量的对应关系如图1所示。使用了催化剂的曲线是

II.甲烷还可以制作燃料电池。如图2是甲烷燃料电池原理示意图,回答下列问题:

已知:总反应为CH4+2O2+2NaOH=Na2CO3+3H2O
(3)该装置的能量转换形式是
(4)电池的负极是
(5)电池工作一段时间后电解质溶液的碱性
(6)标准状况下,消耗3.36L甲烷,电路中转移的电子数目为
您最近一年使用:0次
2 . 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g)ΔH。若:N
N2(g)+3H2(g)ΔH。若:N N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=
N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=____________ (用含(a、b、c的代数式表示)kJ•mol-1。
(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位mmol•min-1)与催化剂的对应关系如表所示。
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是____________ (填写催化剂的化学式)。
②温度为T时.在恒容的密闭容器中加入2molNH3此时压强为p0用Ru催化氨气分解,若平衡时氨气的转化率为50%.,则该温度下反应2NH3(g) N2(g)+3H2(g)的化学平衡常数Kp=
N2(g)+3H2(g)的化学平衡常数Kp=____________ 。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
(3)关于合成氨工艺的理解,下列说法不正确的是____________ (填字母)。
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru.,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)电化学法合成氨:利用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3原理示意如图所示。

①Pt—C3N4,电极上产生NH3的电极反应式为____________ 。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:____________ 。
(1)氨气分解反应的热化学方程式如下:2NH3(g)
 N2(g)+3H2(g)ΔH。若:N
N2(g)+3H2(g)ΔH。若:N N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=
N键、H—H键和N—H键的键能值分别记作a、b和c(单位,kJ•mol-1),则上述反应的ΔH=(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位mmol•min-1)与催化剂的对应关系如表所示。
| 催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
| 初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
②温度为T时.在恒容的密闭容器中加入2molNH3此时压强为p0用Ru催化氨气分解,若平衡时氨气的转化率为50%.,则该温度下反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数Kp=
N2(g)+3H2(g)的化学平衡常数Kp=(3)关于合成氨工艺的理解,下列说法不正确的是
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru.,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)电化学法合成氨:利用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3原理示意如图所示。

①Pt—C3N4,电极上产生NH3的电极反应式为
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:
您最近一年使用:0次
3 . 碳及其化合物种类繁多,在能源、化工、电池等方面有着广泛的用途。回答下列问题:
(1)已知:①
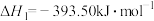
②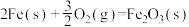
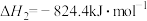
则

___________  。
。
(2)碳酸二乙酯(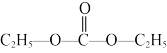 ,简称DEC)可用于锂离子电池电解液。在催化剂的作用下,利用乙醇、
,简称DEC)可用于锂离子电池电解液。在催化剂的作用下,利用乙醇、 和CO可直接反应制备DEC,反应如下:
和CO可直接反应制备DEC,反应如下: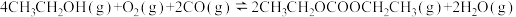
 。
。
①在恒温恒容的密闭容器中发生上述反应,能说明反应达到平衡状态的是___________ (填字母)。
a.
b.容器内气体的密度不变
c.容器内压强不变
d.DEC与 的物质的量之比为
的物质的量之比为
②一定条件下,分别向甲、乙、丙三个恒容密闭容器中加入一定量的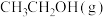 、
、 、
、 ,发生上述反应,各容器中温度、各物质的起始量如下表,反应过程中DEC的物质的量浓度随时间的变化如图所示:
,发生上述反应,各容器中温度、各物质的起始量如下表,反应过程中DEC的物质的量浓度随时间的变化如图所示:

上图中,a,b两点反应达到平衡。甲容器中,在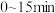 时间段内的平均反应速率
时间段内的平均反应速率
___________ ;乙容器中,若平衡时 ,则T1
,则T1___________ T2(填“>”“<”或“=”);T3℃时的平衡常数K=___________ 。
(1)已知:①

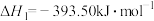
②
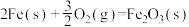
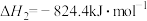
则


 。
。(2)碳酸二乙酯(
 ,简称DEC)可用于锂离子电池电解液。在催化剂的作用下,利用乙醇、
,简称DEC)可用于锂离子电池电解液。在催化剂的作用下,利用乙醇、 和CO可直接反应制备DEC,反应如下:
和CO可直接反应制备DEC,反应如下: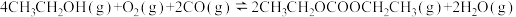
 。
。①在恒温恒容的密闭容器中发生上述反应,能说明反应达到平衡状态的是
a.

b.容器内气体的密度不变
c.容器内压强不变
d.DEC与
 的物质的量之比为
的物质的量之比为
容器 | 甲 | 乙 | 丙 |
容积/L | 0.4 | 0.4 | 0.2 |
温度/℃ | T1 | T2 | T3 |
| 起始量 | 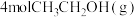 、 、 、 、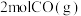 |  、 、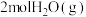 | 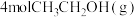 、 、 、 、 |
②一定条件下,分别向甲、乙、丙三个恒容密闭容器中加入一定量的
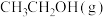 、
、 、
、 ,发生上述反应,各容器中温度、各物质的起始量如下表,反应过程中DEC的物质的量浓度随时间的变化如图所示:
,发生上述反应,各容器中温度、各物质的起始量如下表,反应过程中DEC的物质的量浓度随时间的变化如图所示:
上图中,a,b两点反应达到平衡。甲容器中,在
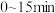 时间段内的平均反应速率
时间段内的平均反应速率
 ,则T1
,则T1
您最近一年使用:0次
名校
解题方法
4 . 运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H=_____________ 。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是_____________ (填序号)
A. 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.相同时间内,断开H-H键的数目和生成N-H键的数目相同
D.容器内气体浓度c(N2):c(H2):c (NH3)=1:3:2
②P1_____ P2 (填“>” “<”“=”或“不确定”,下同);反应的平衡常数:C点______ B点_______ D点。
③C点 的转化率为
的转化率为________ ;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________ υ(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为_____________ 。反应过程中通过质子交换膜(ab)的 为2mol时,吸收柱中生成的气体在标准状况下的体积为
为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________ L。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H=
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是
A.
 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变C.相同时间内,断开H-H键的数目和生成N-H键的数目相同
D.容器内气体浓度c(N2):c(H2):c (NH3)=1:3:2
②P1
③C点
 的转化率为
的转化率为Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为
 为2mol时,吸收柱中生成的气体在标准状况下的体积为
为2mol时,吸收柱中生成的气体在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
5 . 甲烷、乙烯、环氧乙烷、丁烷都是重要的化工原料,用途广泛,回答下列问题:
已知:Ⅰ.2CH2=CH2(g)+O2(g)⇌2 (g) ΔH1<0
(g) ΔH1<0
Ⅱ.CH2=CH2(g)+3O2(g)⇌2CO2(g)+2H2O(l) ΔH2
Ⅲ.2 (g) +5O2(g)⇌ 4CO2(g)+4H2O(l) ΔH3
(g) +5O2(g)⇌ 4CO2(g)+4H2O(l) ΔH3
(1)若反应Ⅲ是在一定温度下可自发进行,则ΔH3______ (填“>”“<”或“=”)0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ·g-1,则△H2=________ kJ·mol-1。
(3)实验测得2CH2=CH2(g)+O2(g)⇌2 (g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(
(g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2( )(k正、k逆为速率常数,只与温度有关)。
)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数________ (填“大于”“小于”或“等于”) k逆增大的倍数。
②若在1L的密闭容器中充入1mol CH2=CH2(g)和1mol O2(g),在一定温度下只发生反应Ⅰ,经过10min 反应达到平衡,CH2=CH2(g)的转化率为40%,则0~10min内,v(O2)=_________ ,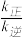 =
=___________ (保留两位有效数字)。
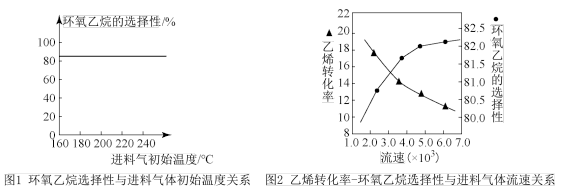
(4)下列有关环氧乙烷制备的说法正确的是________ (填字母)。
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度的影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降,主要是原料气与催化剂接触时间过短造成
C.若进料气中氧气比例增大,环氧乙烷产率降低,其主要原因是部分乙烯、环氧乙烷转化为二氧化碳和水
(5)一种以天然气为物燃料的固体氧化物燃料电池的原理如图所示,其中YSZ为6%~10%Y2O3掺杂的ZrO2固体电解质。

a极上的电极反应式为_____________ ;若电路中转移0.1mol电子,则消耗标准状况下CH4的体积为_____________ L。
已知:Ⅰ.2CH2=CH2(g)+O2(g)⇌2
 (g) ΔH1<0
(g) ΔH1<0Ⅱ.CH2=CH2(g)+3O2(g)⇌2CO2(g)+2H2O(l) ΔH2
Ⅲ.2
 (g) +5O2(g)⇌ 4CO2(g)+4H2O(l) ΔH3
(g) +5O2(g)⇌ 4CO2(g)+4H2O(l) ΔH3(1)若反应Ⅲ是在一定温度下可自发进行,则ΔH3
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ·g-1,则△H2=
(3)实验测得2CH2=CH2(g)+O2(g)⇌2
 (g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(
(g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2( )(k正、k逆为速率常数,只与温度有关)。
)(k正、k逆为速率常数,只与温度有关)。①达到平衡后,仅升高温度,k正增大的倍数
②若在1L的密闭容器中充入1mol CH2=CH2(g)和1mol O2(g),在一定温度下只发生反应Ⅰ,经过10min 反应达到平衡,CH2=CH2(g)的转化率为40%,则0~10min内,v(O2)=
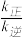 =
=(4)下列有关环氧乙烷制备的说法正确的是
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度的影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降,主要是原料气与催化剂接触时间过短造成
C.若进料气中氧气比例增大,环氧乙烷产率降低,其主要原因是部分乙烯、环氧乙烷转化为二氧化碳和水

(5)一种以天然气为物燃料的固体氧化物燃料电池的原理如图所示,其中YSZ为6%~10%Y2O3掺杂的ZrO2固体电解质。

a极上的电极反应式为
您最近一年使用:0次
2020-05-15更新
|
254次组卷
|
3卷引用:重庆巴蜀中学高2020届高三下学期3月月月考理综化学试题
名校
6 . 乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为____________ 。
(2)已知: △H1=-890.3 kJ∙mol-1
△H1=-890.3 kJ∙mol-1
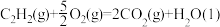 △H2=-1299.6 kJ∙mol-1
△H2=-1299.6 kJ∙mol-1
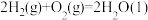 △H3=-571.6 kJ∙mol-1
△H3=-571.6 kJ∙mol-1
则甲烷气相裂解反应:2CH4(g) C2H2(g)+3H2(g)的△H=
C2H2(g)+3H2(g)的△H=_______ kJ∙mol-1。
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)的对数与温度(℃)的关系如图所示。

①T1℃时,向1L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)= c(CH4)。该反应的△H
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)= c(CH4)。该反应的△H ____________ 0(填“>”或“<”),CH4的平衡转化率为__________ %(保留3位有效数字)。上述平衡状态在某一时刻,若改变温度至T2℃,c(CH4)以0.01mol∙L-1∙s-1平均速率增多,经 后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1
后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_________ (填“>”或“<”)T2,t=_________ s。
②列式计算反应2CH4(g) C2H2(g)+3H2(g)在图中A℃时的平衡常数K=
C2H2(g)+3H2(g)在图中A℃时的平衡常数K=__________ (用平衡分压代替平衡浓度计算, )。
)。
③由图可知,甲烷裂解制乙炔时有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有________________ 。
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为
(2)已知:
 △H1=-890.3 kJ∙mol-1
△H1=-890.3 kJ∙mol-1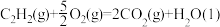 △H2=-1299.6 kJ∙mol-1
△H2=-1299.6 kJ∙mol-1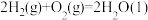 △H3=-571.6 kJ∙mol-1
△H3=-571.6 kJ∙mol-1则甲烷气相裂解反应:2CH4(g)
 C2H2(g)+3H2(g)的△H=
C2H2(g)+3H2(g)的△H=(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)的对数与温度(℃)的关系如图所示。

①T1℃时,向1L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)= c(CH4)。该反应的△H
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)= c(CH4)。该反应的△H  后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1
后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1②列式计算反应2CH4(g)
 C2H2(g)+3H2(g)在图中A℃时的平衡常数K=
C2H2(g)+3H2(g)在图中A℃时的平衡常数K= )。
)。③由图可知,甲烷裂解制乙炔时有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有
您最近一年使用:0次
2020-09-14更新
|
366次组卷
|
6卷引用:广西梧州市2018-2019学年高二下学期期末考试理科综合化学试题
7 . 一氧化碳和二氧化硫是用途广泛的化工基础原料。
(1)已知:C(s)+O2(g)=CO2(g) △H1=– 393.5 kJ·mol – 1
C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol – 1
S(s)+O2(g)=SO2(g) △H3=– 296.0 kJ·mol – 1
已知某反应的平衡常数 ,据以上信息,请写出该反应的热化学反应方程式:
,据以上信息,请写出该反应的热化学反应方程式:________________ 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为______ ,H2的化学反应速率为_____ 。
(3)工业利用反应2SO2(g)+O2(g) 2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______
a 体系压强保持不变
b 混合气体密度保持不变
c SO2和O2的物质的量保持不变
d 每消耗1 mol SO3的同时,生成0.5 mol O2
(1)已知:C(s)+O2(g)=CO2(g) △H1=– 393.5 kJ·mol – 1
C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol – 1
S(s)+O2(g)=SO2(g) △H3=– 296.0 kJ·mol – 1
已知某反应的平衡常数
 ,据以上信息,请写出该反应的热化学反应方程式:
,据以上信息,请写出该反应的热化学反应方程式:(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)
 CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为(3)工业利用反应2SO2(g)+O2(g)
 2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是a 体系压强保持不变
b 混合气体密度保持不变
c SO2和O2的物质的量保持不变
d 每消耗1 mol SO3的同时,生成0.5 mol O2
您最近一年使用:0次
2020-02-04更新
|
84次组卷
|
2卷引用:云南省楚雄市楚雄实验中学2019-2020学年高二上学期期末考试化学试题
解题方法
8 . 碳、氮广泛分布在自然界中,碳、氮的化合物在工农业生产和科技领域有重要用途。
(1)已知有如下反应:CO(g) + O2(g)=CO2(g) △H=-283kJ/mol
O2(g)=CO2(g) △H=-283kJ/mol
H(g) + O2(g)= H2O(g) △H = -241.8 kJ/mol
O2(g)= H2O(g) △H = -241.8 kJ/mol
则CO(g) +H2O(g)=CO2(g) +H2(g) △H =______ ,该反应为____ 反应 (填“吸热"或“放热")。
(2)一定温度下, 在固定容积的密闭容器内发生反应:2NO2(g) N2O4(g) △H = - 180kJ/mol,c(NO2) 随时间变化如下表:
N2O4(g) △H = - 180kJ/mol,c(NO2) 随时间变化如下表:
①用NO2浓度变化表示0~2 s内该反应的平均反应速率为______ 。 在第3 s时,NO2的转化率为______ (转化率是指某一反应物转化的百分率)。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是_______ 。
③该反应的平衡常数为_______ 。
(1)已知有如下反应:CO(g) +
 O2(g)=CO2(g) △H=-283kJ/mol
O2(g)=CO2(g) △H=-283kJ/molH(g) +
 O2(g)= H2O(g) △H = -241.8 kJ/mol
O2(g)= H2O(g) △H = -241.8 kJ/mol则CO(g) +H2O(g)=CO2(g) +H2(g) △H =
(2)一定温度下, 在固定容积的密闭容器内发生反应:2NO2(g)
 N2O4(g) △H = - 180kJ/mol,c(NO2) 随时间变化如下表:
N2O4(g) △H = - 180kJ/mol,c(NO2) 随时间变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(NO2)/ (mol/L) | 0.4 | 0.2 | 0.1 | 0.08 | 0.08 |
①用NO2浓度变化表示0~2 s内该反应的平均反应速率为
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是
③该反应的平衡常数为
您最近一年使用:0次
解题方法
9 . 我国首创以铝组成的金属—海水—空气电池作为新型海水标志灯的能源,它以海水为电解质溶液,靠空气中的氧气使铝组成的金属不断氧化而产生电流。
(1)只要把灯放入海水中数分钟,就会发出耀眼的白光,则该电池的负极反应式为__________ ;
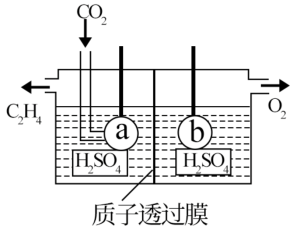
(2)电解法可制取碳的一种气态氢化物C2H4(如图所示)电极a接电源的__________ 极,该电极反应式为__________ ;
(3)将SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体NO,有关反应的离子方程式为__________ ;
(4)处理NOx的一种方法是利用甲烷催化还原NOx,
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ•mol-1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为__________ ;
(5)H2O2在工业、农业、医药上都有广泛的用途。用碱性氢氧燃料电池可合成H2O2,具有效率高、无污染等特点。电池总反应式为H2+O2+OH-=H2O+ ,写出正极反应式
,写出正极反应式__________ 。
(1)只要把灯放入海水中数分钟,就会发出耀眼的白光,则该电池的负极反应式为
(2)电解法可制取碳的一种气态氢化物C2H4(如图所示)电极a接电源的

(3)将SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体NO,有关反应的离子方程式为
(4)处理NOx的一种方法是利用甲烷催化还原NOx,
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ•mol-1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(5)H2O2在工业、农业、医药上都有广泛的用途。用碱性氢氧燃料电池可合成H2O2,具有效率高、无污染等特点。电池总反应式为H2+O2+OH-=H2O+
 ,写出正极反应式
,写出正极反应式
您最近一年使用:0次
解题方法
10 . 甲酸钙用途广泛,可用于高硫烟气脱硫助剂,也可作为制备草酸的中间体.据最新文献,氢氧化钙碳基化合成甲酸钙的反应如下:
 反应1
反应1
(1)反应体系中存在以下两个竞争反应
 反应2
反应2
 反应3
反应3
 二氧化碳与氢气直接合成甲酸的热化学反应方程式为
二氧化碳与氢气直接合成甲酸的热化学反应方程式为 ______ .
 为了更有利于生成甲酸钙,应选择的反应条件是较低的温度和
为了更有利于生成甲酸钙,应选择的反应条件是较低的温度和 ______  填编号
填编号 .
.
A.催化剂 低压
低压 高压
高压
(2)如图1是反应2和反应3,lnK与温度T的关系;同一条件时反应2的K______  填“大于”或“小于”
填“大于”或“小于” 反应3的K,这对于
反应3的K,这对于 ______  填“反应2”或“反应3”
填“反应2”或“反应3” 不利的.
不利的.
(3)以氢氧化钙初始密度为 、CO的分压为
、CO的分压为 条件下催化反应,以氢氧化钙转化率
条件下催化反应,以氢氧化钙转化率 为坐标,时间为横坐标得到如图2;
为坐标,时间为横坐标得到如图2;

 根据图象选择合适的反应温度
根据图象选择合适的反应温度 ______ ;理由是 ______ .
 当
当 为
为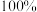 时,产物中甲酸钙与碳酸钙的质量比为50:1,氢氧化钙有
时,产物中甲酸钙与碳酸钙的质量比为50:1,氢氧化钙有 ______  转化为甲酸钙.
转化为甲酸钙.
 反应1
反应1 (1)反应体系中存在以下两个竞争反应
 反应2
反应2  反应3
反应3  二氧化碳与氢气直接合成甲酸的热化学反应方程式为
二氧化碳与氢气直接合成甲酸的热化学反应方程式为  为了更有利于生成甲酸钙,应选择的反应条件是较低的温度和
为了更有利于生成甲酸钙,应选择的反应条件是较低的温度和  填编号
填编号 .
.A.催化剂
 低压
低压 高压
高压 (2)如图1是反应2和反应3,lnK与温度T的关系;同一条件时反应2的K
 填“大于”或“小于”
填“大于”或“小于” 反应3的K,这对于
反应3的K,这对于  填“反应2”或“反应3”
填“反应2”或“反应3” 不利的.
不利的. (3)以氢氧化钙初始密度为
 、CO的分压为
、CO的分压为 条件下催化反应,以氢氧化钙转化率
条件下催化反应,以氢氧化钙转化率 为坐标,时间为横坐标得到如图2;
为坐标,时间为横坐标得到如图2; 
 根据图象选择合适的反应温度
根据图象选择合适的反应温度  当
当 为
为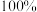 时,产物中甲酸钙与碳酸钙的质量比为50:1,氢氧化钙有
时,产物中甲酸钙与碳酸钙的质量比为50:1,氢氧化钙有  转化为甲酸钙.
转化为甲酸钙.
您最近一年使用:0次
2020-01-26更新
|
55次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——影响化学反应速率的因素(提升练)



