名校
解题方法
1 . 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)=0.4 mol·L-1,计算可得此段时间的反应速率(用H2表示)为________ mol·L-1·min-1。
(2)由表中数据判断ΔH1______ (填“>”“<”或“=”)0;反应CO2(g)+H2(g)  CO(g)+H2O(g) ΔH3=
CO(g)+H2O(g) ΔH3=_________ (用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是______ (填序号)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=__________________ ;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡_______ (填“正向”“逆向”或“不”)移动,平衡常数KⅡ__________ (填“变大”“变小”或“不变”)。
(5)比较这两种合成甲醇的方法,原子利用率较高的是______ (填“Ⅰ”或“Ⅱ”)。
反应Ⅰ:CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应Ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| KⅠ | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)=0.4 mol·L-1,计算可得此段时间的反应速率(用H2表示)为
(2)由表中数据判断ΔH1
 CO(g)+H2O(g) ΔH3=
CO(g)+H2O(g) ΔH3=(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=
(5)比较这两种合成甲醇的方法,原子利用率较高的是
您最近一年使用:0次
2018-04-22更新
|
697次组卷
|
10卷引用:黑龙江省五校(嫩江市第一中学、嫩江市职业高中、伊拉哈中学、海江中学等)2021-2022学年高二上学期期中联考化学试题
黑龙江省五校(嫩江市第一中学、嫩江市职业高中、伊拉哈中学、海江中学等)2021-2022学年高二上学期期中联考化学试题江苏省吴江汾湖高级中学2020-2021学年高二下学期阶段性教学质量检测化学试题云南省曲靖市马龙二中2020-2021学年高二5月月考化学试题山西省运城市芮城中学2021-2022学年高二上学期阶段性月考化学试题四川省宜宾市南溪一中2017-2018学年高二下学期第一次月考化学试题(已下线)2019年9月29日《每日一题》选修4—— 每周一测(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》山东省临沂市费县地区化学2020-2021学年高二上学期9月月考化学试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过素养 学科素养拓展训练河南省正阳县高级中学2020-2021学年高二上学期第二次素质检测化学试题
解题方法
2 . 工业上合成氨的原理如下:N2(g)+3H2(g) 2NH3(g)△H。
2NH3(g)△H。
(1)已知H-H键的键能为436 kJ•mol-1,N-H键的键能为391kJ•mol-1,N=N键的键能是945.6 kJ•mol-1,则上述反应的△H=________ 。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(NH3)=3.5 mol•L-1• min-1;乙:v(N2)=2 mol•L-1• min-1;丙:v(H2)=4.5mol•L-1• min-1;丁:v(NH3)=0.075 mol•L-1• min-1。若其他条件相同,温度不同,则温度由高到低的顺序是______________ (填序号)。
(3)在一定温度下,将1 molN2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol,容器压强为8 MPa。则平衡常数Kp=________ (用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(4)在773 K时,分别将2 molN2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中各物质的浓度与反应时间t的关系如图所示。
①图中表示c(N2)-t的曲线是________ 。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-l,则此时v正________ v逆(填“>”“<”或“=”)。
 2NH3(g)△H。
2NH3(g)△H。(1)已知H-H键的键能为436 kJ•mol-1,N-H键的键能为391kJ•mol-1,N=N键的键能是945.6 kJ•mol-1,则上述反应的△H=
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(NH3)=3.5 mol•L-1• min-1;乙:v(N2)=2 mol•L-1• min-1;丙:v(H2)=4.5mol•L-1• min-1;丁:v(NH3)=0.075 mol•L-1• min-1。若其他条件相同,温度不同,则温度由高到低的顺序是
(3)在一定温度下,将1 molN2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol,容器压强为8 MPa。则平衡常数Kp=
(4)在773 K时,分别将2 molN2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中各物质的浓度与反应时间t的关系如图所示。
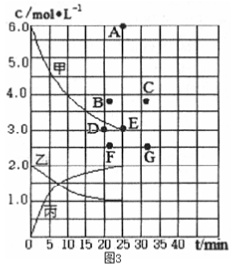
①图中表示c(N2)-t的曲线是
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-l,则此时v正
您最近一年使用:0次
2017-11-03更新
|
116次组卷
|
2卷引用:黑龙江省五校(嫩江市第一中学、嫩江市职业高中、伊拉哈中学、海江中学等)2021-2022学年高二上学期期中联考化学试题
名校
3 . 1 L 0.5 mol·L-1 H2SO4溶液与足量Ba(OH)2稀溶液反应放出a kJ热量;1 L 0.5 mol·L-1 HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量;则500 mL 0.4 mol·L-1 BaCl2溶液与足量稀硫酸反应放出的热量为( )
| A.0.4(a+2b) kJ | B.0.4(a-2b) kJ |
| C.0.2(a-2b) kJ | D.0.2(a+2b) kJ |
您最近一年使用:0次
2017-06-24更新
|
198次组卷
|
5卷引用:黑龙江省哈尔滨市哈师大附中2020-2021学年高一下学期期中考试化学试题
4 . 已知: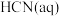 与
与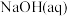 反应的
反应的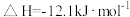 ;
;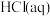 与
与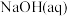 反应的
反应的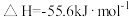 。则
。则 在水溶液中电离的
在水溶液中电离的 等于
等于
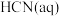 与
与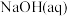 反应的
反应的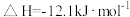 ;
;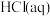 与
与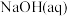 反应的
反应的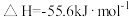 。则
。则 在水溶液中电离的
在水溶液中电离的 等于
等于A.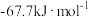 | B. |
C.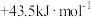 | D.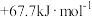 |
您最近一年使用:0次
2016-12-09更新
|
1960次组卷
|
72卷引用:黑龙江省八校2022届高三上学期期中联合考试化学试题
黑龙江省八校2022届高三上学期期中联合考试化学试题(已下线)2011—2012学年黑龙江哈九中度高二上学期期中考试化学试卷(已下线)必考点01 化学反应的热效应-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)重庆市第七中学校2021-2022学年高二上学期期中考试化学试题(已下线)2011-2012学年湖北省荆州中学高二上学期期中考试化学试卷(已下线)2013-2014黑龙江省大庆铁人中学高一下学期期末考试化学试卷(已下线)2014-2015学年甘肃省兰州一中高二上学期期中考试化学卷(已下线)2014秋湖北省武汉市部分重点中学高二上学期期中联考化学试卷2015-2016学年湖南省浏阳、攸县一中高二上期中联考化学试卷2016届河北省枣强中学高三上学期期中测试化学试卷2015-2016学年江西省丰城中学高二上学期期中考试化学试卷2016-2017学年青海师大附中高二上期中化学试卷山西省大同市第一中学2017-2018学年高二上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二上学期期中考试(A卷)化学试题【校级联考】湖北省孝感市七校教学联盟2018-2019学年高二上学期期中联合考试化学试题河南省上蔡县第二高级中学2018-2019学年高二上学期期中考试化学试题浙江省宁波诺丁汉大学附属中学2017-2018学年高二上学期期中考试化学试题宁夏吴忠中学2019-2020学年高二上学期期中考试化学试题(已下线)【全国百强校】广西桂林市第十八中学2018-2019学年高二下学期期中段考化学试题甘肃省民勤县第一中学2020-2021学年高二下学期(理)开学考试化学试题广西南宁市上林县中学2020-2021学年高二上学期期末考试化学试题江苏省海安市实验中学2021-2022学年高二上学期第一次月考化学试题广西浦北中学2021-2022学年高二上学期第一次月考化学试题福建省龙岩第一中学2021-2022学年高二上学期开学考试化学试题山东省青岛第二中学2019-2020学年高二上学期期中考试化学试题四川省乐山沫若中学2022-2023学年高二上学期第二次月考(期中考试)化学试题天津市第二中学2022-2023学年高二上学期期中检测化学试题安徽省合肥市肥东县综合高中2022-2023学年高二上学期11月期中考试化学试题2010年普通高等学校招生全国统一考试理综化学部分(新课标全国I卷)2010年普通高等学校招生全国统一考试(课标Ⅰ卷)理综化学部分全解全析2010年普通高等学校招生全国统一考试(湖南卷)理综化学部分全解全析2010年高考化学试题分项专题七 化学反应中的能量变化(已下线)2010年长春外国语学校高二第一学期期末考试化学试卷(已下线)2012届贵州省遵义四中高三第一次月考理科综合试卷(化学部分)(已下线)2012届山东省济宁一中高三上学期第二次定时练习化学试卷(已下线)2011-2012学年吉林省长春市十一高中高一下学期期末考试化学试卷(已下线)2013-2014广东汕头市金山中学第一学期期末高二化学试卷(已下线)2013-2014学年辽宁省抚顺市六校联合体高一下学期期末考试化学试卷(已下线)2015届安徽省黄山市徽州一中高三第一次月考化学试卷2014-2015陕西省西安市庆安高级中学高二上学期期末化学试卷2014-2015陕西省西安市一中高二上学期期末化学试卷2014-2015陕西省西安市七十中高二上学期期末考试化学试卷2015-2016学年河北省行唐启明中学高二上学期第一次月考化学试卷2015-2016学年广西宾阳县宾阳中学高二5月月考化学试卷河南省中原名校(即豫南九校)2017-2018学年高二上学期第一次联考化学试题河南省八市2017-2018学年高二上学期第一次质量检测化学试题高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第二课时(反应热的计算)四川省南充高级中学2017-2018学年高二12月月考化学试题安徽省淮北市第一中学2017-2018学年高二下学期第一次月考化学试题1山东省济南市历城第二中学2017-2018学年高二下学期开学考试化学试题人教版高二化学选修四专题:化学反应热的计算同步练习卷【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期10月月考化学试题【全国百强校】河南省信阳市高级中学2018-2019学年高二上学期10月月考化学试题2福建省晋江市南侨中学2018-2019学年高二下学期第二次月考化学试题河北安平中学2018-2019学年高二下学期期末考试化学试题(已下线)2019年9月1日《每日一题》人教选修4—— 每周一测云南省保山市第一中学2018-2019学年高二下学期期末化学试题福建省晋江市南侨中学2019-2020学年高二上学期第一阶段考试化学试题2020届高三化学选修4二轮专题练——盖斯定律的应用【选择精编25题】2020届高三化学知识点强化训练—盖斯定律河北省沧州市泊头市第一中学2019-2020学年高二月考检测化学试题四川省雅安市2019-2020学年高二上学期期末检测化学试题河北省泊头市第一中学2019-2020学年高二上学期期末模拟考试化学试卷陕西省榆林市绥德县绥德中学2019-2020高二下学期第一次阶段性测试化学试题河南省驻马店市2018-2019学年高二上学期期末考试化学试题吉林省白城市洮南市第一中学2020-2021学年高二上学期第一次月考化学试题河北省保定市唐县第一中学2020-2021学年高二9月月考化学试题陕西省汉中市洋县中学2018-2019学年高二上学期第一次月考化学试题河南省豫北名校2020-2021学年高二上学期11月质量检测化学试题江苏省南京市第十二中学2020-2021学年高二上学期第一次学情调研测试化学试题福建省龙岩第一中学2022-2023学年高二上学期第一次月考(普通班)化学试题安徽省安庆二中2022-2023学年高一下学期5月月考化学试题



