名校
1 . 研究表明I-可以作为水溶液中SO2歧化反应的催化剂:3SO2(g)+2H2O (l)=2H2SO4 (aq)+S(s) ΔH<0;该过程一般通过如下步骤来实现:①SO2(g)+4I-(aq)+4H+(aq)= S(s)+ 2I2(g) + 2H2O(l) ΔH>0;②I2(g)+2H2O(l)+SO2(g)=SO (aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是
(aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是
 (aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是
(aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是A.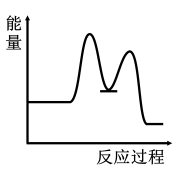 | B.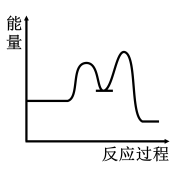 |
C.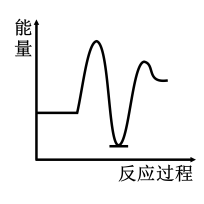 | D.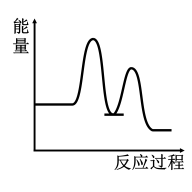 |
您最近一年使用:0次
2021-11-18更新
|
1083次组卷
|
14卷引用:黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题
黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题(已下线)2021年1月浙江高考化学试题变式题21-25黑龙江省肇东市第四中学2021-2022学年高三12月月考化学试题黑龙江省大庆市2023-2024学年高三上学期第一次模拟考试化学试题黑龙江省哈尔滨市第三十二中学2021-2022学年高三上学期期末考试化学试题河北省邯郸市第一中学2021-2022学年上学期高三上学期1月调研化学试题广东省珠海市2021-2022学年高二上学期期末考试化学试题广东省三校联考2022-2023学年高二上学期期中考试化学试题湖北省部分省级示范高中(四校联考)2022-2023学年高二上学期期末测试化学试题湖南省宁乡市2022-2023学年高二上学期期末考试化学试题湖北省宜昌市部分省级示范高中校级联合体2022-2023学年高二下学期期中考试化学试题广东省广州市三校2023—2024学年高二上学期期中联考化学考试广东省佛山市顺德区第一中学2023-2024学年高二上学期11月期中考试化学试题广东省广州市为明学校2023-2024学年高二上学期学情调研考化学试题
名校
2 .  的转化是资源利用和环境保护的重要研究课题。请回答下列问题:
的转化是资源利用和环境保护的重要研究课题。请回答下列问题:
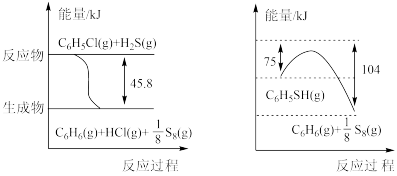
(1)苯硫酚(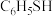 )是一种重要的有机合成中间体,工业上常用氯苯(
)是一种重要的有机合成中间体,工业上常用氯苯( )和硫化氢(
)和硫化氢( )来制备苯硫酚。已知下列两个反应的能量关系如下图所示,则
)来制备苯硫酚。已知下列两个反应的能量关系如下图所示,则 与
与 反应生成
反应生成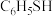 的热化学方程式为
的热化学方程式为___________ 。
(2) 与
与 在高温下反应制得的羰基硫(
在高温下反应制得的羰基硫(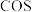 )可用于合成除草剂。在
)可用于合成除草剂。在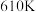 时,将
时,将
 与
与 充入
充入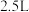 的空钢瓶中,发生反应:
的空钢瓶中,发生反应: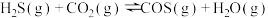 ;
;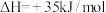 ,反应达平衡后水蒸气的物质的量分数为0.02。
,反应达平衡后水蒸气的物质的量分数为0.02。
①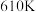 时,反应经
时,反应经 达到平衡,则
达到平衡,则 的反应速率
的反应速率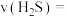
___________ 。
②验测得上述反应的速率方程为: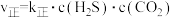 ,
,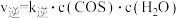 ,
,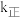 、
、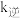 分别为正、逆反应速率常数,速率常数
分别为正、逆反应速率常数,速率常数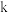 随温度升高而增大。则达到平衡后,仅升高温度,
随温度升高而增大。则达到平衡后,仅升高温度,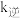 增大的倍数
增大的倍数___________ (填“ ”“
”“ ”或“
”或“ ”)
”)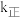 增大的倍数。
增大的倍数。
③该条件下,容器中反应达到化学平衡状态的依据是___________ (填字母序号)。
A.容器内混合气体密度不再变化
B.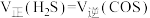
C.容器内的压强不再变化
D. 与
与 的物质的量之比不变
的物质的量之比不变
(3)工业上可以通过硫化氢分解制得 和硫蒸气。在密闭容器中充入一定量
和硫蒸气。在密闭容器中充入一定量 气体,反应原理:
气体,反应原理: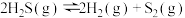 ,
, 气体的平衡转化率与温度、压强的关系如下图所示。
气体的平衡转化率与温度、压强的关系如下图所示。
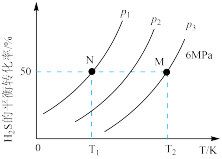
①图中压强( 、
、 、
、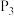 )从大到小顺序为
)从大到小顺序为___________ ,理由是___________ 。
②如果要进一步提高 的平衡转化率,除改变温度、压强外,还可以采取的措施有
的平衡转化率,除改变温度、压强外,还可以采取的措施有___________ (写出一条即可)。
③在温度 、
、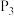
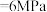 条件下,该反应的平衡常数
条件下,该反应的平衡常数
___________ 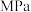 (已知:用平衡分压代替平衡浓度计算,
(已知:用平衡分压代替平衡浓度计算,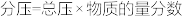 )。
)。
 的转化是资源利用和环境保护的重要研究课题。请回答下列问题:
的转化是资源利用和环境保护的重要研究课题。请回答下列问题:
(1)苯硫酚(
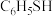 )是一种重要的有机合成中间体,工业上常用氯苯(
)是一种重要的有机合成中间体,工业上常用氯苯( )和硫化氢(
)和硫化氢( )来制备苯硫酚。已知下列两个反应的能量关系如下图所示,则
)来制备苯硫酚。已知下列两个反应的能量关系如下图所示,则 与
与 反应生成
反应生成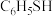 的热化学方程式为
的热化学方程式为(2)
 与
与 在高温下反应制得的羰基硫(
在高温下反应制得的羰基硫(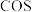 )可用于合成除草剂。在
)可用于合成除草剂。在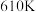 时,将
时,将
 与
与 充入
充入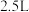 的空钢瓶中,发生反应:
的空钢瓶中,发生反应: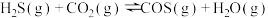 ;
;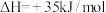 ,反应达平衡后水蒸气的物质的量分数为0.02。
,反应达平衡后水蒸气的物质的量分数为0.02。①
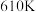 时,反应经
时,反应经 达到平衡,则
达到平衡,则 的反应速率
的反应速率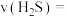
②验测得上述反应的速率方程为:
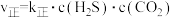 ,
,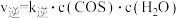 ,
,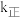 、
、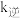 分别为正、逆反应速率常数,速率常数
分别为正、逆反应速率常数,速率常数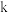 随温度升高而增大。则达到平衡后,仅升高温度,
随温度升高而增大。则达到平衡后,仅升高温度,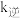 增大的倍数
增大的倍数 ”“
”“ ”或“
”或“ ”)
”)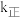 增大的倍数。
增大的倍数。③该条件下,容器中反应达到化学平衡状态的依据是
A.容器内混合气体密度不再变化
B.
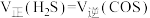
C.容器内的压强不再变化
D.
 与
与 的物质的量之比不变
的物质的量之比不变(3)工业上可以通过硫化氢分解制得
 和硫蒸气。在密闭容器中充入一定量
和硫蒸气。在密闭容器中充入一定量 气体,反应原理:
气体,反应原理: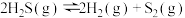 ,
, 气体的平衡转化率与温度、压强的关系如下图所示。
气体的平衡转化率与温度、压强的关系如下图所示。
①图中压强(
 、
、 、
、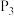 )从大到小顺序为
)从大到小顺序为②如果要进一步提高
 的平衡转化率,除改变温度、压强外,还可以采取的措施有
的平衡转化率,除改变温度、压强外,还可以采取的措施有③在温度
 、
、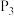
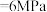 条件下,该反应的平衡常数
条件下,该反应的平衡常数
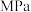 (已知:用平衡分压代替平衡浓度计算,
(已知:用平衡分压代替平衡浓度计算,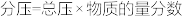 )。
)。
您最近一年使用:0次
2021-10-14更新
|
414次组卷
|
6卷引用:黑龙江省大庆市2021届高三第一次教学质量检测理综化学试题
黑龙江省大庆市2021届高三第一次教学质量检测理综化学试题(已下线)化学-学科网2021年高三5月大联考考后强化卷(新课标Ⅰ卷)(已下线)化学-学科网2021年高三5月大联考考后强化卷(新课标Ⅲ卷)(已下线)化学-学科网2021年高三5月大联考考后强化卷(新课标Ⅱ卷)黑龙江省大庆市大庆铁人中学2021-2022学年高二上学期第一次月考化学试题江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题
名校
3 . 硅单质及其化合物应用范围很广。请回答下列问题:
(1)工业上用石英和焦炭可以制得粗硅。已知:
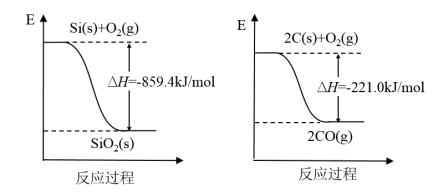
写出用石英和焦炭制取粗硅的热化学方程式_______ 。
(2)制备硅半导体材料必须先得到高纯硅:三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
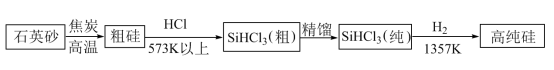
写出由纯SiHCl3制备高纯硅的化学反应方程式_______ 。整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和一种单质,写出该反应的化学方程式_______ 。
(3)对于反应2SiHCl3(g)⇌SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
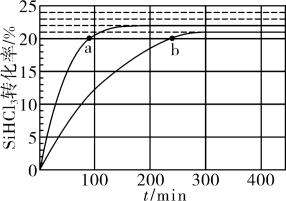
①323K时,反应的平衡转化率α=_______ 。平衡常数K323K=_______ (保留2位有效数字)。
②下列说法正确的是_______
A.平均分子量不变时,该反应一定达到平衡状态
B.a、b处反应速率:v(a)>v(b)
C.改进催化剂可以缩短达到平衡的时间
D.温度体积一定,加入SiHCl3可以提高SiHCl3的转化率
③已知SiHCl3分解反应速率v=v正-v逆=k正﹒x2(SiHCl3)-k逆﹒x(SiH2Cl2)﹒x(SiCl4),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算b处v正/v逆=_______ 。(保留2位小数)
(1)工业上用石英和焦炭可以制得粗硅。已知:

写出用石英和焦炭制取粗硅的热化学方程式
(2)制备硅半导体材料必须先得到高纯硅:三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

写出由纯SiHCl3制备高纯硅的化学反应方程式
(3)对于反应2SiHCl3(g)⇌SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。

①323K时,反应的平衡转化率α=
②下列说法正确的是
A.平均分子量不变时,该反应一定达到平衡状态
B.a、b处反应速率:v(a)>v(b)
C.改进催化剂可以缩短达到平衡的时间
D.温度体积一定,加入SiHCl3可以提高SiHCl3的转化率
③已知SiHCl3分解反应速率v=v正-v逆=k正﹒x2(SiHCl3)-k逆﹒x(SiH2Cl2)﹒x(SiCl4),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算b处v正/v逆=
您最近一年使用:0次
名校
4 . NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题,研究NOx之间的转化也具有重要意义。
用水吸收NOx的相关热化学方程式如下:
(1)2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq)ΔH=-116.1kJ·mol-1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l)ΔH=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=____ kJ·mol-1。
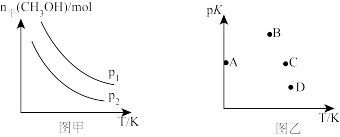
(2)已知反应2NO(g)+2CO(g) N2(g)+2CO2(g)。v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m=
N2(g)+2CO2(g)。v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m=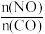 的关系如图所示。
的关系如图所示。

①达到平衡后,仅升高温度,k正增大的倍数__ (填“>”“<”或“=”)k逆增大的倍数。
②下列说法正确的是___ 。
A.投料比:m1<m2<m3
B.汽车排气管中的催化剂可提高NO的平衡转化率
C.当投料比m=2时,NO转化率比CO转化率小
D.当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
(3)已知:N2O4(g) 2NO2(g)ΔH>0将一定量N2O4气体充入刚性密闭容器中,控制反应温度为T1。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g)
2NO2(g)ΔH>0将一定量N2O4气体充入刚性密闭容器中,控制反应温度为T1。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g) 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=___ (对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
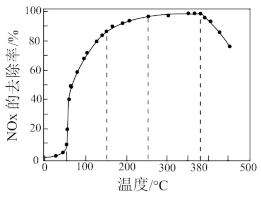
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(如图所示)。

反应相同时间NOx的去除率随反应温度的变化曲线如图所示。
在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升的主要原因是___ ;后来上升缓慢的主要原因是___ ;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___ 。
用水吸收NOx的相关热化学方程式如下:
(1)2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq)ΔH=-116.1kJ·mol-1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l)ΔH=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=
(2)已知反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)。v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m=
N2(g)+2CO2(g)。v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数)。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m=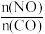 的关系如图所示。
的关系如图所示。
①达到平衡后,仅升高温度,k正增大的倍数
②下列说法正确的是
A.投料比:m1<m2<m3
B.汽车排气管中的催化剂可提高NO的平衡转化率
C.当投料比m=2时,NO转化率比CO转化率小
D.当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
(3)已知:N2O4(g)
 2NO2(g)ΔH>0将一定量N2O4气体充入刚性密闭容器中,控制反应温度为T1。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g)
2NO2(g)ΔH>0将一定量N2O4气体充入刚性密闭容器中,控制反应温度为T1。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g) 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(如图所示)。

反应相同时间NOx的去除率随反应温度的变化曲线如图所示。
在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升的主要原因是

您最近一年使用:0次
名校
解题方法
5 . 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇。
I.探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
(1)CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1=-49.5kJ·mol-1
CH3OH(g)+H2O(g)△H1=-49.5kJ·mol-1
(2)CO(g)+2H2(g) CH3OH(g)△H2=-90.4kJ·mol-1
CH3OH(g)△H2=-90.4kJ·mol-1
(3)CO(g)+H2O(g) CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3
△H3=____ kJ·mol-1。
II.工业上可以由水煤气合成甲醇:CO(g)+2H2(g) CH3OH(g)一定条件下,向密闭容器中通入2molCO和4molH2,发生上述反应。
CH3OH(g)一定条件下,向密闭容器中通入2molCO和4molH2,发生上述反应。
图甲中,压强p2___ p1(填“>”“<”或“=”),原因是___ 。
②图乙中,能正确反映A状态随温度升高pK(pK=-lgK)数值变化的点是___ 。
③该反应的正逆反应速率表达式:v正=k正·c(CO)·c2H2),v逆=k逆·c(CH3OH),k正、k逆为反应速率常数。在一定条件下,加入催化剂,反应速率常数___ (填“增大”、“减小”或“不变”下同);降低温度, 的值
的值___ 。
III.由CO2制备甲醇的过程可能涉及如下两个反应。
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H2
CH3OCH3(g)+3H2O(g)△H2
将3molCO2和3molH2混合后通入某恒温恒容密闭容器中发生上述反应,一段时间后达到平衡,测得容器压强为60MPa,容器中CH3OCH3为0.2mol,H2O为1mol,此时CH3OH的物质的量为___ ,反应Ⅰ的Kp=___ MPa-2(列出计算式,无需化简)。
I.探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
(1)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H1=-49.5kJ·mol-1
CH3OH(g)+H2O(g)△H1=-49.5kJ·mol-1(2)CO(g)+2H2(g)
 CH3OH(g)△H2=-90.4kJ·mol-1
CH3OH(g)△H2=-90.4kJ·mol-1(3)CO(g)+H2O(g)
 CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3△H3=
II.工业上可以由水煤气合成甲醇:CO(g)+2H2(g)
 CH3OH(g)一定条件下,向密闭容器中通入2molCO和4molH2,发生上述反应。
CH3OH(g)一定条件下,向密闭容器中通入2molCO和4molH2,发生上述反应。
图甲中,压强p2
②图乙中,能正确反映A状态随温度升高pK(pK=-lgK)数值变化的点是
③该反应的正逆反应速率表达式:v正=k正·c(CO)·c2H2),v逆=k逆·c(CH3OH),k正、k逆为反应速率常数。在一定条件下,加入催化剂,反应速率常数
 的值
的值III.由CO2制备甲醇的过程可能涉及如下两个反应。
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1反应Ⅱ:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)△H2
CH3OCH3(g)+3H2O(g)△H2将3molCO2和3molH2混合后通入某恒温恒容密闭容器中发生上述反应,一段时间后达到平衡,测得容器压强为60MPa,容器中CH3OCH3为0.2mol,H2O为1mol,此时CH3OH的物质的量为
您最近一年使用:0次
解题方法
6 . 央广网消息:2020年大庆油田生产天然气46.6亿立方米,实现了“十连增”,在大战大考中交出了“当好标杆旗帜、建设百年油田”的新答卷。天然气的主要成分甲烷是一种重要的化工原料,广泛应用于民用和化工业生产中。回答下列问题:
(1)利用CH4超干重整CO2技术可得到富含CO的化工原料。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g)。∆H1=+196 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ∆H2=-484 kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ∆H3=-566 kJ·mol-1
则CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H=_______ 。
(2)在两个相同钢性密闭容器中充入CH4和CO2发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),CH4和CO2的分压均为20 kPa,加入催化剂Ni/α-Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图1所示。
2CO(g)+2H2(g),CH4和CO2的分压均为20 kPa,加入催化剂Ni/α-Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图1所示。

图1
①A点处v正_______ B点处v逆(填“<”、“>”或“=”)。
②用单位时间内气体分压的变化来表示反应速率,即v= ,T2℃下,上述反应0~2min内平均反应速率v(CH4)=
,T2℃下,上述反应0~2min内平均反应速率v(CH4)=_______ kPa·min-1。(分压=总压×物质的量分数)
③上述反应达到平衡后,下列变化一定能使平衡向正向移动的是_____
A.通入惰性气体使容器内压强增大 B.正反应速率加快
C.平衡常数K变大 D.增大催化剂表面积
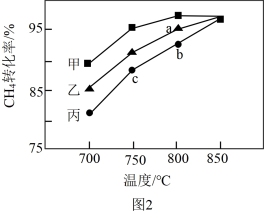
(3)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得甲烷转化率随温度变化如图2所示。三种催化剂作用下,反应活化能最大的是_______ (填“甲”、“乙”或“丙”);CH4的转化率b点高于c点的原因是_______ 。
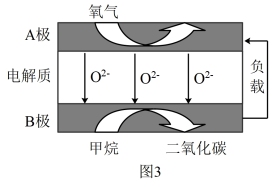
(4)我国科学家设计的新型甲烷燃料电池能量密度高、成本低,其工作原理如图3所示。B极电极反应式为_______ 。
(1)利用CH4超干重整CO2技术可得到富含CO的化工原料。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g)。∆H1=+196 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ∆H2=-484 kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ∆H3=-566 kJ·mol-1
则CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H=
(2)在两个相同钢性密闭容器中充入CH4和CO2发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g),CH4和CO2的分压均为20 kPa,加入催化剂Ni/α-Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图1所示。
2CO(g)+2H2(g),CH4和CO2的分压均为20 kPa,加入催化剂Ni/α-Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图1所示。
图1
①A点处v正
②用单位时间内气体分压的变化来表示反应速率,即v=
 ,T2℃下,上述反应0~2min内平均反应速率v(CH4)=
,T2℃下,上述反应0~2min内平均反应速率v(CH4)=③上述反应达到平衡后,下列变化一定能使平衡向正向移动的是
A.通入惰性气体使容器内压强增大 B.正反应速率加快
C.平衡常数K变大 D.增大催化剂表面积
(3)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得甲烷转化率随温度变化如图2所示。三种催化剂作用下,反应活化能最大的是

(4)我国科学家设计的新型甲烷燃料电池能量密度高、成本低,其工作原理如图3所示。B极电极反应式为

您最近一年使用:0次
名校
解题方法
7 . CO2作为未米的重要碳源,其选择性加氢合成CH3OH一直是研究热点,在CO2加氢合成CH3OH的体系中,同时发生以下反应:
反应i:CO2(g)+3H2(g) CH3OH(g)+H2O(g)∆H1<0
CH3OH(g)+H2O(g)∆H1<0
反应ii:CO2(g)+H2(g) CO(g)+H2O(g)△H2>0
CO(g)+H2O(g)△H2>0
(1)在特定温度下,由稳定态单质生成lmol化合物的焓变叫该物质在此温度下的标准生成焓(△fH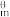 )。表中为几种物质在298K的标准生成焓,则反应ii的∆H2=
)。表中为几种物质在298K的标准生成焓,则反应ii的∆H2=___ kJ·mol−1。
(2)若实验测得反应i:υ正=k正·c(CO2)·c3(H2),υ逆=k逆·c(CH3OH)·c(H2O)(k正、k逆为速率常数)。1899年阿仑尼乌斯指出化学反应速率常数和温度的定量关系为:k=A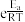 ,其中k为速率常数,A、R为常数,Ea为活化能,T为热力学温度,e为自然对数的底。则达到平衡后,仅加入催化剂,k正增大的倍数
,其中k为速率常数,A、R为常数,Ea为活化能,T为热力学温度,e为自然对数的底。则达到平衡后,仅加入催化剂,k正增大的倍数___ (填“>”“<”或“=")k逆增大的倍数。
(3)在CO2加氢合成CH3OH的体系中,下列说法错误的是___ (填标号).
A.增大H2浓度有利于提高CO2的转化率
B.若升高温度,反应i的正反应速率减小:反应ii的正反应速率增大
C.体系达平衡后,若压缩体积,则反应i平衡正向移动,反应ii平衡不移动
D.选用合适的催化剂可以提高CH3OH在单位时间内的产量
(4)某温度下,向容积为1L的密闭容器中通入2molCO2和10molH2,10min后体系达到平衡,此时CO2的转化率为20%,CH3OH的选择性为50%。
已知:CH3OH的选择性X=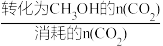 ×100%
×100%
①用CO2表示0~10min内平均反应速率υ(CO2)=___
②反应i的平衡常数K=___ L2/mol2(写出计算式即可)。
(5)维持压强和投料不变,将CO2和H2按一定流速通过反应器,二氧化碳的转化率a(CO2)和甲醇的选择性χ(CH3OH)随温度变化的关系如图所示:
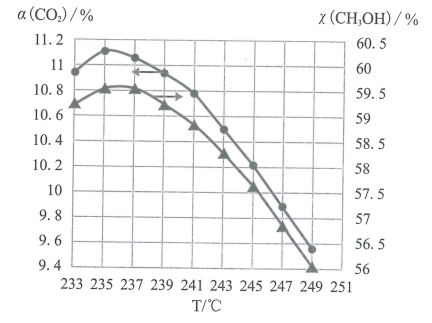
已知催化剂活性受温度影响变化不大,结合反应i和反应ii,分析235℃后曲线变化的原因。
①甲醇的选择性随温度升高而下降的原因是___ ;
②二氧化碳的转化率随温度升高也在下降的可能原因是___ 。
反应i:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)∆H1<0
CH3OH(g)+H2O(g)∆H1<0反应ii:CO2(g)+H2(g)
 CO(g)+H2O(g)△H2>0
CO(g)+H2O(g)△H2>0(1)在特定温度下,由稳定态单质生成lmol化合物的焓变叫该物质在此温度下的标准生成焓(△fH
 )。表中为几种物质在298K的标准生成焓,则反应ii的∆H2=
)。表中为几种物质在298K的标准生成焓,则反应ii的∆H2=| 物质 | H2(g) | CO2(g) | CO(g) | H2O(g) |
△fH (kJ·mol−1) (kJ·mol−1) | 0 | −394 | −111 | −242 |
(2)若实验测得反应i:υ正=k正·c(CO2)·c3(H2),υ逆=k逆·c(CH3OH)·c(H2O)(k正、k逆为速率常数)。1899年阿仑尼乌斯指出化学反应速率常数和温度的定量关系为:k=A
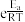 ,其中k为速率常数,A、R为常数,Ea为活化能,T为热力学温度,e为自然对数的底。则达到平衡后,仅加入催化剂,k正增大的倍数
,其中k为速率常数,A、R为常数,Ea为活化能,T为热力学温度,e为自然对数的底。则达到平衡后,仅加入催化剂,k正增大的倍数(3)在CO2加氢合成CH3OH的体系中,下列说法错误的是
A.增大H2浓度有利于提高CO2的转化率
B.若升高温度,反应i的正反应速率减小:反应ii的正反应速率增大
C.体系达平衡后,若压缩体积,则反应i平衡正向移动,反应ii平衡不移动
D.选用合适的催化剂可以提高CH3OH在单位时间内的产量
(4)某温度下,向容积为1L的密闭容器中通入2molCO2和10molH2,10min后体系达到平衡,此时CO2的转化率为20%,CH3OH的选择性为50%。
已知:CH3OH的选择性X=
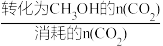 ×100%
×100%①用CO2表示0~10min内平均反应速率υ(CO2)=
②反应i的平衡常数K=
(5)维持压强和投料不变,将CO2和H2按一定流速通过反应器,二氧化碳的转化率a(CO2)和甲醇的选择性χ(CH3OH)随温度变化的关系如图所示:

已知催化剂活性受温度影响变化不大,结合反应i和反应ii,分析235℃后曲线变化的原因。
①甲醇的选择性随温度升高而下降的原因是
②二氧化碳的转化率随温度升高也在下降的可能原因是
您最近一年使用:0次
名校
8 . 利用磷石膏废渣(主要成分为CaSO4)生产硫酸可实现硫资源的循环利用。回答下列问题:
(1)硫黄分解磷石膏工艺涉及的主要反应为:
(I)S2(g)+CaSO4(s) CaS(s)+2SO2(g) ∆H= +240.4 kJ·mol-1
CaS(s)+2SO2(g) ∆H= +240.4 kJ·mol-1
(II)CaS(s)+3CaSO4(s) 4CaO(s)+4 SO2(g) ∆H2= +1047.9 kJ·mol-1
4CaO(s)+4 SO2(g) ∆H2= +1047.9 kJ·mol-1
①反应S2(g)+4CaSO4(s) 4CaO(s)+6SO2(g)的∆H=
4CaO(s)+6SO2(g)的∆H=_______ kJ·mol-1;
②在恒温恒容密闭容器中只进行反应(I),能说明其已达到平衡状态的是_______ (填字母)。
A. v正(SO2)=2 v正(S2) B.气体中含硫原子总数不随时间变化
C.容器内固体总质量不再随时间变化D.容器内气体总压强不再随时间变化
③在恒温恒容密闭容器中进行的反应(II)达到平衡时,向容器中(CaS、CaSO4、CaO均足量)再充入少量SO2,达到新平衡后,与原平衡相比c(SO2)_______ (填“增大”“减小”或“不变”),原因为_______ 。
(2)有效除去废气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5气体在一体积固定的容器中发生如下反应:2N2O5(g)=4NO2(g)+O2(g)(慢反应) ∆H<0,2NO2(g) N2O4(g)(快反应)∆H<0,体系的总压强p总和p(O2)随时间的变化如图所示。。
N2O4(g)(快反应)∆H<0,体系的总压强p总和p(O2)随时间的变化如图所示。。
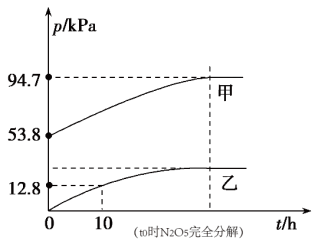
①图中表示O2压强变化的曲线是_______ (填“甲”或“乙")
②已知N2O5分解的反应速率v=0.12p(N2O5)(kPa·h-1),t=10h时,p(N2O5)=_______ kPa,v=_______ kPa•h-1。
③该温度下反应2NO2(g) N2O4(g)的平衡常数Kp=
N2O4(g)的平衡常数Kp=_______ kPa-1(结果保留两位小数)。
(1)硫黄分解磷石膏工艺涉及的主要反应为:
(I)S2(g)+CaSO4(s)
 CaS(s)+2SO2(g) ∆H= +240.4 kJ·mol-1
CaS(s)+2SO2(g) ∆H= +240.4 kJ·mol-1(II)CaS(s)+3CaSO4(s)
 4CaO(s)+4 SO2(g) ∆H2= +1047.9 kJ·mol-1
4CaO(s)+4 SO2(g) ∆H2= +1047.9 kJ·mol-1①反应S2(g)+4CaSO4(s)
 4CaO(s)+6SO2(g)的∆H=
4CaO(s)+6SO2(g)的∆H=②在恒温恒容密闭容器中只进行反应(I),能说明其已达到平衡状态的是
A. v正(SO2)=2 v正(S2) B.气体中含硫原子总数不随时间变化
C.容器内固体总质量不再随时间变化D.容器内气体总压强不再随时间变化
③在恒温恒容密闭容器中进行的反应(II)达到平衡时,向容器中(CaS、CaSO4、CaO均足量)再充入少量SO2,达到新平衡后,与原平衡相比c(SO2)
(2)有效除去废气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5气体在一体积固定的容器中发生如下反应:2N2O5(g)=4NO2(g)+O2(g)(慢反应) ∆H<0,2NO2(g)
 N2O4(g)(快反应)∆H<0,体系的总压强p总和p(O2)随时间的变化如图所示。。
N2O4(g)(快反应)∆H<0,体系的总压强p总和p(O2)随时间的变化如图所示。。
①图中表示O2压强变化的曲线是
②已知N2O5分解的反应速率v=0.12p(N2O5)(kPa·h-1),t=10h时,p(N2O5)=
③该温度下反应2NO2(g)
 N2O4(g)的平衡常数Kp=
N2O4(g)的平衡常数Kp=
您最近一年使用:0次
名校
解题方法
9 . 甲醇是重要的化工原料。回答下列问题:
(1)以甲醇为原料制备甲醛,同时生成副产物H2等,已知以下热化学方程式:
I.CH3OH(g) CO(g)+2H2(g) △H1=a kJ·mol-1
CO(g)+2H2(g) △H1=a kJ·mol-1
II.CO(g)+H2(g) HCHO(g) △H2=b kJ·mol-1
HCHO(g) △H2=b kJ·mol-1
III.CH3OH(g) HCHO(g)+H2(g) △H3=c kJ·mol-1
HCHO(g)+H2(g) △H3=c kJ·mol-1
则b=___________ (用含有a、c的代数式表示)。
(2)以Na2CO3固体为催化剂,甲醇脱氢可制得甲醛。反应机理如下:
(i)CH3OH(g) ·H(g)+·CH2OH(g);
·H(g)+·CH2OH(g);
(ii)·CH2OH(g) HCHO(g)+·H(g);
HCHO(g)+·H(g);
(iii)·H(g)十·H(g) H2(g)
H2(g)
①(i)中反应物的总能量___________ (填“>”“=”或“<”)生成物的总能量。
②某温度时反应(i)、(ii)、(ii)的平衡常数依次为K1、K2、K3,CH3OH(g) H2(g)+HCHO(g)的平衡常数为K,则K=
H2(g)+HCHO(g)的平衡常数为K,则K=___________ (用含K1、K2、K3的代数式表示)。
(3)向体积为1 L恒容反应器中加入2 mol CH3OH及适量催化剂,发生反应CH3OH(g) HCHO(g)+H2(g) △H,在T1、T2(T1<T2)时,CH3OH转化率与时间关系如图所示。
HCHO(g)+H2(g) △H,在T1、T2(T1<T2)时,CH3OH转化率与时间关系如图所示。
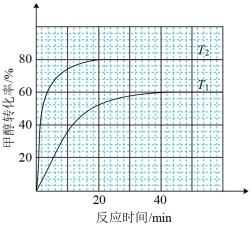
①T2温度下,20min时甲醇的体积分数为___________ %(保留三位有效数字),前20min平均反应速率 (HCHO)=
(HCHO)=___________ mol·L-1·min-1。
②T1温度下该反应的平衡常数Kp=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,反应器内的初始压强为103kPa)。
(4)固体氧化物甲醇燃料电池是能效高、环境友好地转化成电能的全固态电源,工作原理如图所示。

①石墨极上的反应式为___________ 。
②若通过用电器的电子的物质的量为1.2 mol,则消耗标准状况下O2的体积为___________ L。
(1)以甲醇为原料制备甲醛,同时生成副产物H2等,已知以下热化学方程式:
I.CH3OH(g)
 CO(g)+2H2(g) △H1=a kJ·mol-1
CO(g)+2H2(g) △H1=a kJ·mol-1II.CO(g)+H2(g)
 HCHO(g) △H2=b kJ·mol-1
HCHO(g) △H2=b kJ·mol-1III.CH3OH(g)
 HCHO(g)+H2(g) △H3=c kJ·mol-1
HCHO(g)+H2(g) △H3=c kJ·mol-1则b=
(2)以Na2CO3固体为催化剂,甲醇脱氢可制得甲醛。反应机理如下:
(i)CH3OH(g)
 ·H(g)+·CH2OH(g);
·H(g)+·CH2OH(g);(ii)·CH2OH(g)
 HCHO(g)+·H(g);
HCHO(g)+·H(g);(iii)·H(g)十·H(g)
 H2(g)
H2(g)①(i)中反应物的总能量
②某温度时反应(i)、(ii)、(ii)的平衡常数依次为K1、K2、K3,CH3OH(g)
 H2(g)+HCHO(g)的平衡常数为K,则K=
H2(g)+HCHO(g)的平衡常数为K,则K=(3)向体积为1 L恒容反应器中加入2 mol CH3OH及适量催化剂,发生反应CH3OH(g)
 HCHO(g)+H2(g) △H,在T1、T2(T1<T2)时,CH3OH转化率与时间关系如图所示。
HCHO(g)+H2(g) △H,在T1、T2(T1<T2)时,CH3OH转化率与时间关系如图所示。
①T2温度下,20min时甲醇的体积分数为
 (HCHO)=
(HCHO)=②T1温度下该反应的平衡常数Kp=
(4)固体氧化物甲醇燃料电池是能效高、环境友好地转化成电能的全固态电源,工作原理如图所示。

①石墨极上的反应式为
②若通过用电器的电子的物质的量为1.2 mol,则消耗标准状况下O2的体积为
您最近一年使用:0次
2021-04-22更新
|
293次组卷
|
2卷引用:黑龙江省齐齐哈尔市2021届高三第二次模拟考试理综化学试题
名校
解题方法
10 . 在食品行业中,N2O 可用作发泡剂和密封剂。
(1)N2O 在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g) ΔH
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) ΔH1=-1010 kJ•mol-1
4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH2=-1531 kJ•mol-1
则 ΔH=_______ 。
(2)N2O和CO是环境污染性气体,研究表明,CO与N2O在Fe+作用下发生反应 N2O(g)+CO(g)⇌CO2(g)+N2(g)的能量变化及反应历程如图所示。
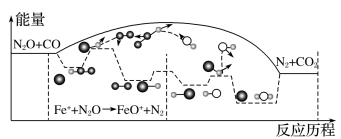
两步反应分别为:反应①Fe++N2O⇌FeO++N2,反应②_______ 。由图可知两步反应均为_______ (填“放热”或“吸热”)反应,由_______ (填“反应①”或“反应②”)决定反应达到平衡所用时间。
(3)在固定体积的密闭容器中,发生反应 N2O(g)+CO(g) ⇌CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能不同,也可能相同),测定 N2O 的平衡转化率。部分实验结果如图所示。
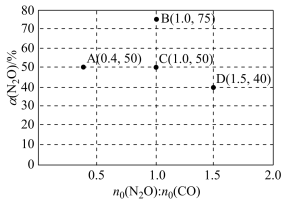
①如果要将图中 C 点的平衡状态改变为B 点的平衡状态,应采取的措施是_______ 。
②图中 C、D 两点对应的实验温度分别为 Tc和TD,通过计算判断Tc_______ (填“>”“=”或“<”)TD
(4)在某温度下,向1 L 密闭容器中充入CO与N2O,发生反应:N2O(g)+CO(g)⇌CO2(g)+N2(g),随着反应的进行,容器内 CO 的物质的量分数变化如表所示:
则该温度下反应的平衡常数 K=_______ 。
(1)N2O 在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g) ΔH
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) ΔH1=-1010 kJ•mol-1
4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH2=-1531 kJ•mol-1
则 ΔH=
(2)N2O和CO是环境污染性气体,研究表明,CO与N2O在Fe+作用下发生反应 N2O(g)+CO(g)⇌CO2(g)+N2(g)的能量变化及反应历程如图所示。

两步反应分别为:反应①Fe++N2O⇌FeO++N2,反应②
(3)在固定体积的密闭容器中,发生反应 N2O(g)+CO(g) ⇌CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能不同,也可能相同),测定 N2O 的平衡转化率。部分实验结果如图所示。

①如果要将图中 C 点的平衡状态改变为B 点的平衡状态,应采取的措施是
②图中 C、D 两点对应的实验温度分别为 Tc和TD,通过计算判断Tc
(4)在某温度下,向1 L 密闭容器中充入CO与N2O,发生反应:N2O(g)+CO(g)⇌CO2(g)+N2(g),随着反应的进行,容器内 CO 的物质的量分数变化如表所示:
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 物质的量分数 | 50.0% | 40.25% | 32.0% | 26.2% | 24.0% | 24.0% |
则该温度下反应的平衡常数 K=
您最近一年使用:0次



