 的转化是资源利用和环境保护的重要研究课题。请回答下列问题:
的转化是资源利用和环境保护的重要研究课题。请回答下列问题: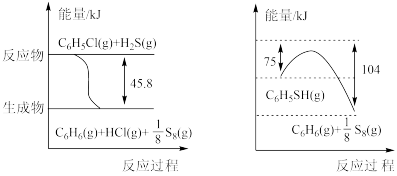
(1)苯硫酚(
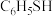 )是一种重要的有机合成中间体,工业上常用氯苯(
)是一种重要的有机合成中间体,工业上常用氯苯( )和硫化氢(
)和硫化氢( )来制备苯硫酚。已知下列两个反应的能量关系如下图所示,则
)来制备苯硫酚。已知下列两个反应的能量关系如下图所示,则 与
与 反应生成
反应生成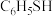 的热化学方程式为
的热化学方程式为(2)
 与
与 在高温下反应制得的羰基硫(
在高温下反应制得的羰基硫(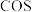 )可用于合成除草剂。在
)可用于合成除草剂。在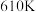 时,将
时,将
 与
与 充入
充入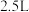 的空钢瓶中,发生反应:
的空钢瓶中,发生反应: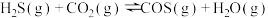 ;
;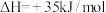 ,反应达平衡后水蒸气的物质的量分数为0.02。
,反应达平衡后水蒸气的物质的量分数为0.02。①
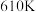 时,反应经
时,反应经 达到平衡,则
达到平衡,则 的反应速率
的反应速率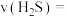
②验测得上述反应的速率方程为:
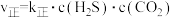 ,
,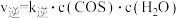 ,
,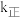 、
、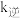 分别为正、逆反应速率常数,速率常数
分别为正、逆反应速率常数,速率常数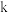 随温度升高而增大。则达到平衡后,仅升高温度,
随温度升高而增大。则达到平衡后,仅升高温度,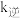 增大的倍数
增大的倍数 ”“
”“ ”或“
”或“ ”)
”)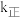 增大的倍数。
增大的倍数。③该条件下,容器中反应达到化学平衡状态的依据是
A.容器内混合气体密度不再变化
B.
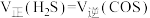
C.容器内的压强不再变化
D.
 与
与 的物质的量之比不变
的物质的量之比不变(3)工业上可以通过硫化氢分解制得
 和硫蒸气。在密闭容器中充入一定量
和硫蒸气。在密闭容器中充入一定量 气体,反应原理:
气体,反应原理: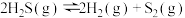 ,
, 气体的平衡转化率与温度、压强的关系如下图所示。
气体的平衡转化率与温度、压强的关系如下图所示。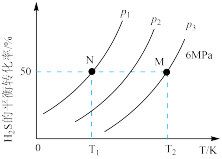
①图中压强(
 、
、 、
、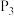 )从大到小顺序为
)从大到小顺序为②如果要进一步提高
 的平衡转化率,除改变温度、压强外,还可以采取的措施有
的平衡转化率,除改变温度、压强外,还可以采取的措施有③在温度
 、
、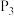
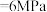 条件下,该反应的平衡常数
条件下,该反应的平衡常数
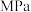 (已知:用平衡分压代替平衡浓度计算,
(已知:用平衡分压代替平衡浓度计算,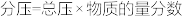 )。
)。
2021·黑龙江大庆·一模 查看更多[6]
黑龙江省大庆市2021届高三第一次教学质量检测理综化学试题(已下线)化学-学科网2021年高三5月大联考考后强化卷(新课标Ⅰ卷)(已下线)化学-学科网2021年高三5月大联考考后强化卷(新课标Ⅲ卷)(已下线)化学-学科网2021年高三5月大联考考后强化卷(新课标Ⅱ卷)黑龙江省大庆市大庆铁人中学2021-2022学年高二上学期第一次月考化学试题江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题
更新时间:2021-10-14 08:26:04
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】Cu2O是一种重要的工业原料,广泛川作催化剂。
Ⅰ.制备Cu2O
(1)微乳液—还原法:在100℃的Cu(NO3)2溶液中加入一定体积的NaOH溶液,搅拌均匀,再逐滴加入肼(N2H4)产生红色沉淀,抽滤、洗涤、干燥,得到Cu2O。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-akJ·mol-1
Cu(OH)2(s)=CuO(s)+H2O(l)△H=+bkJ·mol-1
4CuO(s)=2Cu2O(s)+O2(g)△H=+ckJ·mol-1
则由N2H4(l)和Cu(OH)2(s)反应制备Cu2O(s)的热化学方程式为___
(2)电解法:纳米级Cu2O由于具有优良的催化性能而受到关注。
采用阴离子交换膜制备纳米级Cu2O的装置如图所示:
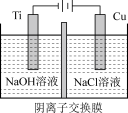
阳极的电极反应式为_____ 。
Ⅱ.纳米级Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g)⇌CH3OH(g)△H=-90.8kJ·mol-1
(3)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是(填字母)。
CH3OH(g)已达平衡状态的是(填字母)。
(4)t℃时,在体积为2L固定体积的密闭容器中加入2.00molH2(g)和1.00molCO(g),起始总压为30kPa,CO的物质的量随时间的变化如表:
根据表中数据回答:
①0~5s内CH3OH的平均速率是_____ ,氢气平衡转化率为_____ 。
②t℃时该反应的压力平衡常数Kp为_____ 。(用平衡分压代替平衡浓度,气体分压=总压×物质的量分数)
③保持其它条件不变,向平衡体系中充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正_____ v逆(填“>”“<”或“=”)。
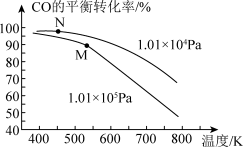
(5)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:_____
Ⅰ.制备Cu2O
(1)微乳液—还原法:在100℃的Cu(NO3)2溶液中加入一定体积的NaOH溶液,搅拌均匀,再逐滴加入肼(N2H4)产生红色沉淀,抽滤、洗涤、干燥,得到Cu2O。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-akJ·mol-1
Cu(OH)2(s)=CuO(s)+H2O(l)△H=+bkJ·mol-1
4CuO(s)=2Cu2O(s)+O2(g)△H=+ckJ·mol-1
则由N2H4(l)和Cu(OH)2(s)反应制备Cu2O(s)的热化学方程式为
(2)电解法:纳米级Cu2O由于具有优良的催化性能而受到关注。
采用阴离子交换膜制备纳米级Cu2O的装置如图所示:

阳极的电极反应式为
Ⅱ.纳米级Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g)⇌CH3OH(g)△H=-90.8kJ·mol-1
(3)能说明反应CO(g)+2H2(g)
 CH3OH(g)已达平衡状态的是(填字母)。
CH3OH(g)已达平衡状态的是(填字母)。| A.CO的消耗速率等于CH3OH的生成速率 |
| B.一定条件,CO的转化率不再变化 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.CO和H2的浓度比不变 |
时间(s) | 0 | 2 | 5 | 10 | 20 | 40 | 80 |
| 物质的量(mol) | 1.00 | 0.50 | 0.375 | 0.25 | 0.20 | 0.20 | 0.20 |
①0~5s内CH3OH的平均速率是
②t℃时该反应的压力平衡常数Kp为
③保持其它条件不变,向平衡体系中充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正
(5)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:

您最近一年使用:0次
【推荐2】二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知;:CO2(g)+3H2(g) CH3OH(l)+H2O(l) △H=-131.0kJ/mol;
CH3OH(l)+H2O(l) △H=-131.0kJ/mol;
H2(g)+ O2(g)= H2O(l) △H=-285.8 kJ/mol。
O2(g)= H2O(l) △H=-285.8 kJ/mol。
CH3OH的燃烧热△H=_______ 。
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g)+CH4(g) CH3COOH(g) △H=+36.0kJ/mol。在不同温度下乙酸的生成速率变化如右图所示。
CH3COOH(g) △H=+36.0kJ/mol。在不同温度下乙酸的生成速率变化如右图所示。
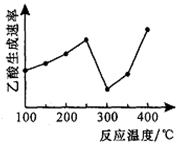
①当温度在250℃~300℃范围时,乙酸的生成速率减慢的主要原因是______ ;当温度在300℃~400℃范围时,影响乙酸生成速率的主要因素是________ 。
②欲使乙酸的平衡产率提高,应采取的措施是________ (填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s)+CO2(g) 2CO(g)。
2CO(g)。
①向容积为1L的恒容容器中加入0.2mol CO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如右图所示,则该反应为_____ (填“放热”或“吸热”)反应。某温度下,若向该平衡体系中再通入0.2mol CO2,平衡____ (填“正向”、“逆向”或“不”)移动,达到新平衡后,体系中CO的百分含量________ (填“变大”、“变小”或“不变”)。
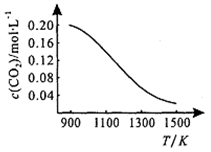
②向压强为p,体积可变的恒压容器中充入一定量CO2,650℃时反应达平衡,CO的体积分数为40.0%,则CO2的转化率为_________ 。气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=_________ (用含p的代数式表示),若向平衡体系中再充入V(CO2): V(CO)=5:4的混合气体,平衡______ (填“正向”、“逆向”或“不”)移动。
(1)工业上可以用CO2来生产燃料甲醇。
已知;:CO2(g)+3H2(g)
 CH3OH(l)+H2O(l) △H=-131.0kJ/mol;
CH3OH(l)+H2O(l) △H=-131.0kJ/mol;H2(g)+
 O2(g)= H2O(l) △H=-285.8 kJ/mol。
O2(g)= H2O(l) △H=-285.8 kJ/mol。CH3OH的燃烧热△H=
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g)+CH4(g)
 CH3COOH(g) △H=+36.0kJ/mol。在不同温度下乙酸的生成速率变化如右图所示。
CH3COOH(g) △H=+36.0kJ/mol。在不同温度下乙酸的生成速率变化如右图所示。
①当温度在250℃~300℃范围时,乙酸的生成速率减慢的主要原因是
②欲使乙酸的平衡产率提高,应采取的措施是
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s)+CO2(g)
 2CO(g)。
2CO(g)。①向容积为1L的恒容容器中加入0.2mol CO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如右图所示,则该反应为

②向压强为p,体积可变的恒压容器中充入一定量CO2,650℃时反应达平衡,CO的体积分数为40.0%,则CO2的转化率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】“21世纪的清洁燃料”二甲醚具有含氢量高,廉价易得,无毒等优点。回答下列问题:
(1)以 、
、 为原料制备二甲醚(CH3OCH3)涉及的主要反应如下:
为原料制备二甲醚(CH3OCH3)涉及的主要反应如下:
i.
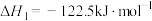 ;
;
ⅱ.
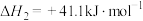 。
。
反应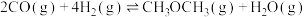 的
的 =
=______ 。
(2)二甲醚水蒸气重整制氢体系中会发生如下反应:
主反应: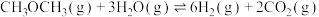
副反应: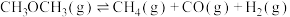

温度为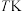 时,向压强为
时,向压强为 的恒压体系中按物质的量之比为1:3充入
的恒压体系中按物质的量之比为1:3充入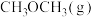 、
、 ,测得在催化剂HZSM-5催化下反应达到平衡时,二甲醚转化率为25%,且产物中
,测得在催化剂HZSM-5催化下反应达到平衡时,二甲醚转化率为25%,且产物中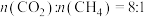 。
。
①能判断主反应达到平衡状态的标志为______ (填字母)。
A.混合气体中各物质分压保持不变 B.混合气体的密度保持不变
C.混合气体平均摩尔质量保持不变 D.消耗1mol 时,有2molCO2生成
时,有2molCO2生成
②反应达到平衡时, 的转化率为
的转化率为______ ,二甲醚水蒸气重整制氢主反应的 =
=______ (列出含 的计算式即可,用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数)。
的计算式即可,用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数)。
③已知主反应高温下可以自发进行,若升高反应温度,平衡时二甲醚的转化率______ (填“高于”或“低于”)25%。
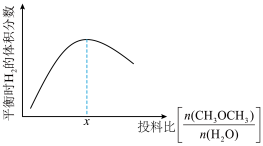
④温度压强不变,只改变反应物的投料比,平衡时 的体积分数变化趋势如图所示。投料比小于
的体积分数变化趋势如图所示。投料比小于 时,平衡时
时,平衡时 的体积分数变化趋势较投料比大于
的体积分数变化趋势较投料比大于 时更明显的原因是
时更明显的原因是____________ 。
(3)用惰性电极设计碱性二甲醚一氧气燃料电池,负极反应的电极反应式为____________ 。
(1)以
 、
、 为原料制备二甲醚(CH3OCH3)涉及的主要反应如下:
为原料制备二甲醚(CH3OCH3)涉及的主要反应如下:i.

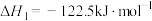 ;
;ⅱ.

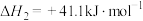 。
。反应
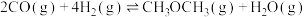 的
的 =
=(2)二甲醚水蒸气重整制氢体系中会发生如下反应:
主反应:
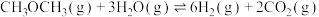
副反应:
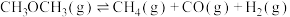

温度为
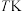 时,向压强为
时,向压强为 的恒压体系中按物质的量之比为1:3充入
的恒压体系中按物质的量之比为1:3充入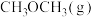 、
、 ,测得在催化剂HZSM-5催化下反应达到平衡时,二甲醚转化率为25%,且产物中
,测得在催化剂HZSM-5催化下反应达到平衡时,二甲醚转化率为25%,且产物中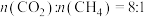 。
。①能判断主反应达到平衡状态的标志为
A.混合气体中各物质分压保持不变 B.混合气体的密度保持不变
C.混合气体平均摩尔质量保持不变 D.消耗1mol
 时,有2molCO2生成
时,有2molCO2生成②反应达到平衡时,
 的转化率为
的转化率为 =
= 的计算式即可,用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数)。
的计算式即可,用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数)。③已知主反应高温下可以自发进行,若升高反应温度,平衡时二甲醚的转化率
④温度压强不变,只改变反应物的投料比,平衡时
 的体积分数变化趋势如图所示。投料比小于
的体积分数变化趋势如图所示。投料比小于 时,平衡时
时,平衡时 的体积分数变化趋势较投料比大于
的体积分数变化趋势较投料比大于 时更明显的原因是
时更明显的原因是
(3)用惰性电极设计碱性二甲醚一氧气燃料电池,负极反应的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】在处理NO废气的过程中,催化剂 会逐渐失活变为
会逐渐失活变为 。某小组为解决这一问题,实验研究
。某小组为解决这一问题,实验研究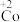 和
和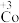 之间的相互转化。
之间的相互转化。
资料:i.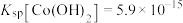
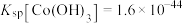
ii.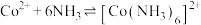
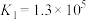
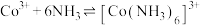
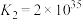
iii. 和
和 在酸性条件下均能生成
在酸性条件下均能生成
(1)探究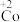 的还原性
的还原性
实验I.粉红色的 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。
实验II.向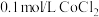 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。
实验III.按下图装置进行实验,观察到电压表指针偏转。 可以被酸性
可以被酸性 溶液氧化。
溶液氧化。
乙同学补充实验Ⅳ,___________ (补全实验操作及现象),否定了该观点。
②探究碱性条件下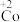 的还原性,进行实验。
的还原性,进行实验。
实验Ⅴ.___________ 。
③根据氧化还原反应规律解释还原性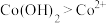 :
: 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使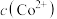 和
和 均降低,但
均降低,但___________ 降低的程度更大,还原剂的还原性增强。
(2)探究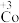 的氧化性
的氧化性
根据实验Ⅲ和Ⅳ推测氧化性: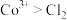 ,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,
,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,___________ (补全实验操作及现象),反应的离子方程式是___________ 。
(3)催化剂 的失活与再生
的失活与再生
①结合数据解释 能被氧化为
能被氧化为 而失活的原因:
而失活的原因:___________ 。
③根据以上实验,设计物质转化流程图 实现 的再生:
的再生:___________ 。
示例: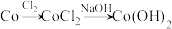 。
。
 会逐渐失活变为
会逐渐失活变为 。某小组为解决这一问题,实验研究
。某小组为解决这一问题,实验研究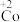 和
和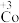 之间的相互转化。
之间的相互转化。资料:i.
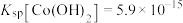
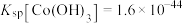
ii.
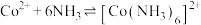
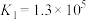
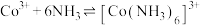
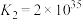
iii.
 和
和 在酸性条件下均能生成
在酸性条件下均能生成
(1)探究
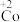 的还原性
的还原性实验I.粉红色的
 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。实验II.向
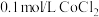 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。实验III.按下图装置进行实验,观察到电压表指针偏转。

 可以被酸性
可以被酸性 溶液氧化。
溶液氧化。乙同学补充实验Ⅳ,
②探究碱性条件下
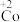 的还原性,进行实验。
的还原性,进行实验。实验Ⅴ.

③根据氧化还原反应规律解释还原性
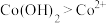 :
: 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使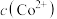 和
和 均降低,但
均降低,但(2)探究
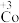 的氧化性
的氧化性根据实验Ⅲ和Ⅳ推测氧化性:
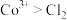 ,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,
,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,(3)催化剂
 的失活与再生
的失活与再生①结合数据解释
 能被氧化为
能被氧化为 而失活的原因:
而失活的原因:③根据以上实验,设计物质转化
 的再生:
的再生:示例:
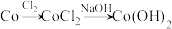 。
。
您最近一年使用:0次
【推荐2】资源化利用CO2不仅可以减少温室气体的排放,还可以重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式为:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ∆H=-76.0kJ/mol,该反应中每生成1mol Fe3O4,转移电子的数目为_______ 。
(2)在一定条件下,二氧化碳转化为甲烷的反应为:CO2(g)+4H2(g) ⇌CH4(g)+2H2O(g) ∆H<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol/L,H2 0.8 mol/L,CH4 0.8 mol/L,H2O 1.6 mol/L。起始充入CO2和H2的物质的量分别为_______ 、_______ 。CO2的平衡转化率为_______ 。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1mol CO2和4molH2,在Ⅱ中充入1mol CH4和2molH2O(g),300℃开始反应,达到平衡时,下列说法正确的是_____ (填字母)。
A.容器Ⅰ、Ⅱ中正反应速率相同 B.容器Ⅰ、Ⅱ中反应的平衡常数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
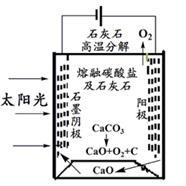
①上述生产过程的能量转化方式是_______ 、_______ 。
②上述电解反应在温度小于900℃时进行,碳酸钙分解为CaO和CO2,电解质为熔融碳酸钠,则阳极电极反应式为_______ ,阴极电极反应式为_______ 。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式为:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ∆H=-76.0kJ/mol,该反应中每生成1mol Fe3O4,转移电子的数目为
(2)在一定条件下,二氧化碳转化为甲烷的反应为:CO2(g)+4H2(g) ⇌CH4(g)+2H2O(g) ∆H<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol/L,H2 0.8 mol/L,CH4 0.8 mol/L,H2O 1.6 mol/L。起始充入CO2和H2的物质的量分别为
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1mol CO2和4molH2,在Ⅱ中充入1mol CH4和2molH2O(g),300℃开始反应,达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同 B.容器Ⅰ、Ⅱ中反应的平衡常数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:

①上述生产过程的能量转化方式是
②上述电解反应在温度小于900℃时进行,碳酸钙分解为CaO和CO2,电解质为熔融碳酸钠,则阳极电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】钛是一种重要的金属,工业上用钛铁矿(主要成分为FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制钛白粉(TiO2),TiO2常通过两种方法可制得Ti。

其中,2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。回答下列问题。
(1)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:SiO2+2NaOH=Na2SiO3+H2O和___________ 。
(2)滤液①中的溶质主要是FeSO4,检验其中Fe2+的方法是:__________ 。
(3)从TiOSO4→H2TiO3需要加热,则加热的目的是:___________ 。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。其阴极反应的电极反应式为:__________ 。
(5)从化学平衡的角度解释:往TiO2和Cl2反应体系中加入焦炭后,能使反应TIO2(s)+2C12(g)⇌TICl4(l)+O2(g)顺利进行的原因是:__________ 。

其中,2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。回答下列问题。
(1)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:SiO2+2NaOH=Na2SiO3+H2O和
(2)滤液①中的溶质主要是FeSO4,检验其中Fe2+的方法是:
(3)从TiOSO4→H2TiO3需要加热,则加热的目的是:
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。其阴极反应的电极反应式为:
(5)从化学平衡的角度解释:往TiO2和Cl2反应体系中加入焦炭后,能使反应TIO2(s)+2C12(g)⇌TICl4(l)+O2(g)顺利进行的原因是:
您最近一年使用:0次
【推荐1】矿石燃料的直接燃烧不仅会有能量利用率低的问题,还会造成严重的环境污染,释放出大量 等污染气体。但是如果加以良好的利用,排放的污染物也会变废为宝。
等污染气体。但是如果加以良好的利用,排放的污染物也会变废为宝。
Ⅰ.在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,用 将CO氧化,
将CO氧化, 被还原为固态S。
被还原为固态S。
已知:

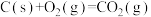

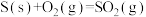

(1) 氧化
氧化 的热化学方程式为
的热化学方程式为_______ 。
Ⅱ.为了减少对环境的污染,煤在直接燃烧前要进行脱硫处理。应用电解法对煤进行脱硫处理具有脱硫效率高、经济效益好等优点。电解脱硫的基本原理如图所示,利用电极反应将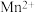 转化成
转化成 、
、 再将煤中的含硫物质(主要是)氧化为
再将煤中的含硫物质(主要是)氧化为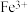 和
和 。
。

(2)写出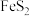 被氧化过程的离子方程式
被氧化过程的离子方程式_______ 。电解过程中,外电路每转移1mol电子,溶液中 的物质的量将
的物质的量将_______ mol(可用分数表示)。
Ⅲ.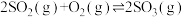 是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
(3)一定条件下,在2L密闭容器中加入4mol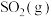 、6mol
、6mol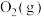 和2mol
和2mol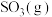 发生上述反应,在2min末达到平衡,测得
发生上述反应,在2min末达到平衡,测得 。
。
①该条件下反应的平衡常数
_______ ,若平衡后保持恒容再加入 、
、 、
、 各1mol,此
各1mol,此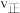
_______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
②恒温恒容下,能说明该反应达到化学平衡状态的是_______ (填字母序号)。
a.
b.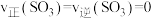
c.混合气体的密度不再变化
d. 不再变化
不再变化
e.单位时间内生成n mol 的同时生成2n mol
的同时生成2n mol
 等污染气体。但是如果加以良好的利用,排放的污染物也会变废为宝。
等污染气体。但是如果加以良好的利用,排放的污染物也会变废为宝。Ⅰ.在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,用
 将CO氧化,
将CO氧化, 被还原为固态S。
被还原为固态S。已知:


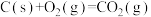

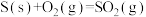

(1)
 氧化
氧化 的热化学方程式为
的热化学方程式为Ⅱ.为了减少对环境的污染,煤在直接燃烧前要进行脱硫处理。应用电解法对煤进行脱硫处理具有脱硫效率高、经济效益好等优点。电解脱硫的基本原理如图所示,利用电极反应将
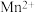 转化成
转化成 、
、 再将煤中的含硫物质(主要是)氧化为
再将煤中的含硫物质(主要是)氧化为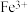 和
和 。
。
(2)写出
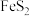 被氧化过程的离子方程式
被氧化过程的离子方程式 的物质的量将
的物质的量将Ⅲ.
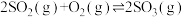 是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。(3)一定条件下,在2L密闭容器中加入4mol
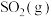 、6mol
、6mol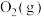 和2mol
和2mol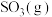 发生上述反应,在2min末达到平衡,测得
发生上述反应,在2min末达到平衡,测得 。
。①该条件下反应的平衡常数

 、
、 、
、 各1mol,此
各1mol,此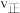
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)②恒温恒容下,能说明该反应达到化学平衡状态的是
a.

b.
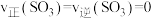
c.混合气体的密度不再变化
d.
 不再变化
不再变化e.单位时间内生成n mol
 的同时生成2n mol
的同时生成2n mol
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】甲醇是重要的化工原料,甲醇的制备与应用也是国际研究的热点。
I.某温度下,利用 生产甲醇主要涉及以下反应。
生产甲醇主要涉及以下反应。
反应1.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)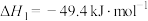 ;
;
反应2.CO2(g)+H2(g) ⇌ CO(g)+H2O(g)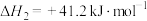 ;
;
(1)反应1自发进行的条件是___________ (填“高温”、“低温”或“任意温度”)。
(2)升高温度,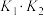 的值将
的值将___________ (填“增大”、“减小”或“不变”)。
(3)向绝热恒容密闭容器中充入等物质的量的CO2(g)和H2(g)发生上述反应,下列可说明反应已达平衡状态的是___________(填编号)。
(4)在恒温密闭容器中,发生反应1和反应2,CO2的平衡转化率[α(CO2)%]和甲醇选择性[CH3OH%= ]随着温度变化关系如图所示。
]随着温度变化关系如图所示。___________ 。
②分析温度高于236°C后CO2转化率下降的原因___________ 。
③在244°C,向容积为V的容器内投入1molCO2(g)和3molH2(g)充分反应,计算平衡时生成CH3OH的物质的量为___________ mol(计算结果保留两位有效数字)。
II.工业上也可用电化学法制备甲醇。
(5)采用如图原电池制备甲醇。通入CO的一端发生的电极反应为___________ 。
I.某温度下,利用
 生产甲醇主要涉及以下反应。
生产甲醇主要涉及以下反应。反应1.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
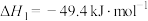 ;
;
反应2.CO2(g)+H2(g) ⇌ CO(g)+H2O(g)
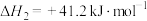 ;
;
(1)反应1自发进行的条件是
(2)升高温度,
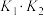 的值将
的值将(3)向绝热恒容密闭容器中充入等物质的量的CO2(g)和H2(g)发生上述反应,下列可说明反应已达平衡状态的是___________(填编号)。
| A.容器内温度不变 | B.混合气体平均密度保持不变 |
| C.CH3OH的体积分数保持不变 | D.v正(CO2)=v逆(CO) |
 ]随着温度变化关系如图所示。
]随着温度变化关系如图所示。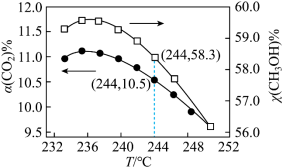
②分析温度高于236°C后CO2转化率下降的原因
③在244°C,向容积为V的容器内投入1molCO2(g)和3molH2(g)充分反应,计算平衡时生成CH3OH的物质的量为
II.工业上也可用电化学法制备甲醇。
(5)采用如图原电池制备甲醇。通入CO的一端发生的电极反应为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】还原法处理氮的氧化物是环境科学研究的热点课题。
Ⅰ.氢气还原法。H2还原NO发生的反应为:2NO(g)+2H2(g) N2(g)+2H2O(g)。
N2(g)+2H2O(g)。
(1)已知几种化学键的键能数据如下:
2NO(g)+2H2(g) N2(g)+2H2O(g) ΔH=
N2(g)+2H2O(g) ΔH=___________ kJ·mol-1。
(2)2NO(g)+2H2(g) N2(g)+2H2O(g) 的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
N2(g)+2H2O(g) 的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
反应1:2NO(g)+H2(g) N2(g)+H2O2(g);
N2(g)+H2O2(g);
反应2:H2O2(g)+H2(g) 2H2O(g)。
2H2O(g)。
总反应速率由反应较慢的一步决定,由此推知上述两步反应中,反应较慢的是___________ (填“反应l”或 “反应2”)。对总反应速率的影响程度c(NO)___________ c(H2)(填“>”“<”或“=”)。
Ⅱ.NH3还原法。在恒容密闭容器中充入NH3和NO2,在一定温度下发生反应: 8NH3(g)+6NO2(g) 7N2(g)+12H2O(g)。
7N2(g)+12H2O(g)。
(3)下列表明该反应达到平衡状态的是_____ (填字母)。
A.混合气体密度保持不变 B.NO2和NH3的消耗速率之比为3∶4
C.混合气体颜色不变 D.混合气体压强保持不变
Ⅲ. CO还原法。
利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH,在2 L恒容密闭容器中充入1 mol CO和1 mol NO,测得NO的转化率与温度、时间的关系如图所示:
N2(g)+2CO2(g) ΔH,在2 L恒容密闭容器中充入1 mol CO和1 mol NO,测得NO的转化率与温度、时间的关系如图所示:
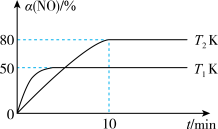
(4)下列说法正确的是___________ (填字母)。
A.ΔH<0
B.上述反应一定能自发进行
C.增大NO的浓度,反应物的转化率增大
D.温度为T1、T2时的平衡常数分别为K1、K2,则K1<K2
(5)T2温度下,0~10 min内用CO表示的平均反应速率v(CO)=___________ mol·L-1·min-1;T1温度下,上述反应的平衡常数K1=___________ L·mol-1。
(6)T1温度下,向平衡后的容器内再加入1 mol CO和1 mol NO,则再次达平衡时NO的转化率______ (填“增大”“减小”或“不变”)。
Ⅰ.氢气还原法。H2还原NO发生的反应为:2NO(g)+2H2(g)
 N2(g)+2H2O(g)。
N2(g)+2H2O(g)。(1)已知几种化学键的键能数据如下:
| 化学键 | H-H | NO中的共价键 | N≡N | H-O |
| 键能(kJ·mol-1) | 436 | 630 | 946 | 463 |
 N2(g)+2H2O(g) ΔH=
N2(g)+2H2O(g) ΔH=(2)2NO(g)+2H2(g)
 N2(g)+2H2O(g) 的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
N2(g)+2H2O(g) 的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:反应1:2NO(g)+H2(g)
 N2(g)+H2O2(g);
N2(g)+H2O2(g);反应2:H2O2(g)+H2(g)
 2H2O(g)。
2H2O(g)。总反应速率由反应较慢的一步决定,由此推知上述两步反应中,反应较慢的是
Ⅱ.NH3还原法。在恒容密闭容器中充入NH3和NO2,在一定温度下发生反应: 8NH3(g)+6NO2(g)
 7N2(g)+12H2O(g)。
7N2(g)+12H2O(g)。(3)下列表明该反应达到平衡状态的是
A.混合气体密度保持不变 B.NO2和NH3的消耗速率之比为3∶4
C.混合气体颜色不变 D.混合气体压强保持不变
Ⅲ. CO还原法。
利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH,在2 L恒容密闭容器中充入1 mol CO和1 mol NO,测得NO的转化率与温度、时间的关系如图所示:
N2(g)+2CO2(g) ΔH,在2 L恒容密闭容器中充入1 mol CO和1 mol NO,测得NO的转化率与温度、时间的关系如图所示:
(4)下列说法正确的是
A.ΔH<0
B.上述反应一定能自发进行
C.增大NO的浓度,反应物的转化率增大
D.温度为T1、T2时的平衡常数分别为K1、K2,则K1<K2
(5)T2温度下,0~10 min内用CO表示的平均反应速率v(CO)=
(6)T1温度下,向平衡后的容器内再加入1 mol CO和1 mol NO,则再次达平衡时NO的转化率
您最近一年使用:0次
【推荐1】碳的化合物在工业上应用广泛。
(1)已知下列热化学方程式:
ⅰ.CH2=CHCH3(g)+ Cl2(g)=CH2ClCHClCH3(g) H1=-133 kJ·mol-1
ⅱ.CH2=CHCH3(g)+Cl2(g)=CH2=CHCH2Cl(g)+HCl(g) ΔH2=-100 kJ·mol-1
又已知在相同条件下,CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g) 的正反应的活化能Ea(正)为132 kJ·mol-1,则逆反应的活化能Ea(逆)为________ kJ·mol-1。
(2)查阅资料得知,反应CH3CHO(aq)=CH4(g)+CO(g)在含有少量I2的溶液中分两步进行:
第Ⅰ步反应为CH3CHO(aq)+I2(aq)→CH3I(l)+HI(aq)+CO(g)(慢反应);
第Ⅱ步为快反应。增大I2的浓度________ (填“能”或“ 不能”)明显增大总反应的平均速率,理由为_____________________________ 。
(3)用催化剂Fe3(CO)12/ZSM5催化CO2加氢合成乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
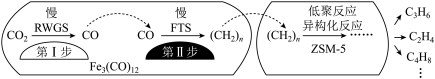
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM5中添加________ 助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是____________ 。
(4)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4) =2∶1,发生反应:CH4(g)+2H2S(g)=CS2(g)+4H2(g)。0.11 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
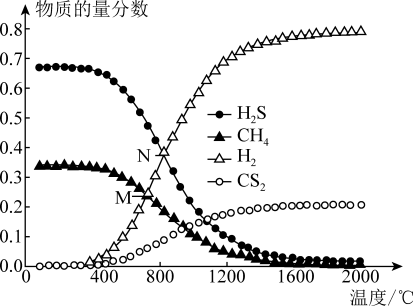
为提高H2S的平衡转化率,除改变温度外,还可采取的措施是____________________ (列举一条)。N点对应温度下,该反应的Kp=_____ (MPa)2(Kp为以分压表示的平衡常数)。
(5)合成碳酸二甲酯的工作原理如图所示。
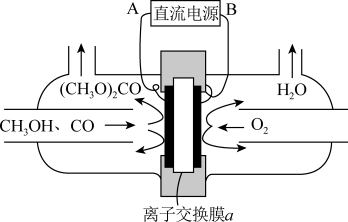
阳极的电极反应式为__________ ,离子交换膜a为________ (填“阳膜”“阴膜”)。
(1)已知下列热化学方程式:
ⅰ.CH2=CHCH3(g)+ Cl2(g)=CH2ClCHClCH3(g) H1=-133 kJ·mol-1
ⅱ.CH2=CHCH3(g)+Cl2(g)=CH2=CHCH2Cl(g)+HCl(g) ΔH2=-100 kJ·mol-1
又已知在相同条件下,CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g) 的正反应的活化能Ea(正)为132 kJ·mol-1,则逆反应的活化能Ea(逆)为
(2)查阅资料得知,反应CH3CHO(aq)=CH4(g)+CO(g)在含有少量I2的溶液中分两步进行:
第Ⅰ步反应为CH3CHO(aq)+I2(aq)→CH3I(l)+HI(aq)+CO(g)(慢反应);
第Ⅱ步为快反应。增大I2的浓度
(3)用催化剂Fe3(CO)12/ZSM5催化CO2加氢合成乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
(4)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4) =2∶1,发生反应:CH4(g)+2H2S(g)=CS2(g)+4H2(g)。0.11 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:

为提高H2S的平衡转化率,除改变温度外,还可采取的措施是
(5)合成碳酸二甲酯的工作原理如图所示。

阳极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2mol NO2的能量变化)。1mol NO氧化为NO2的焓变△H=_____ 。
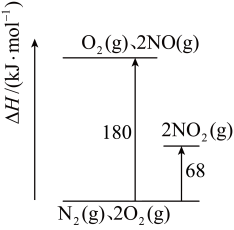
(2)某温度下,反应的平衡常数如下:a.2NO2(g) N2(g)+2O2(g) K=6.7×1016,b. 2NO(g)
N2(g)+2O2(g) K=6.7×1016,b. 2NO(g) N2(g)+O2(g) K=2.2×1030,分解反应趋势较大的反应是
N2(g)+O2(g) K=2.2×1030,分解反应趋势较大的反应是____ (填“a”或“b”);反应2NO(g)+O2(g) 2NO2(g)的K=
2NO2(g)的K=____ 。
(3)已知反应2NO(g)+O2(g) 2NO2(g)的正反应速率V正=kcm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
2NO2(g)的正反应速率V正=kcm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
则k=____ ,m=____ ,n=____ 。
(4)已知该反应的历程为:第一步:NO+NO N2O2 快速平衡;第二步:N2O2+O2
N2O2 快速平衡;第二步:N2O2+O2 2NO2慢反应,其中可近似认为第二步反应不影响第一步的平衡,第一步反应V(正)=k1c2(NO),V(逆)=k-1c(N2O2)。下列叙述正确的是
2NO2慢反应,其中可近似认为第二步反应不影响第一步的平衡,第一步反应V(正)=k1c2(NO),V(逆)=k-1c(N2O2)。下列叙述正确的是____ (填字母)。
A.第一步反应的平衡常数K=
B. V(第一步的正反应)<V(第二步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如下变化。

①NO的平衡转化率为____ 。
②该温度下反应2NO(g)+O2(g) 2NO2(g)的平衡常数为
2NO2(g)的平衡常数为_____ (保留整数)。
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2mol NO2的能量变化)。1mol NO氧化为NO2的焓变△H=

(2)某温度下,反应的平衡常数如下:a.2NO2(g)
 N2(g)+2O2(g) K=6.7×1016,b. 2NO(g)
N2(g)+2O2(g) K=6.7×1016,b. 2NO(g) N2(g)+O2(g) K=2.2×1030,分解反应趋势较大的反应是
N2(g)+O2(g) K=2.2×1030,分解反应趋势较大的反应是 2NO2(g)的K=
2NO2(g)的K=(3)已知反应2NO(g)+O2(g)
 2NO2(g)的正反应速率V正=kcm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
2NO2(g)的正反应速率V正=kcm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。| 组别 | 起始浓度/mol·L-1 | 初始速率/mol·L-1·S-1 | |
| NO | O2 | ||
| 1 | 0.02 | 0.0125 | 7.98×10-3 |
| 2 | 0.02 | 0.0250 | 15.96×10-3 |
| 3 | 0.04 | 0.0125 | 31.92×10-3 |
(4)已知该反应的历程为:第一步:NO+NO
 N2O2 快速平衡;第二步:N2O2+O2
N2O2 快速平衡;第二步:N2O2+O2 2NO2慢反应,其中可近似认为第二步反应不影响第一步的平衡,第一步反应V(正)=k1c2(NO),V(逆)=k-1c(N2O2)。下列叙述正确的是
2NO2慢反应,其中可近似认为第二步反应不影响第一步的平衡,第一步反应V(正)=k1c2(NO),V(逆)=k-1c(N2O2)。下列叙述正确的是A.第一步反应的平衡常数K=

B. V(第一步的正反应)<V(第二步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如下变化。

①NO的平衡转化率为
②该温度下反应2NO(g)+O2(g)
 2NO2(g)的平衡常数为
2NO2(g)的平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减弱温室效应具有重要的意义。工业上CO2与CH4发生反应Ⅰ:CH4(g)+CO2(g) 2CO(g)+2H2(g)∆H1=+234kJ·mol-1,在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)
2CO(g)+2H2(g)∆H1=+234kJ·mol-1,在反应过程中还发生反应Ⅱ:H2(g)+CO2(g) H2O(g)+CO(g)∆H2=+41kJ·mol-1。
H2O(g)+CO(g)∆H2=+41kJ·mol-1。
(1)反应I在一定条件下能够自发进行的原因是__ ,在密闭容器中加入CO2与CH4发生反应,下列能够判断反应I达到平衡状态的是__ (填标号)。
A.一定温度下,容积固定的容器中,密度保持不变
B.容积固定的绝热容器中,温度保持不变
C.一定温度和容积固定的容器中,平均相对分子质量不变
(2)将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
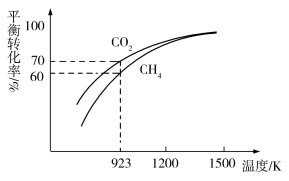
①计算923K时反应Ⅰ的化学平衡常数K=__ (计算结果保留小数点后两位)。
②1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是__ 。
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是___ 。

(4)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:

①阴极上的反应式为___ 。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CO2和CH4体积比为__ 。
 2CO(g)+2H2(g)∆H1=+234kJ·mol-1,在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)
2CO(g)+2H2(g)∆H1=+234kJ·mol-1,在反应过程中还发生反应Ⅱ:H2(g)+CO2(g) H2O(g)+CO(g)∆H2=+41kJ·mol-1。
H2O(g)+CO(g)∆H2=+41kJ·mol-1。(1)反应I在一定条件下能够自发进行的原因是
A.一定温度下,容积固定的容器中,密度保持不变
B.容积固定的绝热容器中,温度保持不变
C.一定温度和容积固定的容器中,平均相对分子质量不变
(2)将1molCH4与1molCO2在2L密闭容器中反应制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①计算923K时反应Ⅰ的化学平衡常数K=
②1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是

(4)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:

①阴极上的反应式为
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CO2和CH4体积比为
您最近一年使用:0次



