解题方法
1 . N2O是《联合国气候变化框架公约》所列六种温室气体之一。目前,直接催化分解法是消除N2O的主要方法,该过程中发生的反应如下:
i.2N2O(g) 2N2(g)+O2(g) △H1
2N2(g)+O2(g) △H1
ii.2N2O(g) N2(g)+2NO(g) △H2
N2(g)+2NO(g) △H2
iii.4N2O(g) 3N2(g)+2NO2(g) △H3
3N2(g)+2NO2(g) △H3
回答下列问题:
(1)根据盖斯定律,反应2NO(g)+O2(g) 2NO2(g)的△H=
2NO2(g)的△H=_______ (写出代数式即可)。
(2)已知反应i在任意温度下均能自发进行,则反应i为_______ (填“吸热”或“放热”)反应。
(3)反应i的势能曲线示意图如图(…表示吸附作用,A表示催化剂,TS表示过渡态分子):
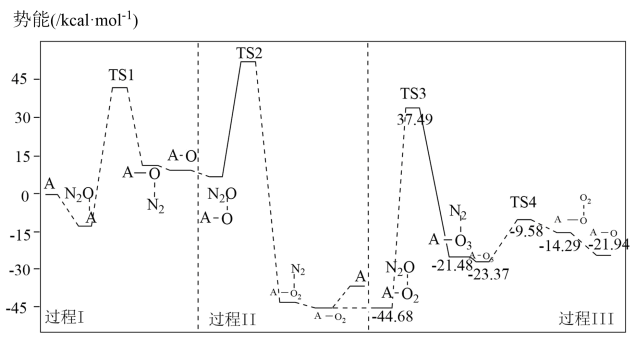
①过程III中最大势能垒(活化能)为_______ kcal·mol-1。
②下列有关反应i的说法不正确的是_______ (填标号)。
A.过程I中有极性键断裂
B.过程I、II、III中都有N2生成
C.该反应中只有两种物质能够吸附N2O分子
D.过程II中间体A-O2可释放O2也可吸附N2O分子
(4)模拟废气中N2O直接催化分解过程。
①515℃时,将模拟废气(N2O体积分数为40%)以6000m3·h-1的速度通过催化剂,测得N2O的转化率为40%,则平均反应速率v(N2O)为_______ m3·h-1。欲提高N2O的转化率,可采取的措施为_______ (任写一条)。
②T℃和P0kPa时,在恒压密闭容器中进行模拟实验。各组分的相关信息如表:
其中x=_______ ;该温度下,反应2N2O(g)  2N2(g)+O2(g)的压强平衡常数Kp=
2N2(g)+O2(g)的压强平衡常数Kp=_______ kPa(以分压表示,分压=总压×物质的量分数)。
i.2N2O(g)
 2N2(g)+O2(g) △H1
2N2(g)+O2(g) △H1ii.2N2O(g)
 N2(g)+2NO(g) △H2
N2(g)+2NO(g) △H2iii.4N2O(g)
 3N2(g)+2NO2(g) △H3
3N2(g)+2NO2(g) △H3回答下列问题:
(1)根据盖斯定律,反应2NO(g)+O2(g)
 2NO2(g)的△H=
2NO2(g)的△H=(2)已知反应i在任意温度下均能自发进行,则反应i为
(3)反应i的势能曲线示意图如图(…表示吸附作用,A表示催化剂,TS表示过渡态分子):

①过程III中最大势能垒(活化能)为
②下列有关反应i的说法不正确的是
A.过程I中有极性键断裂
B.过程I、II、III中都有N2生成
C.该反应中只有两种物质能够吸附N2O分子
D.过程II中间体A-O2可释放O2也可吸附N2O分子
(4)模拟废气中N2O直接催化分解过程。
①515℃时,将模拟废气(N2O体积分数为40%)以6000m3·h-1的速度通过催化剂,测得N2O的转化率为40%,则平均反应速率v(N2O)为
②T℃和P0kPa时,在恒压密闭容器中进行模拟实验。各组分的相关信息如表:
| 物质 | N2 | N2O | O2 | CO2 | NO | NO2 |
| n(投料)/mol | 19 | 34 | 6.5 | 25 | 0 | 0 |
| n(平衡)/mol | 50 | x | 20 | 25 | 2 | 2 |
 2N2(g)+O2(g)的压强平衡常数Kp=
2N2(g)+O2(g)的压强平衡常数Kp=
您最近一年使用:0次
2 . 碳是生命的基础,近几年科学家们纷纷掀起了研究碳的热潮。回答下列问题:
(1)2019年人们“谈霾色变”,汽车尾气是雾霾的罪魁之一。汽车尾气净化的原理为:2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH<0。
某温度下,恒容的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
①2s内用N2表示的化学反应速率为___ ,该温度下,反应的化学平衡常数为___ 。
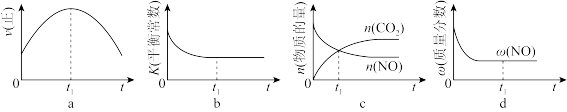
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是___ (填代号)。
(2)用CH4催化还原NOx也可以减少氮的污染。
已知:CH4(g)+2NO2(g)= CO2(g)+ N2(g)+2H2O(g) ΔH=−867kJ/mol
2NO2(g)=N2O4(g) ΔH=-56.9kJ/mol
H2O(g)=H2O(l) ΔH=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(1)的热化学方程式:___ 。
(3)常温常压下,测得向水中通入足量的CO2后,水溶液的pH=5.6。
①若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K大约为
HCO3-+H+的平衡常数K大约为___ 。(已知:溶液中c(H2CO3)=1.5×10-5 mol⸱L−1,10-5.6=2.5×10-6)
②常温下,测得NaHCO3溶液呈碱性,则溶液中c(H2CO3)___ c(CO32-)(填“>”“”或“<”),原因是___ (用离子方程式和必要的文字说明)。
③锅炉中的CaSO4沉淀可用可溶性碳酸盐浸取,然后加酸除去,浸取过程中会发生反应:CaSO4(s)+CO32-(aq) CaCO3(s)+SO42-(aq)。
CaCO3(s)+SO42-(aq)。
已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为___ (计算结果保留三位有效数字)。
(1)2019年人们“谈霾色变”,汽车尾气是雾霾的罪魁之一。汽车尾气净化的原理为:2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH<0。
某温度下,恒容的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10-3mol·L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO)/×10-3mol·L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是

(2)用CH4催化还原NOx也可以减少氮的污染。
已知:CH4(g)+2NO2(g)= CO2(g)+ N2(g)+2H2O(g) ΔH=−867kJ/mol
2NO2(g)=N2O4(g) ΔH=-56.9kJ/mol
H2O(g)=H2O(l) ΔH=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(1)的热化学方程式:
(3)常温常压下,测得向水中通入足量的CO2后,水溶液的pH=5.6。
①若忽略水的电离及H2CO3的第二级电离,则H2CO3
 HCO3-+H+的平衡常数K大约为
HCO3-+H+的平衡常数K大约为②常温下,测得NaHCO3溶液呈碱性,则溶液中c(H2CO3)
③锅炉中的CaSO4沉淀可用可溶性碳酸盐浸取,然后加酸除去,浸取过程中会发生反应:CaSO4(s)+CO32-(aq)
 CaCO3(s)+SO42-(aq)。
CaCO3(s)+SO42-(aq)。已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
您最近一年使用:0次



