2019高三·全国·专题练习
名校
1 . 环戊二烯(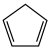 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: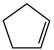 (g) =
(g) =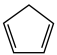 (g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应:
(g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应: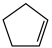 (g)+ I2(g) =
(g)+ I2(g) = (g)+2HI(g) ③ ΔH3=
(g)+2HI(g) ③ ΔH3=___________ kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯(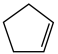 )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________ ,该反应的平衡常数Kp=_________ Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________ (填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________ (填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L−1
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:(1)已知:
 (g) =
(g) = (g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应:
(g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应: (g)+ I2(g) =
(g)+ I2(g) = (g)+2HI(g) ③ ΔH3=
(g)+2HI(g) ③ ΔH3=(2)某温度下,等物质的量的碘和环戊烯(
 )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L−1
您最近一年使用:0次
2019-06-26更新
|
2665次组卷
|
20卷引用:四川省遂宁市2020-2021学年高二下学期期末考试化学试题
四川省遂宁市2020-2021学年高二下学期期末考试化学试题(已下线)专题09 反应速率、化学平衡——2019年高考真题和模拟题化学分项汇编(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》(已下线)专题7.2 化学平衡状态 化学平衡移动(讲)-《2020年高考一轮复习讲练测》江西省高安中学2019-2020学年高二上学期期末考试化学(B卷)试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2章 综合检测高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二章素养检测(已下线)2.3.3+化学平衡常数-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过高考 3年真题强化闯关(已下线)第23讲 化学平衡状态 化学平衡的移动 (精讲)——2021年高考化学一轮复习讲练测鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考选择性必修1(SJ)专题2专题培优专练(已下线)第19讲 化学平衡(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)山东省临沂市平邑县第一中学实验部2021-2022学年高二上学期第二次月考化学试题江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题内蒙古赤峰市2021-2022学年高二下学期期末考试化学试题(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)河南省洛阳市第一中学2022-2023学年高二上学期期末检测化学试题福建省泉州市南安市侨光中学2022-2023学年高二上学期10月月考化学试题湖南省邵阳市新邵县2023-2024学年高二上学期期末考试化学试题
名校
2 . 已知:2C(s)+O2(g)===2CO(g) ΔH=-Q1 kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-Q2 kJ·mol-1;
S(s)+O2(g)===SO2(g) ΔH=-Q3 kJ·mol-1。
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为 ( )
C(s)+O2(g)===CO2(g) ΔH=-Q2 kJ·mol-1;
S(s)+O2(g)===SO2(g) ΔH=-Q3 kJ·mol-1。
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为 ( )
| A.SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-2Q2+Q3) kJ·mol-1 |
| B.S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(Q1-Q3) kJ·mol-1 |
| C.SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(Q1-2Q2+Q3) kJ·mol-1 |
| D.SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-Q2+2Q3) kJ·mol-1 |
您最近一年使用:0次
2017-11-11更新
|
948次组卷
|
7卷引用:四川省石室中学2017-2018学年高二上学期半期考试化学试题



