名校
解题方法
1 . 在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vC=2vB,则此反应可表示为
| A.2A+3B⇌2C | B.A+3B⇌2C | C.3A+B⇌2C | D.A+B⇌C |
您最近半年使用:0次
2023-02-16更新
|
1006次组卷
|
55卷引用:四川省阆中东风中学校2020-2021学年高二上学期第三学月调研监测化学试题
四川省阆中东风中学校2020-2021学年高二上学期第三学月调研监测化学试题安徽省桐城中学2020-2021学年高一上学期12月月考化学试题陕西省宝鸡市渭滨中学2020-2021学年度高二上学期期中考试化学试题北京市石景山区2020-2021学年高二上学期期末调研化学试题河北省张家口市宣化一中2020-2021学年高一下学期期初考试化学试题甘肃省民勤县第四中学2020-2021学年高二下学期开学考试化学试题辽宁省大连市普兰店区第一中学2020-2021学年高二上学期第二阶段考试化学试题四川省达州市2020-2021学年高一下学期期末检测化学试题广西桂林市2020-2021学年高二下学期期末质量检测化学试题贵州省铜仁第一中学2019-2020学年高一下学期期末考试化学试题(已下线)2.1 化学反应速率-2021-2022学年高二化学课后培优练(人教版选修4)北京市昌平区新学道临川学校2021-2022学年高二上学期第一次月考化学试题甘肃省民勤县第一中学2021-2022学年高二上学期第一次月考化学试题吉林省通化县综合高级中学2021-2022学年高二上学期期中考试化学试题安徽省宣城市六校2021-2022学年高二上学期期中联考化学试题(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)人教2019版选择性必修一第二章 第一节 化学反应速率 课后习题黑龙江省牡丹江市第三中学2021-2022学年高二上学期期中考试化学(理)试题甘肃省庆阳市第六中学2021-2022学年高二上学期期中考试化学(理)试题辽宁省大连市2021-2022学年高二上学期期末联考化学试题 河南省洛阳市2021-2022学年高二上学期期末考试化学试题 吉林省长春市第六中学2021-2022学年高二上学期第三学程考试(理)化学试题(已下线)6.2.1 化学反应的速率-2021-2022学年高一化学课后培优练(人教版2019必修第二册)四川省达州市2021-2022学年高二下学期期末监测化学试题(已下线)2.1.1 化学反应速率-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)河北省石家庄市第二十三中学2021-2022学年高一下学期期末考试化学试题上海市黄浦区联合体2021-2022学年高二下学期联合体期末模拟考试化学试题内蒙古包头市第四中学2020-2021学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题河南省郑州励德双语学校2021-2022学年高一下学期期中考试化学试题黑龙江省大庆市第二中学2022-2023学年高二上学期第一次月考化学试题河北省石家庄市第十八中学2022-2023学年高二上学期10月月考化学试题吉林省吉林市2022-2023学年高二上学期期中调研测试化学试题黑龙江省牡丹江市第二中学2022-2023学年高二上学期期中考试化学试题陕西宝鸡市眉县槐芽中学2022-2023学年高二上学期期中考试化学试题安徽省亳州市涡阳县第二中学2022-2023学年高二上学期教学检测化学试题北京市西城职业学校2021-2021学年高二上学期期中测试化学试题云南昆明市昆明行知中学2021-2022学年高二上学期期中考试化学试题(已下线)6.2.1 化学反应速率及影响因素——同步学习必备知识四川省广元中学2022-2023学年高二上学期期中考试化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题陕西省西安市鄠邑区2022-2023学年高二上学期期末质量检测化学(理)试题安徽省黄山市2022-2023学年高二上学期期末考试化学试题湖北省黄冈市2022-2023学年高二上学期11月期中考试化学试题安徽省芜湖市无为襄安中学2022-2023学年高二上学期11月期中考试化学试题广东省湛江市第二十一中学2023-2024学年高二10月月考化学试题新疆喀什地区巴楚县2023-2024学年高二上学期10月期中考试化学试题云南省大理白族自治州民族中学2023-2024学年高二上学期10月月考化学试题湖南省张家界市民族中学2023-2024学年高二上学期第二次月考化学试题内蒙古呼和浩特市第一中学2023-2024学年高二上学期期中考试化学试题陕西省西安市 周至县第四中学2023-2024学年高二上学期10月份月考化学试题 北京市第一六六中学2023-2024学年高二上学期期中考试化学试卷黑龙江省哈尔滨师范大学青冈实验中学2023-2024学年高二上学期期中考试化学试题青海省西宁北外附属新华联外国语高级中学2023-2024学年高二上学期期中考试化学试题内蒙古呼和浩特市回民区2023-2024学年高二上学期期中考试化学试题
解题方法
2 . 某小组同学查到一份研究过氧化氢溶液与氢碘酸( )反应的实验资料,具体如下。
)反应的实验资料,具体如下。
资料1:室温下,过氧化氢溶液可与氢碘酸反应: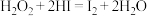
资料2:碘单质溶于水后,溶液为棕黄色。
资料3:实验数据如表所示。
(1)通过资料了中的数据,可以得出的结论是_______ 。
(2)资料3中编号为1的实验继续反应,20s后测得过氧化氢浓度为 ,则
,则
_______ 。
(3)该小组同学欲用碘化钾替代氢碘酸验证上述实验。在实验过程中,未观察到溶液变为棕黄色,却观察到有无色气体产生。于是,该小组同学提出假设: 可能是过氧化氢分解反应的催化剂。
可能是过氧化氢分解反应的催化剂。
①小组同学提出上述假设的依据是_______ 。
②请设计实验方案验证假设: 可能是过氧化氢分解反应的催化剂。(仪器和试剂可自选)
可能是过氧化氢分解反应的催化剂。(仪器和试剂可自选)
实验方案:_______ 。
(4)某研究人员通过研究得到以下两组数据( 为反应的活化能)。
为反应的活化能)。
第1组:
第2组:
结合第1组和第2组数据,你认为他所研究的问题是_______ 。
 )反应的实验资料,具体如下。
)反应的实验资料,具体如下。资料1:室温下,过氧化氢溶液可与氢碘酸反应:
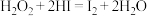
资料2:碘单质溶于水后,溶液为棕黄色。
资料3:实验数据如表所示。
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
 | 0.1 | 0.1 | 0.1 | 0.2 | 0.3 |
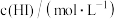 | 0.1 | 0.2 | 0.3 | 0.1 | 0.1 |
| 从混合到出现棕黄色时间/s | 13 | 6.5 | 4.3 | 6.6 | 4.4 |
(2)资料3中编号为1的实验继续反应,20s后测得过氧化氢浓度为
 ,则
,则
(3)该小组同学欲用碘化钾替代氢碘酸验证上述实验。在实验过程中,未观察到溶液变为棕黄色,却观察到有无色气体产生。于是,该小组同学提出假设:
 可能是过氧化氢分解反应的催化剂。
可能是过氧化氢分解反应的催化剂。①小组同学提出上述假设的依据是
②请设计实验方案验证假设:
 可能是过氧化氢分解反应的催化剂。(仪器和试剂可自选)
可能是过氧化氢分解反应的催化剂。(仪器和试剂可自选)实验方案:
(4)某研究人员通过研究得到以下两组数据(
 为反应的活化能)。
为反应的活化能)。第1组:
| 反应 | 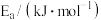 |  | 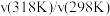 |
| A | 100 | 298→318 | 14.0 |
| 反应 | 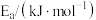 |  |
| A | 100 | 3205 |
| B | 120 |
您最近半年使用:0次
解题方法
3 . 在一定体积的密闭容器中进行如下反应: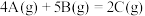
(1)开始时,A为 ,2s后,A为
,2s后,A为 。计算该反应的速率
。计算该反应的速率_______ 。
(2)请用适当的理论模型解释。
①温度升高,反应速率提高_______ 。
②使用催化剂,反应速率提高_______ 。
③增大A的浓度,反应速率提高_______ 。
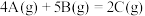
(1)开始时,A为
 ,2s后,A为
,2s后,A为 。计算该反应的速率
。计算该反应的速率(2)请用适当的理论模型解释。
①温度升高,反应速率提高
②使用催化剂,反应速率提高
③增大A的浓度,反应速率提高
您最近半年使用:0次
解题方法
4 . 乙醇是酒精饮料的主要成分,由葡萄糖发酵生成。反应的化学方程式为: 。若某次发酵过程中
。若某次发酵过程中 的反应速率是
的反应速率是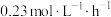 ,则用
,则用 表示的该反应的化学反应速率是多少
表示的该反应的化学反应速率是多少_______ ?
 。若某次发酵过程中
。若某次发酵过程中 的反应速率是
的反应速率是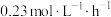 ,则用
,则用 表示的该反应的化学反应速率是多少
表示的该反应的化学反应速率是多少
您最近半年使用:0次
名校
5 . 20℃时,将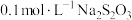 溶液与
溶液与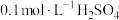 溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为:
溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为: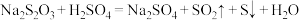 ,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?
,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?_______
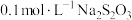 溶液与
溶液与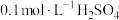 溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为:
溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为: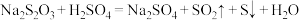 ,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?
,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?
您最近半年使用:0次
2022-11-25更新
|
454次组卷
|
3卷引用:苏教2020版选择性必修1专题2第三单元 化学平衡的移动课后习题
6 . 2L恒容密闭容器中,充入0.6mol X气体和0.4mol Y气体,发生如下反应: ,5min末容器中W的物质的量为0.2mol。若测得前5min以Z浓度变化来表示的平均反应速率为
,5min末容器中W的物质的量为0.2mol。若测得前5min以Z浓度变化来表示的平均反应速率为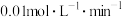 ,则:
,则:
(1)上述反应的化学方程式中Z的化学计量数n的值是________
(2)上述反应在5min末时,已消耗掉Y的物质的量分数是________
(3)下列措施可以加快该反应速率的是________
 ,5min末容器中W的物质的量为0.2mol。若测得前5min以Z浓度变化来表示的平均反应速率为
,5min末容器中W的物质的量为0.2mol。若测得前5min以Z浓度变化来表示的平均反应速率为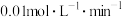 ,则:
,则:(1)上述反应的化学方程式中Z的化学计量数n的值是________
| A.1 | B.2 | C.3 | D.4 |
| A.20% | B.25% | C.33% | D.50% |
| A.Y的物质的量减少为0.2mol | B.将容器体积扩大至4L |
| C.升高温度 | D.向容器中充入与反应无关的氩气 |
您最近半年使用:0次
2022-11-24更新
|
216次组卷
|
2卷引用:苏教2020版化学必修第二册专题6第三单元 化学能与电能的转化课后习题
9-10高一下·河北石家庄·期中
名校
解题方法
7 . 反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的速率可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的速率可表示为
 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的速率可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的速率可表示为| A.υ(NH3)=0.01 mol∙L−1∙s−1 | B.υ(O2)=0.001 mol∙L−1∙s−1 |
| C.υ(NO)=0.001 mol∙L−1∙s−1 | D.υ(H2O)=0.045 mol∙L−1∙s−1 |
您最近半年使用:0次
2022-07-21更新
|
1210次组卷
|
70卷引用:2010年河北省正定中学高一第二学期期中考试化学(理)试题
(已下线)2010年河北省正定中学高一第二学期期中考试化学(理)试题(已下线)2010年上海市金山中学高一第二学期阶段质量检测化学试题(已下线)2009-2010学年乐亭一中高一第二学期期中化学试题(已下线)09~10年长沙同升湖实验学校高一下学期期末考试化学卷(已下线)2010年北京市八一中学高一第二学期期末考试化学试卷(已下线)2010年吉林省北师大宁江附中高一下学期期末考试化学试题(已下线)2010-2011学年辽宁省师大附中高一下学期期中考试化学试卷(已下线)2010-2011学年浙江省宁海县正学中学高二下学期第二次阶段性测试化学试卷(已下线)2010-2011学年黑龙江省齐齐哈尔实验中学高一下学期期中考试化学试卷(已下线)2011-2012学年吉林省油田高中高一下学期期中考试化学试卷(已下线)2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(已下线)2011-2012学年湖北省武汉市五校高一下学期期中统考化学试卷(已下线)2012-2013学年河南安阳一中高二月考(奥数班)化学试卷(已下线)2012-2013学年福建福清东张中学高二上学期期中考试理科化学试卷(已下线)2011-2012学年江西上饶中学高一零点、实验班下期末化学试卷(已下线)2013届河北省容城中学高三上学期第三次月考化学试卷(已下线)2013届湖南省五市十校高三第一次联合检测化学试卷(已下线)2012年苏教版高中化学必修2 2.1化学反应速率与反应限度练习卷(已下线)2012年苏教版高中化学选修4 2.1化学反应速率练习卷(已下线)2012-2013学年河北省存瑞中学高一下学期第三次月考化学试卷(已下线)2014年高一化学人教版必修2 模块水平检测2练习卷2014-2015学年四川眉山市高一第二学期期末教学质量检测化学试卷2015-2016学年黑龙江省大庆铁人中学高二上期末化学试卷2015-2016学年浙江省平阳二中高二上学期第一次质检化学试卷2015-2016学年河北省定州中学高二下第一次调研化学试卷2015-2016学年浙江金华、温州、台州部分学校高一下3月联考化学卷2015-2016学年陕西省澄城县寺前中学高一下学期期中考试化学试卷2015-2016学年辽宁省实验中学分校高一下学期6月月考化学试卷2015-2016学年河南省周口市高一下期末化学试卷黑龙江省哈尔滨师大附中2016-2017学年高二10月月考化学卷2016-2017学年贵州省思南中学高二上半期考试化学卷2016-2017学年甘肃省定西市通渭县高二上学期期末化学试卷2017届上海师范大学第二附属中学高三上学期期中考试化学试卷山西省运城市康杰中学2017-2018学年高一下学期期中考试化学试题河南省兰考县第二高级中学2017-2018学年高一下学期期末抽测调研化学试题【全国市级联考】江苏省无锡市普通高中2017-2018学年高一下学期期末考试化学试题(已下线)2018年9月20日 《每日一题》一轮复习-化学反应速率的计算与比较(已下线)2019年3月31日 《每日一题》 必修2 每周一测浙江省丽水四校联考2019年6月高二阶段性考试化学试题广东省佛山市三水区实验中学2018-2019学年高一下学期第三学段考试化学试题陕西省黄陵中学2019-2020学年高二上学期期中考试化学试题内蒙古呼和浩特开来中学2019-2020学年高二上学期期中考试化学试题湖南省益阳市第六中学2018-2019学年高一下学期期中考试化学试题福建省福建师范大学附属中学2019-2020学年高二上学期期中考试化学(学考)试题2019-2020学年新人教版必修2第6章第2节《化学反应的速率与限度》作业吉林省长白朝鲜族自治县实验中学2020-2021学年高二上学期第二次月考化学试题安徽省合肥市第一中学2019—2020学年高一下学期期末考试化学试题黑龙江省绥化市青冈县第一中学2020-2021学年高二上学期10月月考(筑梦班)化学试题黑龙江省青冈县第一中学2020-2021学年高二上学期月考(腾飞班)化学试题辽宁省辽河油田第二高级中学2020-2021学年高二上学期期中考试化学试题高中化学苏教2019版必修第二册-专题6 第一单元综合拔高练人教版2019必修第二册 第六章 第二节 第1课时 化学反应的速率四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题广西柳州市第三中学2021-2022学年高二下学期4月月考化学试题黑龙江省哈尔滨市第三中学校2021-2022学年高一下学期学年期中考试 (学考) 化学试题湖北省黄冈市麻城市第二中学2021-2022学年高一下学期期中考试化学试题江西省九江市2021-2022学年高一下学期期中调研考试化学试题(B卷)辽宁省营口市第二高级中学2021-2022学年高一6月月考化学试题吉林省延边州汪清县第六中学2021-2022学年高一下学期期末考试化学试题山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题苏教2020版选择性必修1专题2第一单元 化学反应速率课后习题陕西省2022-2023学年高二下学期化学学业水平模拟测试(一)辽宁省鞍山市普通高中2022-2023学年高一下学期期中考试化学(A卷)试题陕西省宝鸡市金台区2022-2023学年高一下学期期中质量检测化学试题黑龙江省牡丹江市第二高级中学2022-2023学年高一下学期5月期中考试化学试题新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题第二章 化学反应速率与化学平衡 第一节 化学反应速率 第1课时 化学反应速率河北省武安市第三中学2023-2024学年高二上学期开学考试化学试题新疆阿克苏市实验中学2022-2023学年高一下学期第三次月考化学试题江苏省徐州市沛县湖西中学2023-2024学年高二下学期第一次调研考试化学试题
名校
解题方法
8 . 某化学小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为10mL0.1mol/LKClO3溶液和10mL0.3mol/L NaHSO3溶液,所得数据如图所示。
已知:ClO +3HSO
+3HSO =Cl-+3SO
=Cl-+3SO +3H+。
+3H+。
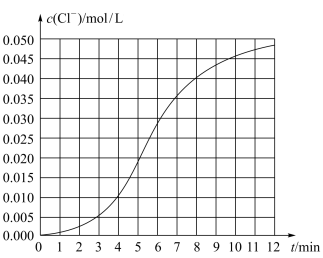
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=____ mol/(L·min)。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大,12min后逐渐变慢(12min后图略)。
i.小组同学针对这一现象进一步通过测定c(Cl-)随时间变化的曲线探究速率先增大的原因,具体如表所示。
①补全方案I中的实验操作:____ 。
②方案II中的假设为____ 。
③除I、II、III中的假设外,还可以提出的假设是____ 。
④在已知方案I的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:____ 。
ii.12min后,化学反应速率变慢的原因是_____ 。
已知:ClO
 +3HSO
+3HSO =Cl-+3SO
=Cl-+3SO +3H+。
+3H+。
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大,12min后逐渐变慢(12min后图略)。
i.小组同学针对这一现象进一步通过测定c(Cl-)随时间变化的曲线探究速率先增大的原因,具体如表所示。
| 方案 | 假设 | 实验操作 |
| I | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液,_____ |
| II | ____ | 取10mL0.1mol/L KClO3溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL0.3mol/LNaHSO3溶液 |
| III | 溶液酸性增强加快了化学反应速率 | 分别向2只烧杯中加入10mL0.1mol/LKClO3溶液;向烧杯①中加入1mL水,向烧杯②中加入1mL0.2mol/L盐酸;再分别向2只烧杯中加入10mL0.3mol/LNaHSO3溶液 |
②方案II中的假设为
③除I、II、III中的假设外,还可以提出的假设是
④在已知方案I的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:
ii.12min后,化学反应速率变慢的原因是
您最近半年使用:0次
2022-06-18更新
|
442次组卷
|
12卷引用:【全国百强校】浙江省余姚中学2018-2019学年高一下学期3月月考化学试题
【全国百强校】浙江省余姚中学2018-2019学年高一下学期3月月考化学试题课时1 化学反应的速率——A学习区 夯实基础(人教版必修2)课时1 化学反应的速率——A学习区 夯实基础(人教版(2019)第二册)必修第二册RJ第6章第二节 化学反应的速率与限度 课时1人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时2 影响化学反应速率的因素河南省洛阳市2020-2021学年高一下学期期中考试化学试题选择性必修1(SJ)专题2第一单元课时2 影响化学反应速率的因素河北省任丘一中2021-2022学年高二上学期阶段考试(一)化学试题贵州省“三新”改革联盟2021-2022学年高一下学期校联考等级考(四)化学试题北京海淀区八一学校2021-2022学年高一下学期6月月考化学试题2019版鲁科化学必修第二册第2章本章自我评价课后习题2.1.2影响化学反应速率的因素 课后
9-10高一下·河北唐山·期中
名校
解题方法
9 . 在一体积固定的密闭容器中加入反应物A、B,发生如下反应:A+2B=3C。反应经2min后,A的浓度从开始时的1.0mol·L-1降到0.8mol·L-1。已知反应开始时B的浓度是1.2mol·L-1。
(1)2min末B、C的浓度____ 。
(2)用A表示该反应2min内的平均速率____ 。
(1)2min末B、C的浓度
(2)用A表示该反应2min内的平均速率
您最近半年使用:0次
2022-02-10更新
|
732次组卷
|
7卷引用:2009---2010学年唐山二中高一第二学期期中化学试卷
(已下线)2009---2010学年唐山二中高一第二学期期中化学试卷(已下线)2011-2012学年广东省梅州市曾宪梓中学高一5月月考化学试卷陕西省西安中学2019-2020学年高一下学期期中考试(平行班)化学试题(已下线)6.1.1 化学反应速率-2021-2022学年高一化学10分钟课前预习练(苏教版2019必修第二册)江苏省扬州市江都区邵伯高级中学2020-2021学年高一下学期期中考试化学试题苏教2020版化学必修第二册专题6第一单元 化学反应速率与反应限度课后习题福建省福州市福清市虞阳中学2022-2023学年下学期高一年第一次月考化学试卷
10 . 在一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化的曲线如下图所示。下列有关说法正确的是
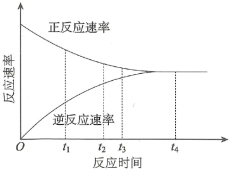

| A.t1时刻,反应逆向进行 | B.t2时刻,正反应速率大于逆反应速率 |
| C.t3时刻,达到反应进行的限度 | D.t4时刻,反应处于平衡状态 |
您最近半年使用:0次



