某小组同学查到一份研究过氧化氢溶液与氢碘酸( )反应的实验资料,具体如下。
)反应的实验资料,具体如下。
资料1:室温下,过氧化氢溶液可与氢碘酸反应: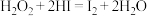
资料2:碘单质溶于水后,溶液为棕黄色。
资料3:实验数据如表所示。
(1)通过资料了中的数据,可以得出的结论是_______ 。
(2)资料3中编号为1的实验继续反应,20s后测得过氧化氢浓度为 ,则
,则
_______ 。
(3)该小组同学欲用碘化钾替代氢碘酸验证上述实验。在实验过程中,未观察到溶液变为棕黄色,却观察到有无色气体产生。于是,该小组同学提出假设: 可能是过氧化氢分解反应的催化剂。
可能是过氧化氢分解反应的催化剂。
①小组同学提出上述假设的依据是_______ 。
②请设计实验方案验证假设: 可能是过氧化氢分解反应的催化剂。(仪器和试剂可自选)
可能是过氧化氢分解反应的催化剂。(仪器和试剂可自选)
实验方案:_______ 。
(4)某研究人员通过研究得到以下两组数据( 为反应的活化能)。
为反应的活化能)。
第1组:
第2组:
结合第1组和第2组数据,你认为他所研究的问题是_______ 。
 )反应的实验资料,具体如下。
)反应的实验资料,具体如下。资料1:室温下,过氧化氢溶液可与氢碘酸反应:
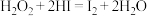
资料2:碘单质溶于水后,溶液为棕黄色。
资料3:实验数据如表所示。
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
 | 0.1 | 0.1 | 0.1 | 0.2 | 0.3 |
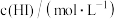 | 0.1 | 0.2 | 0.3 | 0.1 | 0.1 |
| 从混合到出现棕黄色时间/s | 13 | 6.5 | 4.3 | 6.6 | 4.4 |
(2)资料3中编号为1的实验继续反应,20s后测得过氧化氢浓度为
 ,则
,则
(3)该小组同学欲用碘化钾替代氢碘酸验证上述实验。在实验过程中,未观察到溶液变为棕黄色,却观察到有无色气体产生。于是,该小组同学提出假设:
 可能是过氧化氢分解反应的催化剂。
可能是过氧化氢分解反应的催化剂。①小组同学提出上述假设的依据是
②请设计实验方案验证假设:
 可能是过氧化氢分解反应的催化剂。(仪器和试剂可自选)
可能是过氧化氢分解反应的催化剂。(仪器和试剂可自选)实验方案:
(4)某研究人员通过研究得到以下两组数据(
 为反应的活化能)。
为反应的活化能)。第1组:
| 反应 | 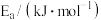 |  | 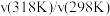 |
| A | 100 | 298→318 | 14.0 |
| 反应 | 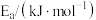 |  |
| A | 100 | 3205 |
| B | 120 |
更新时间:2022-11-26 17:57:01
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】Ⅰ.某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。

根据图中数据填空:
(1)该反应的化学方程式为___________ 。
(2)反应开始至 ,以气体X表示的平均反应速率为
,以气体X表示的平均反应速率为___________ ,反应开始时与反应达平衡状态时的压强之比为___________ 。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中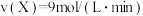 ,乙中
,乙中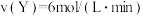 ,则
,则___________ (填“甲”或“乙”)中反应更快。
Ⅱ.某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题:
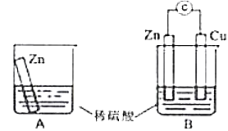
(4)B中 板上观察到的现象是
板上观察到的现象是___________ , 板上发生的电极反应式为
板上发生的电极反应式为___________ 。
(5)从能量转化的角度来看,能设计成原电池的反应通常是放热反应。下列化学反应理论上可以设计成原电池的是___________ (填标号)。
A.铝片与稀 反应制取
反应制取
B.碳酸钙高温分解成氧化钙和二氧化碳
C. 固体反应
固体反应
D.氢氧化钾和硫酸中和

根据图中数据填空:
(1)该反应的化学方程式为
(2)反应开始至
 ,以气体X表示的平均反应速率为
,以气体X表示的平均反应速率为(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中
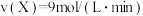 ,乙中
,乙中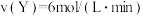 ,则
,则Ⅱ.某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题:

(4)B中
 板上观察到的现象是
板上观察到的现象是 板上发生的电极反应式为
板上发生的电极反应式为(5)从能量转化的角度来看,能设计成原电池的反应通常是放热反应。下列化学反应理论上可以设计成原电池的是
A.铝片与稀
 反应制取
反应制取
B.碳酸钙高温分解成氧化钙和二氧化碳
C.
 固体反应
固体反应D.氢氧化钾和硫酸中和
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐2】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示 已知A、B、C均为气体
已知A、B、C均为气体 。
。
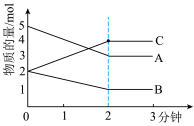
(1)该反应的化学方程式为_______________ 。
(2)反应开始至2分钟时,B的平均反应速率为_______________ 。
(3)能说明该反应已达到平衡状态的是_______________ 。
A.v(A)=2v(B)
B.容器内气体密度不变
C.v逆(A)=v正(C)
D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______________ 。
(5)下表是该小组研究影响过氧化氢H2O2分解速率的因素时采集的一组数据:用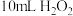 制取
制取 所需的时间
所需的时间 秒
秒
①该研究小组在设计方案时。考虑了浓度、_______________ 、_______________ 等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?_______________ 。
(6)将质量相同但聚集状态不同的 分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定结果如下:
分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定结果如下:
①写出 发生分解的化学反应方程式
发生分解的化学反应方程式_______________ 。
②实验结果说明催化剂作用的大小与_______________ 有关。
 已知A、B、C均为气体
已知A、B、C均为气体 。
。 
(1)该反应的化学方程式为
(2)反应开始至2分钟时,B的平均反应速率为
(3)能说明该反应已达到平衡状态的是
A.v(A)=2v(B)
B.容器内气体密度不变
C.v逆(A)=v正(C)
D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为
(5)下表是该小组研究影响过氧化氢H2O2分解速率的因素时采集的一组数据:用
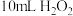 制取
制取 所需的时间
所需的时间 秒
秒
| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360s | 480s | 540s | 720s |
| MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
①该研究小组在设计方案时。考虑了浓度、
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
(6)将质量相同但聚集状态不同的
 分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定结果如下:
分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定结果如下:催化剂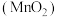 | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出
 发生分解的化学反应方程式
发生分解的化学反应方程式②实验结果说明催化剂作用的大小与
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】已知在一容积恒定的密闭容器中发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,该反应达到平衡后,测得相关数据如下:
CO2(g)+H2(g) ΔH<0,该反应达到平衡后,测得相关数据如下:
(1)实验1中,10h后达到平衡,H2的平均反应速率为_______ mol·L-1h-1,该反应的平衡常数为_______ ,在此平衡体系中再加入0.5mol CO(g)和0.5mol H2(g),平衡_______ 移动(填“正向”、“逆向”或“不”)。
(2)实验2中X的值_______(填序号)。
(3)实验3中Y的值为_______ 。
 CO2(g)+H2(g) ΔH<0,该反应达到平衡后,测得相关数据如下:
CO2(g)+H2(g) ΔH<0,该反应达到平衡后,测得相关数据如下:| 实验序号 | 温度/℃ | 初始CO浓度/(mol·L-1) | 初始H2O浓度/(mol·L-1) | CO的平衡转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | X |
| 3 | 110 | 0.8 | Y | 60% |
(1)实验1中,10h后达到平衡,H2的平均反应速率为
(2)实验2中X的值_______(填序号)。
| A.等于50% | B.大于50% | C.小于50% | D.无法确定 |
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】(1)课本设计了如图一所示实验,其目的是通过比较H2O2的分解速率来比较______ ,可通过观察______ 来定性比较。有同学提出将CuSO4改为CuCl2更为合理,其理由是______ 。

(2)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______ 的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是______
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰

(2)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
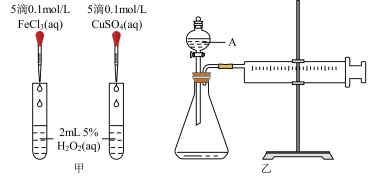
(1)定性分析:如图甲可通过观察___________ ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___________ 。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为___________ ,检查该装置气密性的方法是___________ ,实验中需要测量的数据是___________ 。
(3)加入0.10molMnO2粉末于50mLH2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。

①写出H2O2在二氧化锰作用下发生反应的化学方程式___________ 。
②实验时放出气体的总体积是___________ mL。
③放出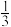 气体所需时间为
气体所需时间为___________ min。
④反应放出 气体所需时间约为
气体所需时间约为___________ min。
⑤A、B、C、D各点反应速率快慢的顺序为___________ 。
⑥解释反应速率变化的原因___________ 。
⑦计算H2O2的初始物质的量浓度___________ 。(请保留两位有效数字)

(1)定性分析:如图甲可通过观察
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为
(3)加入0.10molMnO2粉末于50mLH2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。

①写出H2O2在二氧化锰作用下发生反应的化学方程式
②实验时放出气体的总体积是
③放出
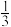 气体所需时间为
气体所需时间为④反应放出
 气体所需时间约为
气体所需时间约为⑤A、B、C、D各点反应速率快慢的顺序为
⑥解释反应速率变化的原因
⑦计算H2O2的初始物质的量浓度
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐3】草酸(H2C2O4)是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性KMnO4溶液发生反应:5H2C2O4+2MnO +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。
(1)探究外界条件对反应速率的影响。
①完成此实验设计,其中:V1=_____ ,V2=_____ 。
②对比实验1、2可探究_____ 对反应速率的影响。
③已知Mn2+对H2C2O4和KMnO4溶液的反应有催化作用,请设计实验4证明_____ 。
(2)某兴趣小组用草酸及草酸盐的性质测定硬水中钙离子的浓度。
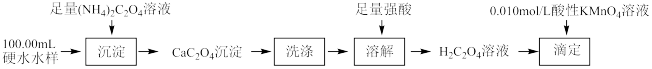
根据消耗酸性KMnO4标准溶液的体积即可测定硬水样品中Ca2+的浓度。
①实验过程提及的下列仪器,在使用之前一定要润洗的是_____ (填字母)。
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②滴定过程中______ (填“需要”或“不需要”)另加指示剂,如何判断滴定终点_____ 。
③本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的KMnO4标准溶液为_____ mL。该硬水样品中Ca2+的浓度为_____ mol∙L−1。

④下列不当操作会使测得的硬水样品Ca2+的浓度偏高的是_____ (填字母)。
A.滴定管未用标准溶液润洗 B.草酸钙(H2C2O4)沉淀洗涤不充分
C.滴定前仰视读数并记录数据 D.盛放草酸溶液的锥形瓶没有干燥
 +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。(1)探究外界条件对反应速率的影响。
| 实验编号 | 所加试剂及用量/mL | 条件 | 溶液颜色褪至无色所需时间/min | |||
| 0.01 mol∙L−1H2C2O4溶液 | 0.01 mol∙L−1KMnO4溶液 | 3.0 mol∙L−1稀H2SO4 | 水 | 温度℃ | ||
| 1 | 12.0 | 2.0 | 3.0 | 3.0 | 20 | t1 |
| 2 | 6.0 | 2.0 | 3.0 | V1 | 20 | t2 |
| 3 | V2 | 2.0 | 3.0 | 9.0 | 30 | t3 |
②对比实验1、2可探究
③已知Mn2+对H2C2O4和KMnO4溶液的反应有催化作用,请设计实验4证明
(2)某兴趣小组用草酸及草酸盐的性质测定硬水中钙离子的浓度。

根据消耗酸性KMnO4标准溶液的体积即可测定硬水样品中Ca2+的浓度。
①实验过程提及的下列仪器,在使用之前一定要润洗的是
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②滴定过程中
③本实验滴定管起点和终点的液面位置如图所示,则滴定过程中消耗的KMnO4标准溶液为

④下列不当操作会使测得的硬水样品Ca2+的浓度偏高的是
A.滴定管未用标准溶液润洗 B.草酸钙(H2C2O4)沉淀洗涤不充分
C.滴定前仰视读数并记录数据 D.盛放草酸溶液的锥形瓶没有干燥
您最近一年使用:0次



