名校
解题方法
1 . 某小组利用H2C2O4溶液与用硫酸酸化的KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
(1)该实验是通过___ 来判断反应的快慢。
(2)已知H2C2O4被KMnO4(H+)氧化为CO2逸出,该反应的化学方程式为___ ,为了观察到实验现象从而判断反应的快慢,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)≥___ 。
(3)探究温度对化学反应速率影响的实验编号是__ 和__ (填编号,下同),可探究H2C2O4浓度对化学反应速率影响的实验编号是__ 和__ 。
(4)实验①测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__ 。
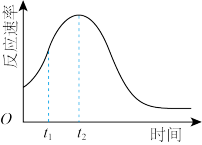
(5)该小组发现室温下反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:___ ,若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是___ (填序号)
A.硫酸钾 B.硫酸锰 C.稀硫酸 D.氯化锰
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 蒸馏水 体积/ml | 温度/℃ | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | |||
| ① | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 25 |
| ② | 0.50 | a | 0.010 | 4.0 | c | 25 |
| ③ | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 50 |
(2)已知H2C2O4被KMnO4(H+)氧化为CO2逸出,该反应的化学方程式为
(3)探究温度对化学反应速率影响的实验编号是
(4)实验①测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
(5)该小组发现室温下反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:
A.硫酸钾 B.硫酸锰 C.稀硫酸 D.氯化锰

您最近一年使用:0次
2018高三上·全国·专题练习
2 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
(1)通过实验A、B,可探究出_____ (填外部因素)的改变对反应速率的影响,其中V1=_____ ,T1=______ ;通过实验________ 可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由此实验可以得出的结论是_________ ;利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=______ 。
(3)该反应中有无色无味气体产生且锰被还原为Mn2+,写出相应反应的离子方程式__________ 。

(4)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并认为造成此种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊的作用,则该作用是___________ ,相应的粒子最可能是(填序号)______ 。
| 实验 序号 | 实验温 度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶 液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(2)若t1<8,则由此实验可以得出的结论是
(3)该反应中有无色无味气体产生且锰被还原为Mn2+,写出相应反应的离子方程式

(4)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并认为造成此种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊的作用,则该作用是
您最近一年使用:0次
2018-09-21更新
|
646次组卷
|
5卷引用:2018年9月21日《每日一题》一轮复习- 影响化学反应速率的因素
(已下线)2018年9月21日《每日一题》一轮复习- 影响化学反应速率的因素步步为赢 高二化学暑假作业:作业九 化学反应速率和化学平衡(已下线)第17天 对化学反应速率的理解——《2019年暑假作业总动员》高二化学山西省祁县第二中学2019-2020学年高二10月月考化学试题高中化学苏教2019版必修第二册-专题6 本专题达标检测
名校
3 . 利用下列实验装置能完成相应实验的是
A. 该装置(秒表未画出)测定化学反应速率 该装置(秒表未画出)测定化学反应速率 |
B. 该装置制取HCl并吸收尾气 该装置制取HCl并吸收尾气 |
C. 该装置制备纯净的NH3 该装置制备纯净的NH3 |
D.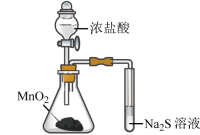 该装置比较MnO2、Cl2、S的氧化性 该装置比较MnO2、Cl2、S的氧化性 |
您最近一年使用:0次
2020-02-19更新
|
262次组卷
|
7卷引用:2020届高三化学实验复习——化学实验基本操作【选择突破】
2020届高三化学实验复习——化学实验基本操作【选择突破】(已下线)考点20 化学实验基础知识-2020年高考化学命题预测与模拟试题分类精编(已下线)热点题型特训 实验设计中装置使用的评价分析安徽省安庆市2020届高三上学期期末教学质量监测化学试题安徽省宣城市六校2021-2022学年高二上学期期中联考化学试题安徽省南陵中学2021-2022学年高二上学期9月月考化学试题安徽省亳州市涡阳县第二中学2022-2023学年高二上学期教学检测化学试题
解题方法
4 . 将0.48g镁粉分别加入10.0mL下列溶液,反应6小时,用排水法收集产生的气体,溶液组成与H2体积(已换算成标准状况)的关系如下表。下列说法不正确的是
| 实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 溶液组成 | H2O | 1.0mol/L NH4Cl | 0.1mol/L NH4Cl | 1.0mol/L NaCl | 1.0mol/L NaNO3 | 0.8mol/L NH4Cl+ 0.2mol/L NH3·H2O | 0.2mol/L NH4Cl+ 0.8mol/L NH3·H2O |
| V/ml | 12 | 433 | 347 | 160 | 14 | 401 | 349 |
A.由实验2、3可得, 浓度越大,镁和水反应速率越快 浓度越大,镁和水反应速率越快 |
| B.由实验1、4、5可得,Cl-对镁和水的反应有催化作用 |
| C.由实验3、7可得,反应过程产生的Mg(OH)2覆盖在镁表面,减慢反应 |
D.无论酸性条件还是碱性条件, 都能加快镁和水的反应 都能加快镁和水的反应 |
您最近一年使用:0次
2020-01-29更新
|
273次组卷
|
3卷引用:第15讲 化学反应速率-2021年高考化学一轮复习名师精讲练
名校
解题方法
5 . 用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如表,(KMnO4溶液用稀硫酸酸化),实验装置如下图:

(1)该反应的化学方程式为_______
(2)该实验探究的是_______ 因素对化学反应速率的影响。
(3)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末, =
=_______  。(假设混合溶液体积为50mL)
。(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定_______ 来比较化学反应速率。(一条即可)
(5)小组同学发现反应速率随时间的变化如下图所示,其中t1~t2时间内速率变快的主要原因可能是:①_______ ;②_______ 。


| 实验序号 | A溶液 | B溶液 |
| ① | 20mL0.1 H2C2O4溶液 H2C2O4溶液 | 30mL0.0l KMnO4溶液 KMnO4溶液 |
| ② | 20mL0.2 H2C2O4溶液 H2C2O4溶液 | 30mL0.01 KMnO4溶液 KMnO4溶液 |
(1)该反应的化学方程式为
(2)该实验探究的是
(3)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,
 =
= 。(假设混合溶液体积为50mL)
。(假设混合溶液体积为50mL)(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定
(5)小组同学发现反应速率随时间的变化如下图所示,其中t1~t2时间内速率变快的主要原因可能是:①

您最近一年使用:0次
名校
解题方法
6 . Ⅰ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
(1)该实验探究的是___ (因素)对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___ (填实验序号)。
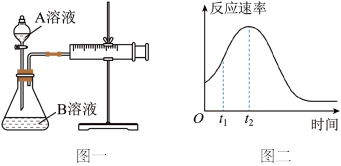
(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO )=
)=___ mol·L-1(假设混合液体积为50mL)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定___ 来比较化学反应速率。
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂②___ 。
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)ΔH=-QkJ·mol-1。
2NH3(g)ΔH=-QkJ·mol-1。
(1)下列有关描述正确的有___ 。
A.当容器内的压强不变时,该反应已达平衡
B.当反应达平衡时,向容器中充入1molHe,反应速率会加快
C.若充入2molNH3(g),充分反应后吸热QkJ
D.常温常压,氨气和水700:1(体积比)溶解,原因之一是氨气和水分子之间可形成氢键
(2)若起始时向容器中充入10mol·L-1的N2和15mol·L-1的H2,10min时测得容器内NH3的浓度为1.5mol·L-1。10min内用N2表示的反应速率为___ ;此时H2的转化率为___ 。
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):| 实验序号 | A溶液 | B溶液 |
| ① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.1mol·L-1KMnO4溶液 |
| ② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.1mol·L-1KMnO4溶液 |

(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO
 )=
)=(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂②
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g)
 2NH3(g)ΔH=-QkJ·mol-1。
2NH3(g)ΔH=-QkJ·mol-1。(1)下列有关描述正确的有
A.当容器内的压强不变时,该反应已达平衡
B.当反应达平衡时,向容器中充入1molHe,反应速率会加快
C.若充入2molNH3(g),充分反应后吸热QkJ
D.常温常压,氨气和水700:1(体积比)溶解,原因之一是氨气和水分子之间可形成氢键
(2)若起始时向容器中充入10mol·L-1的N2和15mol·L-1的H2,10min时测得容器内NH3的浓度为1.5mol·L-1。10min内用N2表示的反应速率为
您最近一年使用:0次
7 . 某同学为探究浓度对化学反应速率的影响,设计以下实验。
下列说法错误的是
| ① | ② | ③ | ④ | |
| 试剂a | 1mL0.01mol/L酸性高锰酸钾水溶液 | 1mL0.01mol/L酸性高锰酸钾水溶液 | 1mL0.01mol/L酸性高锰酸钾水溶液 | 1mL0.01mol/L酸性高锰酸钾水溶液 |
| 试剂b | 2mL0.1mol/LH2C2O4水溶液 | 2mL0.2mol/LH2C2O4水溶液 | 1mL0.2mol/LH2C2O4水溶液 | 1mL以浓盐酸为溶剂配制的0.2mol/LH2C2O4水溶液 |
| 褪色时间 | 690s | 677s | 600s |
| A.对比实验①、②可知,H2C2O4水溶液浓度增大,反应速率加快 |
| B.对比实验②、③可知,酸性高锰酸钾水溶液浓度增大,反应速率加快 |
| C.为验证H+浓度对反应速率的影响,设计实验④并与③对照 |
D.实验③的离子方程式为2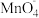 +6H++5H2C2O4=2Mn2++10CO2↑+8H2O +6H++5H2C2O4=2Mn2++10CO2↑+8H2O |
您最近一年使用:0次
2021-05-13更新
|
1125次组卷
|
5卷引用:第20讲 化学反应速率(精讲)-2022年一轮复习讲练测
(已下线)第20讲 化学反应速率(精讲)-2022年一轮复习讲练测(已下线)专题09 反应速率、化学平衡-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)第20讲 化学反应速率(讲)-2023年高考化学一轮复习讲练测(全国通用)山东省滨州市2021届高三第二次模拟考试化学试题辽宁省抚顺市重点高中2020-2021学年高一下学期期末考试化学试题
名校
解题方法
8 . 某小组利用H2C2O4溶液和酸性KMnO4溶液(H2SO4酸化)反应来探究“外界条件对化学反应速率的影响”。该小组欲通过测定单位时间内生成CO2的体积来判断反应的快慢。设计实验方案如下:
(1)已知反应后H2C2O4转化为CO2逸出, 转化为Mn2+,写出该反应的离子方程式
转化为Mn2+,写出该反应的离子方程式______________ ;每消耗1 molH2C2O4,则反应中转移________________ mol电子。
(2)探究浓度对化学反应速率影响的实验编号是_________ ,实验②、③探究_________ 对化学反应速率影响。本实验还可通过测定____________ 来比较化学反应速率。
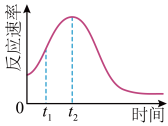
(3)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:a、该反应放热,使体系温度升高;b、____________ 。
(4)若实验①在5 min末收集49.0 mLCO2气体,则在5 min末,c( )=
)=_______ mol•L-1。(已知25℃时,气体摩尔体积Vm=24.5 L• mol-1)
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
| ① | 0.10 | 20 | 0.10 | 30 | 25 |
| ② | 0.20 | 20 | 0.10 | 30 | 25 |
| ③ | 0.20 | 20 | 0.10 | 30 | 50 |
 转化为Mn2+,写出该反应的离子方程式
转化为Mn2+,写出该反应的离子方程式(2)探究浓度对化学反应速率影响的实验编号是
(3)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:a、该反应放热,使体系温度升高;b、

(4)若实验①在5 min末收集49.0 mLCO2气体,则在5 min末,c(
 )=
)=
您最近一年使用:0次
2020-12-02更新
|
596次组卷
|
3卷引用:第06讲 影响化学反应速率的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
(已下线)第06讲 影响化学反应速率的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)四川省绵阳东辰国际学校2020-2021学年高二上学期期中考试化学试题第二章 第一节 化学反应速率 第2课时 影响化学反应速率的因素 活化能
2019高二上·全国·专题练习
9 . 某研究小组拟用定量的方法探究双氧水分解生成O2的快慢,设计了如图1所示装置。在锥形瓶中放入0.1 mol MnO2粉末,用分液漏斗向锥形瓶中加入一定量双氧水,放出气体的体积和时间的关系如图2所示:(已知该反应是放热反应,实验是在标准状况下进行的)

(1)在1~4 min内,反应中生成氧气的平均反应速率为________ mL·min−1。
(2)A、B、C、D各点反应速率由快到慢的顺序为________ 。
(3)出现上述变化的原因是_____________ 。
(4)下列有关该实验的注意事项,你认为有必要的是________ (填代号)。
A 严格来说,测定气体体积时必须排除加入的双氧水的体积
B 读取量筒中液体体积时,必须使气体温度恢复至标准状况
C 乙瓶中必须装满水,不能留有空隙
D 实验结束时,导管末端必须浸在液面下

(1)在1~4 min内,反应中生成氧气的平均反应速率为
(2)A、B、C、D各点反应速率由快到慢的顺序为
(3)出现上述变化的原因是
(4)下列有关该实验的注意事项,你认为有必要的是
A 严格来说,测定气体体积时必须排除加入的双氧水的体积
B 读取量筒中液体体积时,必须使气体温度恢复至标准状况
C 乙瓶中必须装满水,不能留有空隙
D 实验结束时,导管末端必须浸在液面下
您最近一年使用:0次
10 . 某化学小组欲测定酸性条件下 溶液与
溶液与 溶液反应的化学反应速率,所用的试剂为
溶液反应的化学反应速率,所用的试剂为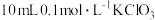 溶液和
溶液和 溶液,所得
溶液,所得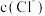 随时间变化的曲线如图所示
随时间变化的曲线如图所示

(1)根据实验数据可知,该反应在 内的平均反应速率
内的平均反应速率
________  。
。
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。
ⅰ.探究化学反应速率增大的影响因素:
已知:
问题与思考:
①方案Ⅲ烧杯①中加入 水的作用是
水的作用是________ 。
②在证明方案Ⅰ假设不成立的情况下,从控制变量角度思考,方案Ⅲ实验操作设计不严谨,改进措施为________________________________________________ 。
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设:________________________________ 。
ⅱ.反应后期,化学反应速率降低的主要原因是________________________________________________ 。
 溶液与
溶液与 溶液反应的化学反应速率,所用的试剂为
溶液反应的化学反应速率,所用的试剂为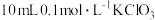 溶液和
溶液和 溶液,所得
溶液,所得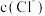 随时间变化的曲线如图所示
随时间变化的曲线如图所示
(1)根据实验数据可知,该反应在
 内的平均反应速率
内的平均反应速率
 。
。(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。
ⅰ.探究化学反应速率增大的影响因素:
已知:

方案 | 假设 | 具体实验操作 |
Ⅰ | 该反应放热使溶液温度升高,反应速率加快 | 向烧杯中依次加入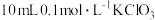 溶液和 溶液和 溶液, 溶液, |
Ⅱ | 反应产物 对反应有催化作用 对反应有催化作用 | 取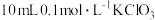 溶液于烧杯中,先加入 溶液于烧杯中,先加入 溶液 溶液 |
Ⅲ | 反应中溶液酸性增强,加快了化学反应速率 | 分别向2个烧杯中加入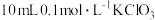 溶液,烧杯①中加入 溶液,烧杯①中加入 水,烧杯②中加入 水,烧杯②中加入 盐酸,再分别向烧杯中加入 盐酸,再分别向烧杯中加入 溶液 溶液 |
问题与思考:
①方案Ⅲ烧杯①中加入
 水的作用是
水的作用是②在证明方案Ⅰ假设不成立的情况下,从控制变量角度思考,方案Ⅲ实验操作设计不严谨,改进措施为
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设:
ⅱ.反应后期,化学反应速率降低的主要原因是
您最近一年使用:0次
2020-09-14更新
|
515次组卷
|
6卷引用:《新教材变化解读及考法剖析 》—第六章 化学反应与能量(人教版2019必修第二册)
(已下线)《新教材变化解读及考法剖析 》—第六章 化学反应与能量(人教版2019必修第二册)湖北省荆州中学、宜昌一中等“荆、荆、襄、宜四地七校2019-2020学年高二11月联考化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第3节 化学反应的速率 课时2 影响化学反应速率的因素高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时3 影响化学反应速率的因素综合分析(已下线)期中01-2020-2021学年高一化学章末集训必刷卷(人教版2019必修第二册)选择性必修1 专题2 第一单元 课时3 影响化学反应速率的因素综合分析



