解题方法
1 . 某化学课外小组的同学,通过实验室制备铁和稀盐酸的反应探究外界条件对化学反应速率的影响,下表是实验过程中的数据及相关信息:
(注:气体体积均在相同条件下测得)
(1)实验①和②表明,________ 对反应速率有影响;实验①和③表明________ 对反应速率的影响。
(2)实验室在制氢气时,可在锌和盐酸反应的容器中加入少量硫酸铜固体,原因是________ 。(用文字表达)
(3)若四组实验均反应进行1分钟(铁有剩余),则以上实验需要测出的数据是________ 。
序号 | 反应温度/℃ | c(HCl)/(mol·L-1) | V(HCl)/mL | 10 g Fe的形状 | t/min |
① | 20 | 2 | 10 | 块状 | 1 |
② | 20 | 4 | 10 | 块状 | 1 |
③ | 20 | 2 | 10 | 粉末 | 1 |
④ | 40 | 2 | 10 | 粉末 | 1 |
⑤ | 40 | 4 | 10 | 粉末 | 1 |
(1)实验①和②表明,
(2)实验室在制氢气时,可在锌和盐酸反应的容器中加入少量硫酸铜固体,原因是
(3)若四组实验均反应进行1分钟(铁有剩余),则以上实验需要测出的数据是
您最近一年使用:0次
名校
2 . 回答下列问题
(1)甲烷可以和氯气在光照条件下发生反应,反应类型为:_____ ,产物之一CCl4的空间构型为:________ 。
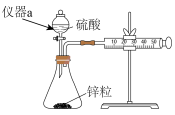
(2)比较锌粒与不同浓度硫酸反应时的速率,可通过如下装置,测定收集等体积H2需要的时间来实现。该实验装置在加入试剂前需进行__________ ,该装置中仪器a的名称:__________ 。
(3)在酸性KMnO4与H2C2O4(草酸,一种弱酸)反应时,可通过测定褪色时间来确定反应速率,请写出该反应的离子方程式:_________________ 。
(4)在地壳内SiO2和HF存在以下平衡: SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) ,若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为
SiF4(g)+ 2H2O(g) ,若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为_________ mol·Lˉ1·minˉ1。
(1)甲烷可以和氯气在光照条件下发生反应,反应类型为:
(2)比较锌粒与不同浓度硫酸反应时的速率,可通过如下装置,测定收集等体积H2需要的时间来实现。该实验装置在加入试剂前需进行

(3)在酸性KMnO4与H2C2O4(草酸,一种弱酸)反应时,可通过测定褪色时间来确定反应速率,请写出该反应的离子方程式:
(4)在地壳内SiO2和HF存在以下平衡: SiO2(s) +4HF(g)
 SiF4(g)+ 2H2O(g) ,若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为
SiF4(g)+ 2H2O(g) ,若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为
您最近一年使用:0次
2022高二·上海·专题练习
名校
3 . 图1实验装置用于测定锌与稀硫酸反应的速率。 _______ 。
(2)分别取2 g颗粒大小相同的锌粒分别与体积均为40 mL的1 mol·L-1硫酸、4 mol·L-1硫酸反应,收集25 mL H2时所需时间后者比前者_______ 。 填“长”或“短”
填“长”或“短”
(3)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
b. 在锥形瓶中加入40 mL的1 mol·L-1硫酸;
c. 塞好橡胶塞,_______ 时立即用秒表计时;
d. 注射器内每增加5mL气体时读取一次秒表。
(4)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是_______ ,反应进行一定时间后速率逐渐减慢,原因是_______ 。
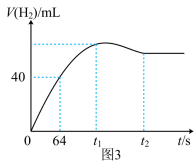
(5)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是_______ ;在64 s内用H+浓度表示的平均反应速率v(H+) = _______ (此时,溶液体积仍为40 mL,气体摩尔体积为25 L·mol-1)。

(2)分别取2 g颗粒大小相同的锌粒分别与体积均为40 mL的1 mol·L-1硫酸、4 mol·L-1硫酸反应,收集25 mL H2时所需时间后者比前者
 填“长”或“短”
填“长”或“短”
(3)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
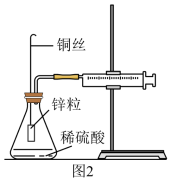
b. 在锥形瓶中加入40 mL的1 mol·L-1硫酸;
c. 塞好橡胶塞,
d. 注射器内每增加5mL气体时读取一次秒表。
(4)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是
(5)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是
您最近一年使用:0次
2022-09-28更新
|
273次组卷
|
4卷引用:2.3.1 化学反应速率的概念和测定-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修1)
(已下线)2.3.1 化学反应速率的概念和测定-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修1)湖南省邵阳市武冈市2022-2023学年高二上学期期中考试化学试题(已下线)实验02 定性与定量研究影响化学反应速率的因素-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)宁夏石嘴山市平罗中学2023-2024学年高二下学期4月月考化学试题
4 . 化学反应速率的测定
(1)测定原理
利用与化学反应中任何一种化学物质的_______ 相关的可观测量进行测定。
(2)测定方法
①直接观察测定:如_______ 和_______ 等。
②科学仪器测定:如反应体系颜色的变化。在溶液中,当反应物或生成物本身有较明显的颜色时,可利用_______ 和_______ 间的比例关系来跟踪反应的过程和测量反应速率。
(1)测定原理
利用与化学反应中任何一种化学物质的
(2)测定方法
①直接观察测定:如
②科学仪器测定:如反应体系颜色的变化。在溶液中,当反应物或生成物本身有较明显的颜色时,可利用
您最近一年使用:0次
2021-09-03更新
|
502次组卷
|
3卷引用:课前-2.1.1 化学反应速率-课前、课中、课后(人教版2019选择性必修1)
课前-2.1.1 化学反应速率-课前、课中、课后(人教版2019选择性必修1)6.1.1化学反应速率(课前)-2019苏教版必修2课前课中课后(已下线)【知识图鉴】单元讲练测选择性必修1第2单元01讲核心
名校
解题方法
5 . I.硫代硫酸钠与稀硫酸反应的方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O某学习小组为研究反应物浓度和温度对该反应速率的影响,设计以下3组实验,回答下列问题
(1)该反应所需的仪器有:量筒、烧杯、试管、胶头滴管、秒表、___________
(2)通过记录___________ 可以比较反应的快慢
(3)对比实验Ⅱ、Ⅲ研究温度对该反应速率的影响,则y=___________
(4)对比实验___________ (填实验序号)研究c(H+)对该反应速率的影响,则x=___________
Ⅱ.在如图所示的恒温密闭容器中加入2molX和2molY,发生如下反应并达到平衡(Y状态未知): 2X(s)+Y(?) aZ(g)。起始时容器的体积为VL,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为VL。
aZ(g)。起始时容器的体积为VL,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为VL。

请回答下列问题:
(1)a=___________ ;Y的状态为___________ (填“气态”或“非气态)
(2)平衡时Y的转化率=___________
(3)下列叙述中,能说明上述反应达到平衡状态的是___________ (填编号)
a.气体总物质的量不变 b.单位时间内消耗1molY,同时生成amolZ
c.气体的平均摩尔质量保持不变 d.X和Y的物质的量之比保持不变
| 实验序号 | 反应温度 | Na2S2O3溶液 | 稀硫酸 | H2O | 产生沉淀时间 | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | |||
| I | 25 | 5 | 0.2 | 10 | 0.1 | x | t1 |
| II | 25 | 10 | 0.1 | 10 | 0.2 | 5 | t2 |
| III | 35 | 10 | 0.1 | 5 | y | 10 | t3 |
(1)该反应所需的仪器有:量筒、烧杯、试管、胶头滴管、秒表、
(2)通过记录
(3)对比实验Ⅱ、Ⅲ研究温度对该反应速率的影响,则y=
(4)对比实验
Ⅱ.在如图所示的恒温密闭容器中加入2molX和2molY,发生如下反应并达到平衡(Y状态未知): 2X(s)+Y(?)
 aZ(g)。起始时容器的体积为VL,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为VL。
aZ(g)。起始时容器的体积为VL,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为VL。
请回答下列问题:
(1)a=
(2)平衡时Y的转化率=
(3)下列叙述中,能说明上述反应达到平衡状态的是
a.气体总物质的量不变 b.单位时间内消耗1molY,同时生成amolZ
c.气体的平均摩尔质量保持不变 d.X和Y的物质的量之比保持不变
您最近一年使用:0次
2021-07-02更新
|
265次组卷
|
2卷引用:江西省南昌市进贤县第一中学2020-2021学年高一下学期期末考试化学试题
解题方法
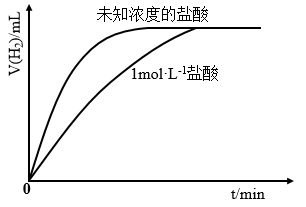
6 . 甲同学用等质量的锌粉分别与 盐酸及相同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出
盐酸及相同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出 的体积随反应时间的变化曲线,如图。
的体积随反应时间的变化曲线,如图。
(1)根据图示可判断,甲同学所用未知浓度的盐酸的浓度比
___________ (填“大”或“小”),理由是___________ 。
(2)乙同学为控制反应速率,防止因反应过快而难以测量 体积,且不改变生成
体积,且不改变生成 的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是
的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是___________ 。
A.蒸馏水 B.KCl溶液 C. 溶液 D.
溶液 D. 溶液
溶液
(3)丙同学用 硫酸代替上述实验中的
硫酸代替上述实验中的 盐酸,二者的反应速率是否相同
盐酸,二者的反应速率是否相同___________ (填“相同”或“不相同”),理由是___________ 。
(4)如果图中22.4mL是在标准状况下测得的气体体积,则在该过程中转移电子的电量是___________ (1个电子的电量为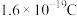 )
)
 盐酸及相同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出
盐酸及相同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出 的体积随反应时间的变化曲线,如图。
的体积随反应时间的变化曲线,如图。(1)根据图示可判断,甲同学所用未知浓度的盐酸的浓度比


(2)乙同学为控制反应速率,防止因反应过快而难以测量
 体积,且不改变生成
体积,且不改变生成 的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是
的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是A.蒸馏水 B.KCl溶液 C.
 溶液 D.
溶液 D. 溶液
溶液(3)丙同学用
 硫酸代替上述实验中的
硫酸代替上述实验中的 盐酸,二者的反应速率是否相同
盐酸,二者的反应速率是否相同(4)如果图中22.4mL是在标准状况下测得的气体体积,则在该过程中转移电子的电量是
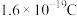 )
)
您最近一年使用:0次
2021-07-02更新
|
197次组卷
|
2卷引用:河北省保定市2020-2021学年高一下学期期末考试化学试题
解题方法
7 . 某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定____ 进行判断,其速率最快的是___ (填实验序号)
(2)实验1和2表明____ 对反应速率有影响;实验1和3表明____ 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
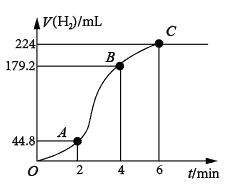
在OA、AB、BC三段中反应速率最快的是_______ ,其原因是_______
| 实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定
(2)实验1和2表明
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。

在OA、AB、BC三段中反应速率最快的是
您最近一年使用:0次
名校
8 . 用8.4gMgCO3与100mL稀盐酸反应制取少量的CO2,反应过程中生成的CO2的体积(已折算为标准状况)随反应时间变化的情况如图所示。已知:MgCO3在室温下溶解度为0.02g/100gH2O。

(1)写出反应的离子方程式___ 。
(2)___ 段(填“OE”“EF”或“FG”)的平均反应速率最快,可能的原因是___ 。
(3)EF段用HCl浓度的减小表示的该反应的平均反应速率为___ 。
(4)用等物质的量浓度的硫酸代替盐酸,反应速率将___ (填“加快”“减慢”或“不变”)。
(5)G点消耗HCl的物质的量为___ mol,在G点以后收集的CO2的量不再增多,原因是___ 。

(1)写出反应的离子方程式
(2)
(3)EF段用HCl浓度的减小表示的该反应的平均反应速率为
(4)用等物质的量浓度的硫酸代替盐酸,反应速率将
(5)G点消耗HCl的物质的量为
您最近一年使用:0次
名校
9 . 某研究性学习小组为了探究温度对H2O2分解速率的影响,设计了如图所示的实验装置反应温度通过调节水浴温度来控制(导管体积忽略不计)。
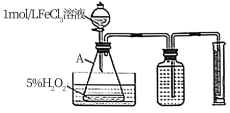
请回答下列问题:
(1)仪器A的名称是___ 。
(2)实验开始时,需要先向A中滴加1-2滴FeCl3溶液,FeCl3溶液的作用是__ 。
(3)实验开始后装置A中发生反应的化学方程式为___ 。
(4)该实验中判断不同温度下H2O2分解速率快慢的依据是___ 。
(5)相同条件下进行该实验,反应速率总是随着时间的推移而逐渐减慢。速率减慢的原因是__ 。

请回答下列问题:
(1)仪器A的名称是
(2)实验开始时,需要先向A中滴加1-2滴FeCl3溶液,FeCl3溶液的作用是
(3)实验开始后装置A中发生反应的化学方程式为
(4)该实验中判断不同温度下H2O2分解速率快慢的依据是
(5)相同条件下进行该实验,反应速率总是随着时间的推移而逐渐减慢。速率减慢的原因是
您最近一年使用:0次
2021-05-27更新
|
189次组卷
|
2卷引用:2020年山西省普通高中学业水平考试化学试题
20-21高一下·浙江·阶段练习
解题方法
10 . 已知锌与稀硫酸反应为放热反应,某学生为了探究其反应程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
(1)反应速率最大的时间段(即0~1 min、1 ~ 2 min、2~3 min、3~4 min、4~5 min)为___________ ,影响反应速率的因素是___________ 。
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水 B. CuCl2溶液 C. NaCl 溶液
你认为他上述做法中不可行的是___________ (填相应字母);做法中不可行的理由是___________ 。
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
(1)反应速率最大的时间段(即0~1 min、1 ~ 2 min、2~3 min、3~4 min、4~5 min)为
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水 B. CuCl2溶液 C. NaCl 溶液
你认为他上述做法中不可行的是
您最近一年使用:0次



