2021高三·全国·专题练习
解题方法
1 . 某兴趣小组在利用图所示装置做铜与稀硝酸反应的实验中,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。
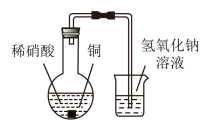
(1)图中铜与稀硝酸反应的离子方程式为___________ 。
(2)图中NaOH溶液能够吸收的有害气体是___________ 。
(3)小组同学提出了如下假设并设计实验探究:
I.甲同学认为反应速率变化的原因可能是反应放热导致溶液温度升高所致,故测定反应过程中溶液不同时间的温度,结果如下表:
结合实验目的和表中数据,你得出的结论是___________ 。
II.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的___________ (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。故得出结论:Cu2+并不是反应的催化剂
III.丙同学根据现象推测反应过程中还有少量______ 生成,进而认为该物质对反应有催化作用,如图所示,丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
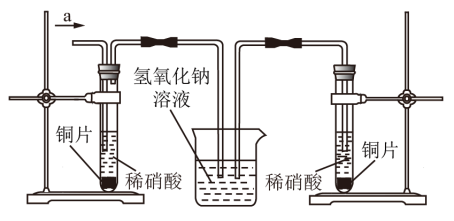
(4)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中Cu2+的浓度较高所致,另一部分同学认为是该溶液中溶解了通入的物质。丁同学设计了一个实验方案证明后者的推测更为合理。(在表格中写出该同学可能的实验操作和实验现象)

(1)图中铜与稀硝酸反应的离子方程式为
(2)图中NaOH溶液能够吸收的有害气体是
(3)小组同学提出了如下假设并设计实验探究:
I.甲同学认为反应速率变化的原因可能是反应放热导致溶液温度升高所致,故测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
II.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。故得出结论:Cu2+并不是反应的催化剂
III.丙同学根据现象推测反应过程中还有少量

(4)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中Cu2+的浓度较高所致,另一部分同学认为是该溶液中溶解了通入的物质。丁同学设计了一个实验方案证明后者的推测更为合理。(在表格中写出该同学可能的实验操作和实验现象)
| 操作 | 现象 |
您最近一年使用:0次
2023·全国·模拟预测
名校
解题方法
2 . 下列实验设计及现象、结论合理的是
| 选项 | 实验目的 | 实验设计及现象 | 结论 |
| A | 探究 是否具有还原性 是否具有还原性 | 向一定浓度的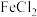 溶液中滴加少量酸性高锰酸钾溶液,高锰酸钾溶液紫红色褪去 溶液中滴加少量酸性高锰酸钾溶液,高锰酸钾溶液紫红色褪去 |  具有还原性 具有还原性 |
| B | 检验 气体中是否混有 气体中是否混有 | 将气体依次通过饱和 溶液和澄清石灰水,澄清石灰水变浑浊 溶液和澄清石灰水,澄清石灰水变浑浊 |  气体中混有 气体中混有 |
| C | 探究HA是否是弱电解质 | 测某温度下一定浓度NaA溶液的pH,pH>7 | HA是弱电解质 |
| D | 探究不同催化剂的催化效率 | 两支试管中分别盛相同温度、相同浓度、相同体积的 溶液,分别滴加相同浓度、相同体积的 溶液,分别滴加相同浓度、相同体积的 溶液与 溶液与 溶液,滴加FeCl3溶液得试管中产生气体更快 溶液,滴加FeCl3溶液得试管中产生气体更快 |  对 对 分解的催化效率更高 分解的催化效率更高 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-08更新
|
1098次组卷
|
4卷引用:全国卷(老教材)理综化学预测卷
(已下线)全国卷(老教材)理综化学预测卷广西北海市2024届高三一模考试化学试题(已下线)热点08 表格型实验方案的设计与评价2023届江西省南昌市第十九中学高三下学期第三次模拟考试理科综合试卷-高中化学
名校
3 . 下列实验目的、实验操作及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 验证肉桂醛中含碳碳双键 | 向肉桂醛(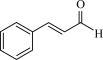 )中加入酸性KMnO4溶液 )中加入酸性KMnO4溶液 | 肉桂醛中含有碳碳双键 |
| B | 比较CuSO4和KMnO4的催化效果 | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4溶液和KMnO4溶液,CuSO4溶液产生气泡速率快 | CuSO4催化H2O2溶液分解效果更好 |
| C | 验证菠菜中含有铁元素 | 将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入几滴KSCN溶液,溶液不变红 | 说明菠菜中不含铁元素 |
| D | 判断强酸和弱酸 | NaHCO3溶液显碱性,NaHSO3溶液显酸性 | 可以确定H2CO3是弱酸,无法判断H2SO3是否为弱酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-19更新
|
800次组卷
|
2卷引用:陕西师范大学附属中学2022-2023学年高三下学期第十次模考理综化学试题
解题方法
4 . 下列实验方案设计、现象与结论都正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 探究Fe2+、Cu2+对H2O2溶液分解的催化效果强弱 | 在两支试管a、b中各加2 mL5%H2O2溶液,分别滴入0.1 mol•L-1FeCl3溶液和0.1 mol•L-1CuSO4溶液各0.5 mL | 若a中产生气泡快于b中,则说明Fe3+的催化效果强于Cu2+ |
| B | 探究Fe与水蒸气高温反应后固体产物中铁元素的化合价 | 取少量固体产物于试管中,加足量的稀硫酸溶解,分成两份:一份滴加几滴KSCN溶液,另一份少量滴加KMnO4溶液 | 若前者溶液变血红色,后者溶液紫色褪去,则固体产物中铁元素有+2、+3两种价态 |
| C | 探究油脂在碱性条件下的水解 | 在小烧杯中加入约5 g动物脂肪、6 mL95%的乙醇,再加入6 mL 40%的氢氧化钠溶液,微热一段时间后取少量溶液,加入新制氢氧化铜 | 若出现绛蓝色,则油脂已发生水解 |
| D | 探究Cu与硫酸的 反应 | 铜粉加入稀硫酸中,加热,再加入少量KNO3固体 | 未加KNO3固体前,无明显现象;加入KNO3固体后,产生大量气泡,则说明KNO3起催化作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 下列实验操作能达到实验目的的是
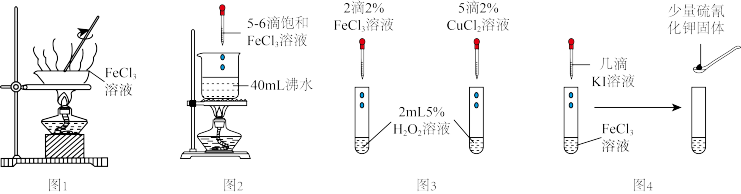

| A.图1:加热蒸干FeCl3溶液制备FeCl3固体 |
| B.图2:制备Fe(OH)3胶体 |
| C.图3:比较Fe3+、Cu2+对H2O2分解的催化效果 |
| D.图4:验证FeCl3与KI的反应是可逆反应 |
您最近一年使用:0次
2022-12-07更新
|
240次组卷
|
3卷引用:河南省2022-2023学年高三上学期12月联考化学试题
名校
6 . 下列实验装置和实验目的能相符合的是
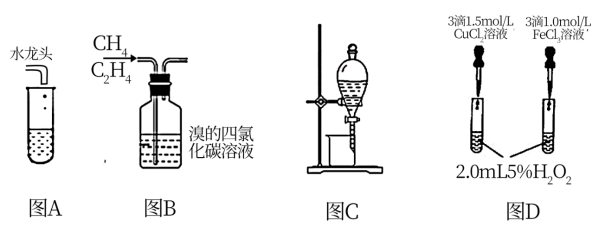

| A.图A装置可以验证Cu和浓硫酸反应后的产物 |
| B.图B装置可以去除甲烷中的杂质气体乙烯 |
| C.图C装置可以分离碘和CCl4的混合液体,提纯CCl4 |
| D.图D右侧装置产生气泡速度较快,可以说明FeCl3对H2O2的催化效果更好 |
您最近一年使用:0次
2021-05-05更新
|
648次组卷
|
2卷引用:黑龙江省哈尔滨市第九中学2021届高三第二次模拟考试理科综合化学试题
名校
7 . 下列装置正确,且能达到实验目的的是
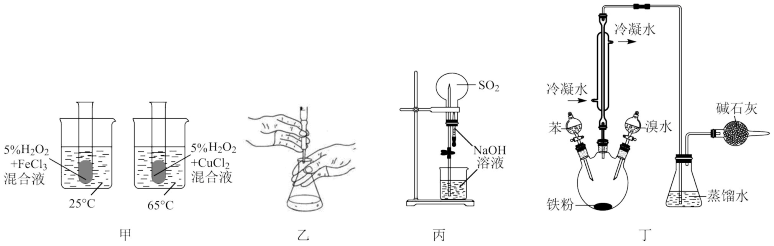

| A.图甲探究温度对过氧化氢分解速率的影响 | B.图乙装置用K2Cr2O7溶液滴定FeSO4溶液 |
| C.图丙装置进行喷泉实验 | D.图丁装置制粗溴苯 |
您最近一年使用:0次
名校
解题方法
8 . 某校化学小组探究 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
(1)对比实验i、ii、iii,说明反应速率与___________ 有关。
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于 ,淡黄色固体是
,淡黄色固体是___________ 。
(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是___________ ,但实验中溶液始终没有变蓝。
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是___________ 。
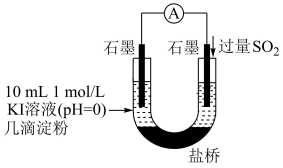
(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
根据(2)(4)(5)的实验现象,结合化学反应原理解释实验iv中始终未检测到单质碘的原因是___________ 。
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是___________ 。
实验结果证实了猜想,则总反应的化学方程式是___________ 。
 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):| 实验 | 实验操作 | 实验现象 |
| i | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至量 至量 | 溶液慢慢变为浅黄色 |
| ii | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至过量 至过量 | 溶液迅速变为黄色,略有浑浊 |
| iii | 取 淀粉 淀粉 溶液 溶液 (用盐酸酸化至 (用盐酸酸化至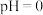 ),通入 ),通入 至过量 至过量 | 溶液迅速变为黄色,有浑浊 |
| iv | 将实验iii中的黄色浊液进行离心分离 | 试管壁上附着淡黄色固体,溶液为黄色 |
(1)对比实验i、ii、iii,说明反应速率与
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于
 ,淡黄色固体是
,淡黄色固体是(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是

(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
| 实验 | 实验操作 | 实验现象 |
| v | 将 通入蓝色的碘淀粉混合溶液中 通入蓝色的碘淀粉混合溶液中 | 溶液蓝色迅速褪去 |
| vi | 取实验iv离心后的黄色溶液少量,加入盐酸酸化的 溶液 溶液 | 生成白色沉淀 |
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中
 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是实验结果证实了猜想,则总反应的化学方程式是
您最近一年使用:0次
名校
解题方法
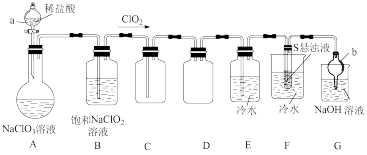
9 . 二氧化氯常用作氧化剂、脱臭剂、保鲜剂、漂白剂等。因其具有对人体及动物无害以及对环境不造成二次污染等特点备受人们青睐。某实验室设计如图装置制取并收集 且探究其性质。
且探究其性质。
已知:
① 是一种易溶于水的黄绿色气体,与冷水几乎不反应,与热水能反应,其熔点
是一种易溶于水的黄绿色气体,与冷水几乎不反应,与热水能反应,其熔点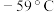 ,沸点
,沸点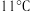 ,受热易分解;
,受热易分解;
②稀盐酸与 反应或
反应或 与
与 溶液反应均可制取
溶液反应均可制取 。
。
回答下列问题:
(1)仪器b的名称是___________ 。
(2)装置A中发生反应: +
+___________ 
 ,滴加稀盐酸时,应缓慢滴加,其主要原因是
,滴加稀盐酸时,应缓慢滴加,其主要原因是___________ 。
(3)根据(2)试分析装置B的作用:___________ (用化学方程式说明)。
(4)装置F中可得到两种强酸的混合溶液,该装置中的现象为___________ ,反应的化学方程式为___________ 。
(5)已知在酸性条件下 可发生反应生成
可发生反应生成 并释放出
并释放出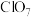 ,向
,向 溶液中滴加盐酸,反应剧烈,若将盐酸换成等
溶液中滴加盐酸,反应剧烈,若将盐酸换成等 的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因是
的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因是___________ 。
 且探究其性质。
且探究其性质。
已知:
①
 是一种易溶于水的黄绿色气体,与冷水几乎不反应,与热水能反应,其熔点
是一种易溶于水的黄绿色气体,与冷水几乎不反应,与热水能反应,其熔点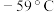 ,沸点
,沸点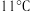 ,受热易分解;
,受热易分解;②稀盐酸与
 反应或
反应或 与
与 溶液反应均可制取
溶液反应均可制取 。
。回答下列问题:
(1)仪器b的名称是
(2)装置A中发生反应:
 +
+
 ,滴加稀盐酸时,应缓慢滴加,其主要原因是
,滴加稀盐酸时,应缓慢滴加,其主要原因是(3)根据(2)试分析装置B的作用:
(4)装置F中可得到两种强酸的混合溶液,该装置中的现象为
(5)已知在酸性条件下
 可发生反应生成
可发生反应生成 并释放出
并释放出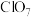 ,向
,向 溶液中滴加盐酸,反应剧烈,若将盐酸换成等
溶液中滴加盐酸,反应剧烈,若将盐酸换成等 的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因是
的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因是
您最近一年使用:0次
2022-09-12更新
|
171次组卷
|
2卷引用:河南省洛阳市第一高级中学2022~2023学年高三上学期9月月考化学试题
解题方法
10 . 铜和稀硝酸在无氧环境下会生成弱酸 。某实验小组为探究铜和稀硝酸的反应,设计实验装置如图。
。某实验小组为探究铜和稀硝酸的反应,设计实验装置如图。

实验过程现象记录如下表。
(1)仪器a的名称为_______ 。
(2)滴入硝酸前,为营造无氧环境,应进行的操作是_______ 。
(3)反应过程中产生的 会进一步与Cu反应生成NO,其离子方程式为
会进一步与Cu反应生成NO,其离子方程式为_______ 。
(4)溶液呈绿色是 和体系中某种微粒相互作用的结果,为探究该微粒进行下列实验:
和体系中某种微粒相互作用的结果,为探究该微粒进行下列实验:
根据以上实验现象可知, 和
和_______ (填化学式)相互作用达到平衡呈绿色。
(5)取适量150 min时反应液于试管中,加入_______ ,溶液由蓝色变为绿色,,说明150 min时反应液中含有 。
。
(6)结合平衡移动原理解释150~300 min反应液颜色变化的原因_______ 。
(7)基于上述装置,选择合适试剂,设计实验证明 对Cu与
对Cu与 硝酸的反应具有催化作用
硝酸的反应具有催化作用_______ (简述实验方案及观测指标)。
 。某实验小组为探究铜和稀硝酸的反应,设计实验装置如图。
。某实验小组为探究铜和稀硝酸的反应,设计实验装置如图。
实验过程现象记录如下表。
| 时间/min | 0~75 | 75~150 | 150~225 | 225~300 | 300~375 |
| 溶液颜色 | 接近无色 | 无色→浅蓝色 | 浅蓝色→绿色 | 绿色→深蓝色 | 浅蓝色 |
| 生成NO体积/mL | 0 | 1.0 | 42.0 | 137.5 | 0.5 |
| 反应体系温度/℃ | 26.6 | 26.8 | 26.8~27.2 | 27.2~28.8 | 28.8~28.6 |
(2)滴入硝酸前,为营造无氧环境,应进行的操作是
(3)反应过程中产生的
 会进一步与Cu反应生成NO,其离子方程式为
会进一步与Cu反应生成NO,其离子方程式为(4)溶液呈绿色是
 和体系中某种微粒相互作用的结果,为探究该微粒进行下列实验:
和体系中某种微粒相互作用的结果,为探究该微粒进行下列实验:| 序号 | 实验操作 | 现象 |
| a | 往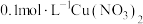 溶液中通入NO 溶液中通入NO | 溶液始终为蓝色 |
| b | 往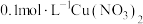 溶液中加入 溶液中加入 | 溶液变为绿色 |
| c | 往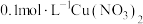 溶液中加入 溶液中加入 后逐滴加入 后逐滴加入 硝酸 硝酸 | 溶液先变为绿色后逐渐变为蓝色 |
 和
和(5)取适量150 min时反应液于试管中,加入
 。
。(6)结合平衡移动原理解释150~300 min反应液颜色变化的原因
(7)基于上述装置,选择合适试剂,设计实验证明
 对Cu与
对Cu与 硝酸的反应具有催化作用
硝酸的反应具有催化作用
您最近一年使用:0次



