1 . 反应;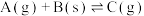
 ,在其他条件不变时,改变其中一个条件,则生成
,在其他条件不变时,改变其中一个条件,则生成 的速率(填“增大”、“不变”、“减小”):
的速率(填“增大”、“不变”、“减小”):
(1)升温_______ 。
(2)使用催化剂_______ 。
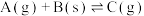
 ,在其他条件不变时,改变其中一个条件,则生成
,在其他条件不变时,改变其中一个条件,则生成 的速率(填“增大”、“不变”、“减小”):
的速率(填“增大”、“不变”、“减小”):(1)升温
(2)使用催化剂
您最近一年使用:0次
名校
解题方法
2 . 化学反应速率及平衡在生产生活中有重要作用。
已知反应
(1)小组同学发现反应速率总是如下图所示,其中 时间内速率变快的主要原因可能是:①该反应放热②
时间内速率变快的主要原因可能是:①该反应放热②___________

(2) 后反应速率逐渐减小的原因是
后反应速率逐渐减小的原因是___________ 。
已知反应

(1)小组同学发现反应速率总是如下图所示,其中
 时间内速率变快的主要原因可能是:①该反应放热②
时间内速率变快的主要原因可能是:①该反应放热②
(2)
 后反应速率逐渐减小的原因是
后反应速率逐渐减小的原因是
您最近一年使用:0次
解题方法
3 . 工业上合成氨是在一定条件下进行反应:N2(g)+3H2(g)  2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
反应体系中各组分的部分性质如下表所示:
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________ 。温度升高,K值___________ (填“增大”“减小”或“不变”)。
(2)K值越大,表明___________(填序号)。
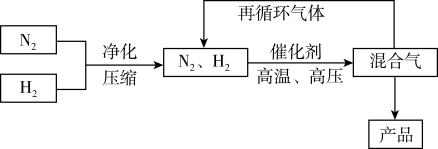
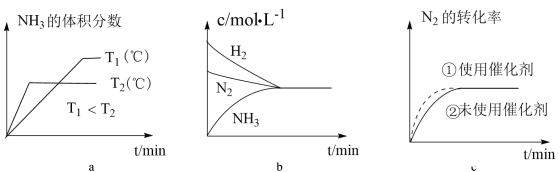
(3)对于合成氨反应而言,如图有关图像一定正确的是___________ (填字母)。
 2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
2NH3(g),ΔH=-92.4kJ·mol-1,其部分工艺流程如图所示。
反应体系中各组分的部分性质如下表所示:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点/℃ | -210.01 | -259.23 | -77.74 |
| 沸点/℃ | -195.79 | -252.77 | -33.42 |
(1)写出该反应的化学平衡常数表达式:K=
(2)K值越大,表明___________(填序号)。
| A.其他条件相同时N2的转化率越高 |
| B.其他条件相同时NH3的产率越高 |
| C.原料中N2的含量越高 |
| D.化学反应速率越快 |

您最近一年使用:0次
解题方法
4 . 氢气用于工业合成氨N2(g)+3H2(g) 2NH3(g);ΔH=-92.2kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5﹑t7时刻所对应的实验条件改变分别是
2NH3(g);ΔH=-92.2kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5﹑t7时刻所对应的实验条件改变分别是

t4___________ 。t5___________ 。t7___________ 。
 2NH3(g);ΔH=-92.2kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5﹑t7时刻所对应的实验条件改变分别是
2NH3(g);ΔH=-92.2kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5﹑t7时刻所对应的实验条件改变分别是
t4
您最近一年使用:0次
解题方法
5 . 对于反应 ,如下表所示,保持其他条件不变,只改变一个反应条件时,生成
,如下表所示,保持其他条件不变,只改变一个反应条件时,生成 的反应速率会如何变化?(在下表空格内填“增大”“减小”或“不变”)。
的反应速率会如何变化?(在下表空格内填“增大”“减小”或“不变”)。
 ,如下表所示,保持其他条件不变,只改变一个反应条件时,生成
,如下表所示,保持其他条件不变,只改变一个反应条件时,生成 的反应速率会如何变化?(在下表空格内填“增大”“减小”或“不变”)。
的反应速率会如何变化?(在下表空格内填“增大”“减小”或“不变”)。| 改变条件 | 升高温度 | 降低温度 | 增大氧气的浓度 | 使用催化剂 | 压缩容器体积 | 恒容下充入Ne |
生成 的速率 的速率 |
您最近一年使用:0次
2021-12-03更新
|
753次组卷
|
3卷引用:新疆巴楚县第一中学2021-2022学年高一下学期期中考试化学试题
新疆巴楚县第一中学2021-2022学年高一下学期期中考试化学试题人教2019版必修第二册第六章第二节 化学反应的速率与限度课后习题(已下线)6.1.2 影响化学反应速率的因素-2021-2022学年高一化学10分钟课前预习练(苏教版2019必修第二册)
解题方法
6 . NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为 ,为了控制大气污染,提出下列建议:
,为了控制大气污染,提出下列建议:
a.使用催化剂 B.改变压强 C.提高反应温度
你认为可行的方法是___________ ,理由是___________
 ,为了控制大气污染,提出下列建议:
,为了控制大气污染,提出下列建议:a.使用催化剂 B.改变压强 C.提高反应温度
你认为可行的方法是
您最近一年使用:0次
解题方法
7 . 影响化学反应速率的重要的外部因素有______ 、_______ 、______ 、_________
您最近一年使用:0次
2020-09-26更新
|
191次组卷
|
2卷引用:新疆阿克苏地区拜城县第一中学2021-2022学年高二上学期第一次月考化学试题
名校
8 . 某可逆反应:2A(g)⇌B(g)+D(g)在密闭固定容积的容器中4种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:

(1)实验1中,在10~20min内,以物质A表示的平均反应速率为_____ 。
(2)0~20min内,实验2比实验1的反应速率(“快”或“慢”)_____ ,其原因可能是_____ 。
(3)实验3比实验1的反应速率(填“快”或“慢”)_____ ,其原因可能是_____ 。
(4)从表中可以看出,t_____ 900(填“>”、“<”、“=”)。
(5)实验3中40分钟时υ(正)_____ υ(逆)(填“>”、“<”、“=”)。
(6)实验4中50分钟时B的浓度为_____ 。

(1)实验1中,在10~20min内,以物质A表示的平均反应速率为
(2)0~20min内,实验2比实验1的反应速率(“快”或“慢”)
(3)实验3比实验1的反应速率(填“快”或“慢”)
(4)从表中可以看出,t
(5)实验3中40分钟时υ(正)
(6)实验4中50分钟时B的浓度为
您最近一年使用:0次
名校
9 . 在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)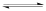 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
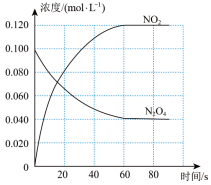
(1)反应的△H______ 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________ mol·L-1·s-1
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,10s又达到平衡。T_______ 100℃(填“大于”“小于”)。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______ (填“正反应”或“逆反应”)方向移动
(4)再次到达平衡后,向容器中加入合适的正催化剂,则v正_______ v逆_______ ,(填“增大”、“减小”或“不变”),体系的颜色_______ (填“变深” “变浅”或“不变”)。
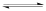 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,10s又达到平衡。T
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向
(4)再次到达平衡后,向容器中加入合适的正催化剂,则v正
您最近一年使用:0次
名校
10 . 过氧化氢(H2O2)俗名双氧水,常温下是一种无色的液体,它难电离,易分解。作为一种经典化工产品,工业上早在一百多年前便开始生产。随着社会需求的增长,尤其是生态环境保护的需要,过氧化氢近年来更受人们的器重,并被称为“绿色氧化剂”。为了储存、运输、使用的方便,工业上采用醇析法将其转化成固态的过碳酸钠晶体(化学式为:2Na2CO3·3H2O2),俗称固体双氧水,该晶体具有Na2CO3和H2O2的双重性,常用作洗涤剂和消毒剂。根据所学化学的相关知识,回答下列问题:
(1)H2O2的电子式______________ ,该消毒剂的消毒原理与_________ 相同。
(2)过碳酸钠溶液可以去油污,写出其溶液呈弱碱性离子方程式________________ 。
(3)该洗涤剂中的有效成分可以将废水中的氰化钠(NaCN)转化为两种无毒的物质,反应的离子方程式为_____ 。
(4)如果这种洗涤剂在含有铁离子的水中使用,不仅会削弱洗涤剂的去油污的能力,甚至完全失去杀菌作用,结合离子方程式 和相应文字表述说明原因___________________ 。
(1)H2O2的电子式
(2)过碳酸钠溶液可以去油污,写出其溶液呈弱碱性离子方程式
(3)该洗涤剂中的有效成分可以将废水中的氰化钠(NaCN)转化为两种无毒的物质,反应的离子方程式为
(4)如果这种洗涤剂在含有铁离子的水中使用,不仅会削弱洗涤剂的去油污的能力,甚至完全失去杀菌作用,结合
您最近一年使用:0次



